环境激素联合冷刺激诱导建立慢性少精子症大鼠模型的实验研究*
2019-08-02美合日古丽萨塔尔张盼盼王天宇艾孜孜热合曼蒋丹丹斯依提阿木提阿地力江伊明
美合日古丽·萨塔尔 张盼盼 王天宇 艾孜孜·热合曼蒋丹丹 斯依提·阿木提 阿地力江·伊明*
新疆医科大学基础医学院人体解剖学教研室(乌鲁木齐 830011)
由于环境因素、工作压力、行为模式和饮食结构的改变,人类的生殖健康面临着巨大的威胁。有文献报道[1,2],近50年来人类精子质量不断下降,成年男性精液量及精子数量下降了近50%,且呈继续下降趋势。因此,少精子症的研究亦越来越受到诸多学者的广泛关注[3,4]。环境雌激素(environmental estrogens,EEs)及冷刺激可直接或间接影响动物生殖系统,但具体不详,有关模型更是鲜有报道。故本研究以3种雌激素样饲料分别联合冷刺激复合干预的方法,就诱导慢性少精子症大鼠模型进行了研究,并从精子浓度、精子活率改变,睾丸及附睾形态学变化,以及Johnson评分,对少精子症模型进行了综合评价,初步确定了最佳建模方法,并围绕其性腺轴内分泌激素的改变进行了初步的机制探讨,为基于该模型基础上的基础与应用研究奠定了基础。
材料和方法
一、实验动物
性成熟雄性SD大鼠84只,平均质量(220±10)g,由新疆医科大学实验动物中心提供。
二、主要仪器与试剂
冷凝机、DRS-09A型超声波加湿器(杭州多乐信电器有限公司)、BS-1150型电子天平(北京赛多科斯天平有限公司)、Carl Zeiss多功能扫描电子显微镜 (德国蔡司公司)。M199细胞培养液(HyClone公司,批号:No.SH30253.01)、水合氯醛 (索来宝公司,批号:No.327D021)。
饲料配制:特殊饲料A为70%常规大鼠饲料与15%菠菜实、15%芫荽实,饲料B为70%常规大鼠饲料与30%的芫荽实,饲料C为70%常规大鼠饲料与30%菠菜实。
三、实验方法
(一)实验分组与动物模型的建立
随机取12只正常雄性大鼠为正常对照组(N组),余72只为造模组A、B、C组。A饲料+冷刺激组(简称A组),B饲料+冷刺激组 (简称B组),C饲料+冷刺激组(简称C组),每组24只。N组大鼠常规饲养,温度为(25±2)℃,湿度为(55±5)%,造模组大鼠置于气候箱[温度 (10±2)℃、 湿度 (75±5)%] 的环境中饲养,9:00~19:00放入。干预24周后,检测各组大鼠精子浓度,分别筛选出精子浓度低于N组50%的少精子症大鼠模型,分别设为 A2、B2、C2组,未成模者设为 A1、B1、C1组。
(二)取材
建模24周后,7%水合氯醛(5 mL/kg)腹腔注射麻醉大鼠,腹主动脉采血,离心取上清。取双侧睾丸、附睾分别称量,一侧睾丸与附睾常规光、电镜标本固定。取另一侧附睾尾,在M199培养液中 (含有2%BSA)剪碎,37℃孵育15min,参照《人类精液检查与处理实验室手册》(第5版)[5]进行精子计数并计算精子浓度。然后按照文献[6]进行睾丸Johnson评分。
(三)血清激素水平检测
按照放免试剂盒说明书对大鼠睾酮 (T)、雌二醇(E2)、黄体生成素(LH)、促卵泡激素(FSH)和催乳素(PRL)进行检测。
四、统计分析
采用SPSS22.0进行统计分析,计量资料用均数±标准差(±s)表示,多组间比较采用单因素ANOVA分析,两两比较采用LSD法进行检验,计数资料以百分比(%)表示,组间率的比较采用卡方检验,以P<0.05为差异有统计学意义。
结 果
一、各组精子浓度、活率、运动能力变化及成模率结果
结果显示,A、B、C 3组大鼠精子浓度与活率较N组均显著降低(P<0.05,P<0.01),提示,A、B、C 3 种均可导致大鼠精子浓度与活率显著降低(表1)。经按照低于N组50%作为标准筛选少精子症模型后,A、B、C 3组成模率分别为 28.6%、38.1%、28.6%。 A2、B2、C2组大鼠精子浓度、活率及运动能力均显著低于N组(P<0.01),提示,在形成少精子症同时,出现了精子运动力减弱,同时,B2组精子浓度显著低于 A2、C2组(P<0.05,表 2,图 1)。
表1 各组大鼠精子浓度、精子活率变化(±s)

表1 各组大鼠精子浓度、精子活率变化(±s)
注:与 N 组比较 *P<0.05,**P<0.01;与 B 组比较 △P<0.05,△△P<0.01
N组 A组 B组 C组精子浓度(×106/mL) 17.06±5.03 11.94±4.88* 11.70±7.68* 11.92±7.84*精子活率(%) 52.52±14.72 21.96±3.83** 12.12±3.76** 19.61±5.07**
表2 各组大鼠精子浓度、运动能力及活率变化(±s)

表2 各组大鼠精子浓度、运动能力及活率变化(±s)
注:与 N 组比较 *P<0.05,**P<0.01;与 B2组比较 △P<0.05,△△P<0.01
A组 B组 C组A1组 A2组 B1组 B2组 C1组 C2组精子浓度(×106/mL) 17.06±5.03 14.81±4.77 8.09±1.41**△ 19.50±5.80 4.39±2.96** 17.52±7.14 8.32±1.89**△精子活率(%) 52.41±14.72 39.10±15.89 34.83±10.78** 39.71±16.08 27.06±17.56** 38.44±16.13 32.09±8.62**精子运动能力(%) 28.86±10.35 17.42±19.43 13.15±7.19** 18.36±14.15 12.45±9.96** 11.65±10.04* 10.65±7.79**N组
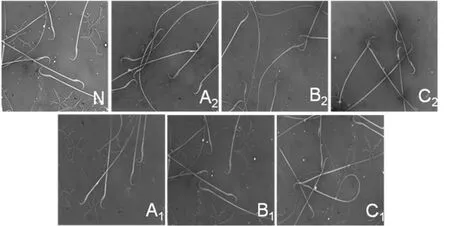
图1 各组大鼠精子伊红-苯胺黑染色图
二、睾丸、附睾质量结果
睾丸质量A2、B2、C2组显著低于N组差异具统计学意义(P<0.05,P<0.01,P<0.05),B2组显著低于 A2、C2组(P<0.01)。 附睾重量 A2、B2、C2组显著低于 N 组 (P<0.015,表 3,图 2、3)。
表3 N及模型组大鼠睾丸和附睾质量变化(±s)

表3 N及模型组大鼠睾丸和附睾质量变化(±s)
注:与 N 组比较 *P<0.05,**P<0.01;与 B2组比较 △P<0.05,△△P<0.01
N组 A2组 B2组 C2组睾丸(g) 1.75±0.19 1.34±0.46*△△ 0.80±0.33** 1.39±0.40*△△附睾(g) 0.82±0.07 0.61±0.08** 0.55±0.07** 0.63±0.17**

图2 N组及模型组大鼠睾丸大小
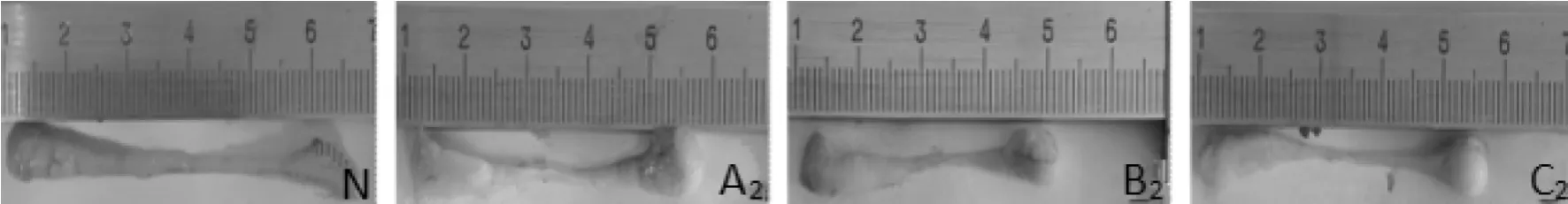
图3 N组及模型组大鼠附睾大小
三、睾丸、附睾光镜观察结果
N组睾丸、附睾光镜下组织形态结构正常。A2、B2、C2组睾丸各级生精细胞排列紊乱,生精细胞、精子及间质细胞数量均减少,其中B2组生精细胞与精子数量减少最为明显。A2、B2、C2组附睾管腔内精子数量减少,其中B2组附睾管壁明显增厚,管腔内精子数量也明显减少(图4、5)。

图4 N组及模型组大鼠睾丸H-E染色结果

图5 N组及模型组大鼠附睾H-E染色结果
四、大鼠睾丸、附睾电镜观察结果
N组睾丸、附睾组织形态结构均正常。A2、C2组睾丸生精小管内见少量精母细胞和精子细胞及少量精子,少量生精细胞核消失,异染色质增多,支持细胞数量减少。少量线粒体出现空泡样变。B2组睾丸生精小管内可见精原细胞、精母细胞核固缩,支持细胞核溶解并数量减少。A2、C2组附睾静纤毛排列较整齐,细胞间隙增大,管腔内精子数量减少;B2组附睾静纤毛排列紊乱,细胞间隙明显增大,且管腔内精子数量极少(图 6)。

图6 N组及模型组大鼠睾丸、附睾电镜结果(×2500)
五、大鼠睾丸Johnson评分结果
A2、B2、C23组睾丸 Johnson评分结果显著低于 N组,差异具统计学意义(P<0.01);同时,B2组亦显著低于 A2和 C2组,差异具统计学意义(P<0.01,表 4)。
表4 N及成模组大鼠睾丸Jonhsen评分结果(±s)

表4 N及成模组大鼠睾丸Jonhsen评分结果(±s)
注:与 N组比较 *P<0.05,**P<0.01;与 B2组比较△P<0.05,△△P<0.01
组别 Jonhsen评分N 组(n=15) 9.10±0.78 A2 组(n=15) 5.30±1.05**△△B2 组(n=15) 3.10±0.99**C2 组(n=15) 5.70±0.94**△△
六、血清激素水平检测结果
B2组T水平较N组T水平显著降低,E2水平显著升高差异均具统计学意义(P<0.01)。FSH、PRL水平B2亦较N组亦显著升高(P<0.05,P<0.01)。LH水平B2组较N组升高,但差异无统计学意义(P>0.05,表5)。
表 5 血清 T、E2、LH、FSH、PRL 水平变化(±s)
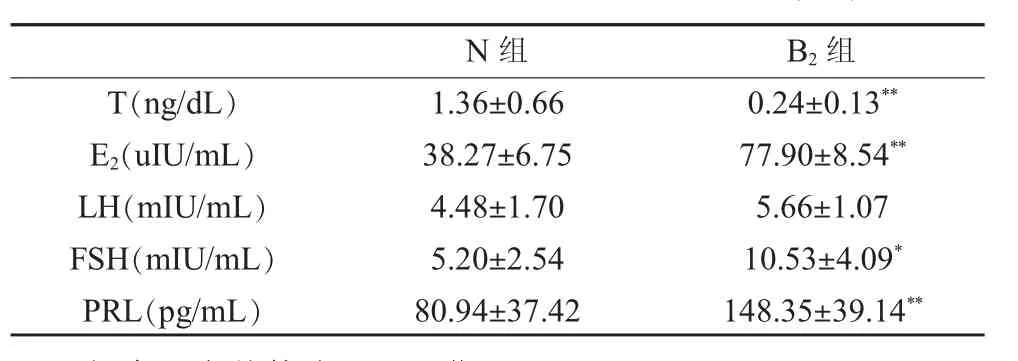
表 5 血清 T、E2、LH、FSH、PRL 水平变化(±s)
注:与 N 组比较,*P<0.05,**P<0.01
N组 B2组T(ng/dL) 1.36±0.66 0.24±0.13**E2(uIU/mL) 38.27±6.75 77.90±8.54**LH(mIU/mL) 4.48±1.70 5.66±1.07 FSH(mIU/mL) 5.20±2.54 10.53±4.09*PRL(pg/mL) 80.94±37.42 148.35±39.14**
讨 论
不孕不育症的发生约为育龄夫妇的10%~15%,其中男性因素占40%~60%[7,8]。文献研究表明[9]精液异常导致的男性不孕不育约占70%~80%,其中少精子症、弱精子症和少弱精子症分别占男性不孕不育的10%、30%和40%~50%[10-12]。在众多因素当中由于环境因素的影响,男性无精子症、少精子症、少弱精症等疾病的发生率逐年增加[13]。因此,开展该领域的研究具有重要意义。同时,因伦理因素,很多研究需要借助动物模型来开展,故建立与临床吻合度较高,且具有良好的科学性、稳定性的动物模型成为必须。
常见的环境因素包括电离辐射、重金属污染、环境激素污染与气温因素等等[14]。这其中EEs是一类对男性生殖系统影响最大的外源性内分泌干扰物之一,包括合成性EEs、植物性EEs及真菌性EEs等[15]。而作为环境因素中的气温因素,即冷、热刺激对人类的健康亦有着不同的影响,尤其长期的寒冷环境,可对生殖健康带来不同程度的损伤,秋冬季节更是心、脑血管等疾病的高发季节[16,17]。考虑到以上因素,本研究分别选用富含异黄酮、雌二醇、雌三醇等植物雌激素的芫荽和菠菜等植物[18,19],制作3种雌激素样饲料,模拟了食源性植物雌激素污染,并联合冷刺激复合干预的方式,研究了3种条件下建立复合型少精子症模型的可行性和科学性,并在此基础上探讨了其可能的机制。
结果显示,A、B、C 3种条件下均会导致精子浓度显著降低,干预24周后A、B、C 3组大鼠精子浓度较N组均显著降低(P<0.05),并形成少精子症。关于少精子症模型的建立,目前采用腺嘌呤、环磷酰胺、棉酚、热应激等化学与物理方法较多[20],上述模型在一定程度上较好的解决了少精子症科学研究模型需求,同时也还存在与产生少精子症的实际环境条件的吻合度上尚有一定差距。而在少精子症的评价方面,学者们采取的标准也不尽一致,有学者以模型和正常对照组之间精子浓度具有显著性差异作为标准[21-23],也另有学者将精子浓度低于正常对照组的30%、20%设为少精子症模型标准[24,25]。而本研究,则在此基础上,结合WHO(第5版)对人类少精子症的诊断标准,参考学者张才田、Kesari等标准[26,27],以降低50%作为少精症模型的标准进行了筛选。结果显示,A、B、C 3组成模率分别为 28.6%、38.1%和28.6%,B2组明显高于其他两组,但经统计学处理,无显著性差异(P=0.744),这可能与样本量有关,尚需进一步研究来明确。精子浓度比较后可见,B2组大鼠精子浓度显著低于A2、C2组(P<0.05)。对男性生殖腺睾丸和精子的成熟器官附睾的研究结果显示,A2、B2、C23组睾丸和附睾的质量均显著降低 (P<0.05,P<0.01),与 A2、C2以 B2组最为显著(P<0.01)。 光、电镜下A2、B2、C23组睾丸和附睾均发生不同程度的病理性改变,且以B2组最为明显,表现为睾丸内生精小管内精子数量明显减少或无精子,见精原细胞、精母细胞核固缩,支持细胞核溶解并数量减少,大量线粒体出现空泡样变;附睾管内见极少量的精子,且静纤毛排列紊乱等改变。而Johnson评分结果显示,A2、B2、C23组均较N组显著降低 (P<0.01), 同时,B2组显著低于A2、C2组(P<0.01)。对上述各项指标综合分析后,笔者认为,上述3种不同雌激素样饲料联合冷刺激的方法均可建立少精子症模型,但其中芫荽实联合冷刺激的方法效果最佳,具有成模率高,精子数量减少显著,病理变化明显等特点。
性腺轴激素检测结果显示,B2组T水平较N组显著降低(P<0.01),E2水平较 N 组显著升高(P<0.01),FSH、PRL 水平亦显著升高(P<0.05,P<0.01)。 提示芫荽实联合冷刺激致大鼠精子数量减少并最终发展为少精子症,同时伴发弱精子症的机制可能与T水平降低、E2水平升高,并引发性腺轴功能紊乱有关。具体机制而言,可能和EEs竞争性的结合在E2受体上,抑制负反馈调节作用,促进正反馈调节LH的分泌,进而刺激E2的分泌有关[28],同时睾丸细胞暴露在高雌激素环境时,类固醇合成酶的表达下降,亦可导致T水平进一步降低[29];另外也有可能与EEs促进PRL、性激素结合蛋白的表达和分泌,使抑制素B及雄烯二酮水平降低,扰乱激素的平衡[30],并因长期冷刺激,引发慢性应激反应,进一步导致性腺轴激素紊乱,并最终导致生殖功能损伤有关,但尚需进一步研究予以论证。
综上所述,上述3种不同雌激素样饲料联合冷刺激的方法均可建立少精子症模型,但其中以芫荽实联合冷刺激的方法效果最佳,其具体发生机制和性腺轴内分泌功能改变有关。该模型且较好的模拟了少精子症的慢性发病过程,为基于该模型的基础上的基础与应用研究奠定了良好的基础,并为环境复合因素作用下少精子症及少弱精子症的发病机制研究开拓了新的思路。
