杂交手术治疗Stanford A型主动脉夹层
2019-08-01石烽王志维吴红兵任伟吴智勇
石烽 王志维 吴红兵 任伟 吴智勇
武汉大学人民医院心血管外科(武汉430060)
主动脉夹层(aortic dissection,AD)是一种极其凶险的大血管疾病,起病急骤,病死率高,未经治疗的急性AD患者发病24 h内每小时病死率为1%~2%,死亡原因多为AD破裂引起的大出血猝死[1]。急性Stanford A型主动脉夹层破口从升主动脉延伸至降主动脉,需进行深低温停循环弓部置换手术,但此方式手术创伤大,术后恢复时间长。2010年,BAVARIA等[2]提出的主动脉弓部血管重建联合胸主动脉腔内修复术,即杂交手术,其可以在同一单元、同一时间将血管介入治疗、外科手术治疗和及时的影像学诊断一气呵成,打破学科壁垒,体现了学科交叉的优势,创新了医疗服务模式,为患者提供了完整、系统的科学治疗,是AD领域发展的最新趋势[3]。且杂交手术术中无需替换病变的主动脉弓,避免了深低温停循环过程,相较于传统的全弓替换手术,杂交手术时间短、创伤小、术后恢复快,已在临床中得到应用。有报道显示[4],最近几年我国AD支架植入率达99%,杂交手术逐渐演变成现代血管外科治疗的主要趋势,它能有效处理夹层破口锚定区不足的问题。有研究发现[5],传统全弓替换手术因其手术创伤大,病死率居高不下,约为25%,而杂交手术完美的规避了深低温停循环造成的影响,显著提升了AD患者的存活率。自2016年1月至2018年11月,我中心进行了21例杂交手术,现对此21例杂交手术方式总结并与分析其临床效果。
1 资料与方法
1.1一般资料本组21例急性Stanford A型AD患者。男16例,女5例,平均年龄(57±12)岁。纳入标准:(1)年龄>45岁;(2)合并重大疾病及器官功能障碍,如冠心病、重度心功能不全、严重心律失常、脑卒中、肾功能不全、妊娠等;(3)有心血管病二次手术史。排除标准:(1)年龄<45岁;(2)无重大疾病及器官功能障碍,如冠心病、重度心功能不全、严重心律失常、脑卒中、肾功能不全、妊娠等;(3)无心血管病二次手术史。所有患者术前均经全主动脉CT血管成像(CTA)明确诊断为急性Stanford A型主动脉夹层,心脏彩色多普勒超声检查排除主动脉瓣疾病,所有患者均在发病急性期(<48 h)完成杂交手术。
1.2术前准备及麻醉方式入院后予以积极降压、控制心率、镇静、镇痛等对症处理,积极完善12导联心电图、心脏彩色多普勒超声、全主动脉CTA检查等术前检查及检验,做好术前准备。麻醉方式:采用快速诱导、气管插管静脉复合吸入麻醉。
1.3手术方式杂交手术分为两步,第一步完成主动脉弓部血管重建术,第二步行胸主动脉腔内修复术。按照MITCHELL等[6]提出的主动脉弓破口分区方法(图1),分为Z0区(原发破口位于主动脉根部至头臂干开口后缘),Z1(原发破口位于头臂干后缘与左颈总动脉后缘之间),Z2(原发破口位于左颈总动脉后缘与左锁骨下动脉后缘之间),Z3(原发破口位于左锁骨下动脉后缘至主动脉弓弯曲结束处),Z4(降主动脉起始处至远端降主动脉)。夹层原发破口位置不同,主动脉弓部血管重建的方法也不同。
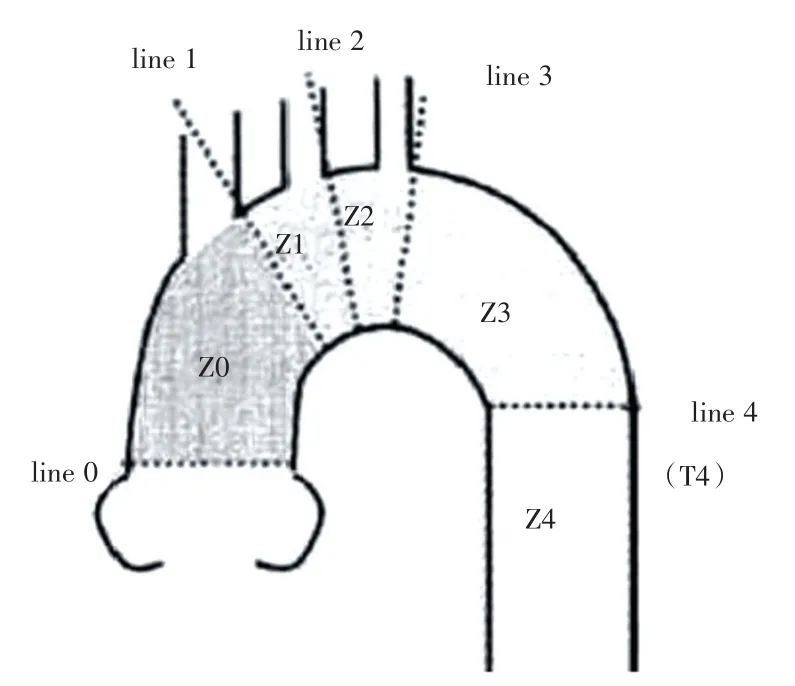
图1 主动脉弓分区Fig.1 Aortic arch partion
1.4主动脉弓部血管重建术
1.4.1Z0区主动脉受累取肩部垫高、颈部后仰卧位,暴露股动脉备用,行全胸骨正中切口,切开心包,游离暴露头臂干、左颈总动脉、左锁骨下动脉并分别套上橡胶带备用,经股动脉插供血管,上下腔静脉分别插管建立体外循环。降压后阻断升主动脉,切开主动脉根部,根据探查结果决定是否行主动脉瓣置换及冠脉开口移植。若主动脉瓣探查未见异常,取四分支人工血管近端端端吻合于主动脉窦管交界上方,人工血管主干远端吻合于头臂干开口近心端,完成升主动脉置换,夹闭人工血管各分支,开放阻断钳,经人工血管恢复体循环。四分叉人工血管的分支依次与左颈总动脉、头臂干及左锁骨下动脉下端行端端吻合(图2),吻合一支开放一支,于人工血管最上方开口处作银夹标识。
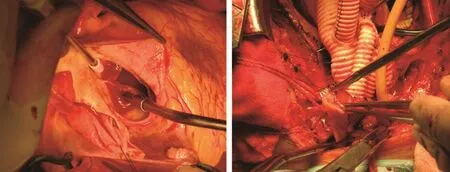
图2 四分支人工血管行弓部去分支化Fig.2 Four branch vessel use in debranching of arch
1.4.2Z0区主动脉完好取胸骨正中切口,游离暴露弓部三分支血管并分别套带。于近心端双重结扎头臂干及左颈总动脉,在结扎线近心端和远心端分别用阻断钳夹闭并离断近心端头臂干和左颈总动脉,缝闭离断血管残端,再将“Y型”人工血管远端双分支分别与离断的远心端头臂干、左颈总动脉端端吻合,再通过人工血管行左颈总动脉-左锁骨下动脉血管旁路搭桥术,钳夹人工血管双分支,应用侧壁钳近升主动脉根部钳夹升主动脉,以“Y型”人工血管主干端侧吻合于主动脉窦管交接上方的升主动脉侧壁,完成弓部血管去分支化+左颈总动脉-左锁骨下动脉搭桥术(图3)。也可剪取“Y型”人工血管分支一段,端侧吻合于“Y型”人工血管主干分叉处,形成“三分支”血管。将人工血管三分支依次与左颈总动脉、左锁骨下动脉、头臂干吻合,人工血管主干近端处理同前,完成升主动脉-头臂干-左颈总动脉-左锁骨下动脉搭桥术(图4)。开放人工血管,在头臂干开口近端处做银夹标识。

图3 Y型人工血管行弓部去分支化Fig.3 Y model vessel use in debranching of arch
1.4.3Z1区手术方式若头臂干直径较细,则同Z0方法开胸重建左颈总动脉和左锁骨下动脉;若头臂干粗大,经胸骨上窝沿皮纹作弧形5~7 cm长切口,分离胸锁乳突肌,显露弓部三分支并套带,以人工血管行右颈总动脉-左颈总动脉-左锁骨下动脉搭桥术,于左颈总动脉开口近端做银夹标识。
1.4.4Z2区手术方式取左锁骨上窝弧形切口,方法同上,游离左颈总动脉-左锁骨下动脉,以8 mm人工血管行左颈总动脉-左锁骨下动脉搭桥术,左锁骨下动脉根部处理同上,于左锁骨下动脉开口近端处做银夹标识。完成弓部血管重建后,升温排气脱离体外循环,彻底止血后逐层关胸。
1.4.5Z3、Z4区手术方式由于Z3、Z4区夹层病变属于Stanford B型AD,与本文主题Stanford A型主动脉夹层不符,故暂不讨论。
1.5胸主动脉腔内修复术待主动脉弓部血管重建完成后,彻底止血。取腹股沟区切口显露股动脉,或穿刺桡动脉,经股动脉或桡动脉造影评估升主动脉三分支血管显影是否通畅。同时,造影确定内膜撕裂口位置及锚定区动脉直径、撕裂口上缘距主动脉弓头臂干、左颈总动脉、左锁骨下动脉开口距离。选取超过锚定区10%~15%直径的胸主动脉覆膜支架,控制性降压后经股动脉缓慢释放支架,保证支架头端覆盖主动脉弓部银夹标识处,再次造影确定主动脉真腔膨胀,假腔闭合良好,无内漏,支架无移位及扭曲,必要时可行脑部血管造影评估脑供血情况。
1.6术后随访杂交术后3、6、9个月以及每年随访,包括12导联心电图、心脏彩色多普勒超声、全主动脉CTA检查。全主动脉CTA扫描范围自颈部血管至股动脉,观察人工血管是否通畅,支架形态是否扭曲、变性,支架周围有无内漏,主动脉夹层假腔血栓机化情况和支架血管远端通畅性(图5),了解患者术后及出院后是否死亡、有无脑血管、肢体、脊髓缺血合并症。
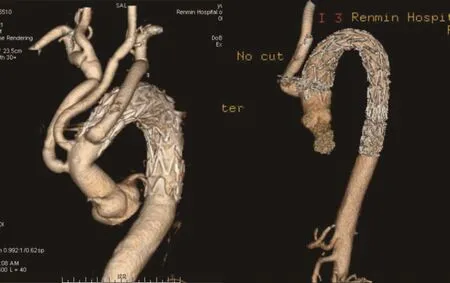
图5 不同杂交术式术后CTAFig.5 Different debranching methods of postoperative CTA
2 结果
2.1临床资料21例患者术后均治愈出院,未出现院内死亡。术中相关指标方面,体外循环时间(115±10.9)min,主动脉阻断时间(52±4.6)min。术后治疗方面,呼吸机辅助呼吸(15±3.2)h,监护室治疗(33±0.8)h。术后住院(14±1.9)d。
2.2术后并发症情况21例手术患者,1例出现神经系统并发症,表现为术后昏迷、谵妄、烦躁,未出现偏瘫、瞳孔变化等脑梗症状。1例患者术后肺部感染,1例术后并发急性肾衰,此患者术前全主动脉CTA显示夹层未累及肾动脉,术前肾功能未见异常,术后行血液透析治疗后肾功能明显改善,康复后出院。
2.3术后随访21例患者出院前1周及术后3、6、9个月、每年复查全主动脉CTA,平均随访(11±8.5)个月,失访2例,随访率为90.5%(19/21)。1例行弓部血管去分支化+降主动脉支架植入术患者在术后3个月复查全主动脉CTA时发现内漏,术后6个月随访时复查主动脉CTA提示内漏消失。1例行颈动脉-锁骨下动脉搭桥+降主动脉支架植入术患者术后6个月随访全主动脉CTA提示弓部夹层逆撕,入院行升主动脉+全主动脉弓置换,术后随访良好。其余患者随访全主动脉CTA与术前全主动脉CTA对比,主动脉真腔扩大,假腔消失,人工血管分支通畅,支架未移位、形态良好,支架周围无内漏,夹层破口封闭良好,假腔血栓完全机化,未出现夹层逆撕,复诊患者均未出现脑血管意外、偏瘫、肢体活动功能障碍等症状。
3 讨论
AD是血液从主动脉内膜破口进入中膜,并沿纵轴方向扩大致主动脉各层被剥离,进而形成局部血肿乃至血管破裂的状态,是一种具有灾难性后果的临床急症,由于其保守治疗有极高的病死率,故多需外科手术治疗。主动脉弓部有三个重要分支:头臂干、左颈总动脉、左锁骨下动脉,若夹层累及此处,因其解剖位置的特殊性,临床上处理较为困难,故长期以来对A型AD弓部的处理一直是主动脉外科研究的重要问题[7]。以前认为,升主动脉及全主动脉弓替换加支架“象鼻”术的最佳适应症是原发破口位于主动脉弓并撕裂至降主动脉的急性A型AD[8]。此方式治疗A型AD弓部病变已有20多年历史,但此方式手术时间长、创伤大、出血多,对术者要求高,同时导致神经系统并发症、肺部感染、急性肾衰等并发症[9]。外科手术素来坚持“简单实用”原则,对于破口近弓部分支的A型主动脉夹层,如何简化手术步骤、减小创伤、改善预后,一直在探索中[10]。近年来主动脉弓部血管重建联合胸主动脉腔内修复术的“杂交”手术因其相关并发症低,远期通畅率逐渐提高,应用也越来越广泛[11]。有关杂交手术治疗Stanford A型AD:
第一、杂交手术缩短手术时长。杂交手术通过开放手术进行弓部血管重建,从而为主动脉腔内隔绝修复术创建更合适的支架锚定区,避免了深低温停循环过程,缩短了体外循环降温复温的过程,缩短了手术时间,进而降低了手术出血风险和手术病死率[12]。本研究21例患者术后均未出现院内死亡,体外循环时间(115±10.9)min,主动脉阻断时间(52±4.6)min,呼吸机辅助呼吸(15±3.2)h,监护室治疗(33± 0.8)h,相较于本中心急性Stanford A型AD同期行深低温停循环下全弓替换手术体外循环时间(208±17.3)min,主动脉阻断时间(120±9.4)min,呼吸机辅助呼吸(21.3±6.3)h,监护室治疗时间(58±2.0)h,均显著缩短。
第二、杂交手术创新人工血管种类选择。若夹层累及升主动脉,需选择“四分支”人工血管在体外循环下完成升主动脉置换及弓部血管重建。若升主动脉完好,夹层仅累及头臂干至降主动脉,可选择“Y型”人工血管。使用“Y型”人工血管重建主动脉弓血管分支时,由于“Y型”血管远端两分支仅能与主动脉弓的头臂干、左颈总动脉吻合,主动脉弓的第三个分支血管——左锁骨下动脉,仅能行左颈总动脉-左锁骨下动脉搭桥术,此时左锁骨下动脉的供血完全来源于左颈总动脉,血流量较之前直接来源于主动脉弓的血流量较小,影响左侧上肢功能活动。故本中心创新人工血管种类,将“Y型”人工血管处理成“三分支”人工血管,行升主动脉-头臂干-左颈总动脉-左锁骨下动脉搭桥术,将人工血管的三分支与主动脉弓三分支血管行端端吻合,保障三分支血管的血流均来自主动脉弓,保障足够的血流量供应。
第三、术中脑保护。长时间体外循环是术后死亡的危险因素[13],并且深低温停循环增加炎性因子的激活,加重缺血再灌注损伤[14],对大脑及其他脏器损伤较大,故术中良好的脑保护尤为关键。本中心行主动脉弓部分支重建手术,有正中开口和和颈部横行切口两种。正中开胸手术方式,尽管切口较颈部切口大,但升主动脉-颈部血管重建的手术方式,使左颈总动脉血流直接来源于血流丰富的升主动脉,能减少神经系统并发症。主动脉弓部血管阻断后引起的热缺血是引起神经系统并发症的重要原因。本中心行弓部血管重建术中,通过灌注针头连通头臂干及左颈总动脉,保证弓部分支阻断期间血供不中断,避免了热缺血。本中心任伟等[15]已通过此方式行弓部血管重建术,术后患者神经系统并发症人数较全弓置换明显减少。本研究21例患者中,仅有1例出现术后谵妄症状,神经系统并发症发生率较低,与本中心术中脑保护有效相关。
第四、术后并发症。内漏和夹层逆撕是杂交手术不同于传统全弓置换手术的术后并发症[16]。内漏是指支架植入术后仍然有血液通过各种途径返流入假腔[17]。既往文献报道杂交全弓术后内漏发生率在0~15%之间[18],本研究仅1例术后3个月发生内漏,6个月后内漏消失。本中心对内漏的预防及处理经验:(1)术中依据造影结果积极应对,包括球囊扩张及短支架植入;(2)本中心自制的三分支人工血管与主动脉弓三分支吻合,避免了Ⅱ型内漏发生;(3)行胸主动脉腔内隔绝术时,保证支架近端锚定区预留2 cm以上,选取较锚定区直径大10%~15%直径的支架,防止Ⅰ型内漏发生。夹层逆撕是杂交手术术后严重并发症,由于杂交手术保留了受夹层累及的主动脉弓,术中损伤主动脉内膜、术后主动脉假腔闭合不佳、覆膜支架管径过大等原因引起主动脉弓部夹层逆撕[19-20]。本研究中出现1例行颈动脉-锁骨下动脉搭桥+降主动脉腔内隔绝术术后6个月全主动脉CTA提示弓部夹层逆撕,入院行升主动脉+全主动脉弓置换,术后随访良好。术前严格把握手术适应证,术中操作精准避免损伤主动脉内膜,仔细测量主动脉锚定区直径以选取合适尺寸支架是避免此类并发症的关键。
尽管杂交弓部血管重建手术避免了深低温停循环过程,在一定程度上缩短了手术时间,降低了手术风险率,但其应用于临床实践尚不久,开展此手术的中心较少,应注意其相关局限性:(1)腔内隔绝支架稳定性及远期效果有待大样本及长时间的考究;(2)术者需长期暴露于辐射范围中;(3)支架所导致的总住院费用上涨;这些问题也为以后的临床工作指明了方向。
综上,杂交手术治疗急性Stanford A型主动脉夹层,避免了高风险的深低温停循环,甚至无需体外循环辅助,手术时间缩短,创伤小,术后恢复快,术后早期临床效果满意,是主动脉夹层传统手术的很好补充,但远期效果仍需大样本和长期随访来进一步考证。
