阿托伐他汀通过MaxiK通道介导HepG2细胞焦亡
2019-08-01邓晶晶李婷婷张佳月张绍兰
邓晶晶 李婷婷 张佳月 张绍兰
成都医学院(成都 610500)
肝细胞性肝癌(hepatocellular carcinoma,HCC)是消化系统最常见的恶性肿瘤之一[1-3],大多数的肝癌患者在诊断时已经发生了肝内或肝外转移而无法进行手术[4-5],而单纯的放疗也只能针对肿瘤局部以及肿瘤周围组织,对远端的转移无法进行控制[6]。此外,肝癌也存在多药耐药现象,严重阻碍了化疗药物的治疗效果[3,7]。因此,如果能在分子层面探索和筛选新的药物靶点,将能够为肝癌治疗提供新的策略。
MaxiK通道,是细胞膜上一种钙离子激活的钾离子通道,有相关文献研究结果显示,其高表达对肝癌细胞的生长有显著的抑制作用[8]。而细胞焦亡是近年来发现的一种伴随炎症反应的细胞死亡方式,其发生依赖于半胱天冬氨酸蛋白酶-1(caspase-1)的激活[9-10]。CHU等[11]研究表明,在肝癌细胞中,其焦亡过程是受到抑制的,由此提示细胞的焦亡与肝癌的发病可能存在一定联系。
他汀类药物为临床上较为广泛使用的降血脂药,近年来流行病学研究发现他汀类药物的早期应用能够抑制肿瘤的发生、增殖及转移。也有研究报道称阿托伐他汀能够抑制癌细胞的生长,而其能否对肝癌细胞产生积极的作用尚未报道。
本实验通过人肝癌细胞HepG2的体外培养,检测阿托伐他汀对其增殖的影响,以确定阿托伐他汀是否能抑制其的增殖;以及对MaxiK通道的表达是否有影响。探究MaxiK通道在阿托伐他汀对HepG2细胞的作用,为肝癌的防治提供新的理论依据和治疗靶点。
1 材料与方法
1.1材料
1.1.1细胞将购自中国医学科学院基础医学研究所细胞资源中心的HepG2人肝癌细胞系根据阿托伐他汀干预浓度(干预时间2 h)分为4组:0 μmol/L组、10 μmol/L组、20 μmol/L组、40 μmol/L组。尔后,进一步将0 μmol/L组作为对照组,20 μmol/L组作为实验组,MaxiK抑制剂paxilline干预组作为paxilline组。
1.1.2试剂与仪器试剂:PBS、DMEM培养基购自Hyclone公司;胰酶、MaxiK抑制剂paxilline、胎牛血清购自Sigma公司;q-PCR引物由成都擎科梓熙生物技术有限公司合成;SYBRTMPremix Ex TaqTMⅡKit、RNase Free dH2O、逆转录试剂盒及PCR检测试剂盒购自TaKaRa公司;MaxiKα抗体购自圣克鲁斯生物技术有限公司;Caspase-1和IL-1β抗体购自Abcam公司;BCA蛋白定量试剂盒、全蛋白提取试剂盒购自北京索来宝公司;LDH由Sangon生物科技有限公司提供;阿托伐他汀由Nucien制药有限公司提供;Trizol购自Invitrogen公司;异丙醇溶液由天津致远化学试剂有限公司提供;氯仿溶液由上海生物工程有限公司提供。
仪器:倒置荧光显微镜(BH2-RFL-T3型,美国Thermo公司);细胞培养箱(美国Thermo Fisher Scientific公司);全自动生化分析仪(iMagic-M7型,深圳市库贝尔生物科技股份有限公司);离心机(JW-1024型,安徽嘉文仪器装备有限公司);水平摇床(北京六一仪器厂)电子分析天平(北京Sartorius公司)恒温水浴锅(DK-98-ⅡA型,天津市泰斯特仪器有限公司);96孔板和6孔板(美国Thermo公司);多功能酶标仪(美国Thermo Fisher Scientific公司);转模架(国产,批号:180-1903);立式自动压力蒸汽灭菌器(GR60DA型,致微(厦门)仪器有限公司);qPCR仪(美国Bio-Rad公司);电泳仪(DYY-111型,北京六一仪器厂);全自动凝胶成像分析仪(美国UVP公司);超净工作台(1389型,美国Thermo)。
1.2方法
1.2.1HepG2细胞的培养将细胞置于细胞培养箱中培养(37℃、5%CO2、相对湿度为95%),待细胞生长融合至80%~90%时,用PBS洗2遍后再用0.25%胰蛋白酶消化,1 000 r/min离心5 min后用培养基重悬细胞,并按1∶3将细胞悬液接种于培养瓶中,继续置于细胞培养箱中培养(培养条件不变)。选择生长状态良好的对数生长期细胞,用0.25%胰蛋白酶消化离心后重悬并计数,按1×105/mL和1×104/mL细胞数分别接种于6孔和96孔培养板中,根据分组给予不同浓度阿托伐他汀以及paxilline(2 μg/mL)干预,并进行后续实验。
1.2.2MTT实验检测细胞活性取对数生长期的HepG2细胞重悬液计数,按照1×104/mL细胞数接种于96孔板(每孔200 μL),置于细胞培养箱内培养至细胞贴壁(37℃,5%CO2、相对湿度为95%),更换培养基;分为4个实验组,每个实验组分别加入不同浓度的阿托伐他汀,每个浓度设6个复孔,将含有DMSO低于2.5%的培养基作为阴性对照组,实验重复6次;培养2 h后,每个样品孔加入20 μL浓度为5mg/mL的MTT溶液,于培养箱内继续培养4 h后,弃上清液,使用移液枪按每孔150 μL加入DMSO后置于孵箱中孵育30 min,在酶标仪上振荡10 min后测定490 nm处的OD值。
1.2.3乳酸脱氢酶释放实验HepG2细胞接种培养及干预同MTT实验,在每孔中加入50 μL的乳酸脱氢酶试剂和催化剂(1:45)的混合液,室温下培养30 min后加入终止试剂结束反应,放入自动生化分析仪中进行乳酸脱氢酶测定。
1.2.4q-PCR测HepG2细胞MaxiK表达水平对照组和实验组HepG2细胞的总RNA的提取采用Trizol法,再利用逆转录试剂盒逆转录为cDNA,采用q-PCR法进行基因扩增,用来测量MaxiK表达量。实验重复3次,以GADPH为内参基因,用2-ΔΔCt法处理数据。
1.2.5Western Blot检测HepG2细胞Caspase1和IL-1β含量取所提蛋白样品测浓度,对照组和实验组加样后用SDS-PAGE电泳进行分离,尔后再转至PVDF膜上,在室温条件下封闭1 h(5%脱脂奶粉TTBS溶液)。再用抗Caspase-1和IL-1β抗体(1∶200),抗GAPDH抗体(1∶3 000)孵育,置4℃冰箱过夜。洗膜后再用二抗孵育1 h(37℃),实验重复3次,然后置于UVP化学发光机中曝光并分析统计结果。
1.3统计学方法采用SPSS 19.0统计软件进行统计学分析,统计数据结果以(x±s)表示,两样本均数间的两两比较采用的是t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1阿托伐他汀能够剂量依赖性地降低HepG2细胞的活力通过对HepG2细胞采取不同浓度阿托伐他汀干预2 h后,通过MTT法检测发现所测OD值随着干预浓度增加而降低(表1,P<0.05)。结果表明,在相同的孵育环境下,阿托伐他汀干预浓度的增加会降低HepG2细胞的活力。
表1 MTT检测结果Tab.1 Results of MTT assay ±s

表1 MTT检测结果Tab.1 Results of MTT assay ±s
注:与0 μmol/L组比较,aP < 0.05,bP < 0.01;与20 μmol/L组比较,cP>0.05
分组0 μmol/L 10 μmol/L 20 μmol/L 40 μmol/L MTT(OD值)0.619 3±0.006 0.576 5±0.015a 0.318 7±0.037b 0.267 0±0.014c
2.2阿托伐他汀能够增加HepG2细胞Caspase-1和IL-1β表达以及LDH的释放HepG2细胞经20 μmol/L浓度阿托伐他汀干预2 h,通过Western blot检测发现:与对照组相比Caspase-1和IL-1β(图1A)在干预组表达明显增加。通过LDH释放试验发现:阿托伐他汀干预后的HepG2细胞LDH流出显著增加(P<0.05,图1B)。上述结果提示,阿托伐他汀诱导了HepG2细胞的焦亡。
2.3阿托伐他汀上调HepG2细胞MaxiK表达为了进一步探索阿托伐他汀降低对HepG2细胞活性影响的机制,本实验采用了qPCR检测方法对对照组和实验组HepG2细胞所提取的cDNA进行了检测。结果发现,与对照组相比,阿托伐他汀干预后HepG2细胞MaxiK表达水平显著增加(P<0.05,图2),提示MaxiK表达增加是阿托伐他汀降低HepG2细胞活性增加其焦亡的原因所在。
2.4抑制MaxiK能够降低HepG2细胞Caspase-1和IL-1β表达为了验证MaxiK对HepG2细胞焦亡的影响,利用MaxiK特异性抑制剂paxilline(2 μg/mL)对HepG2细胞进行干预,尔后通过Western blot技术进行检测。结果提示,抑制MaxiK后能够抑制HepG2细胞Caspase-1和IL-1β表达(图3)。这些结果提示,MaxiK通道介导了HepG2细胞的焦亡,并且通过抑制MaxiK通道的表达能够减少HepG2细胞焦亡。
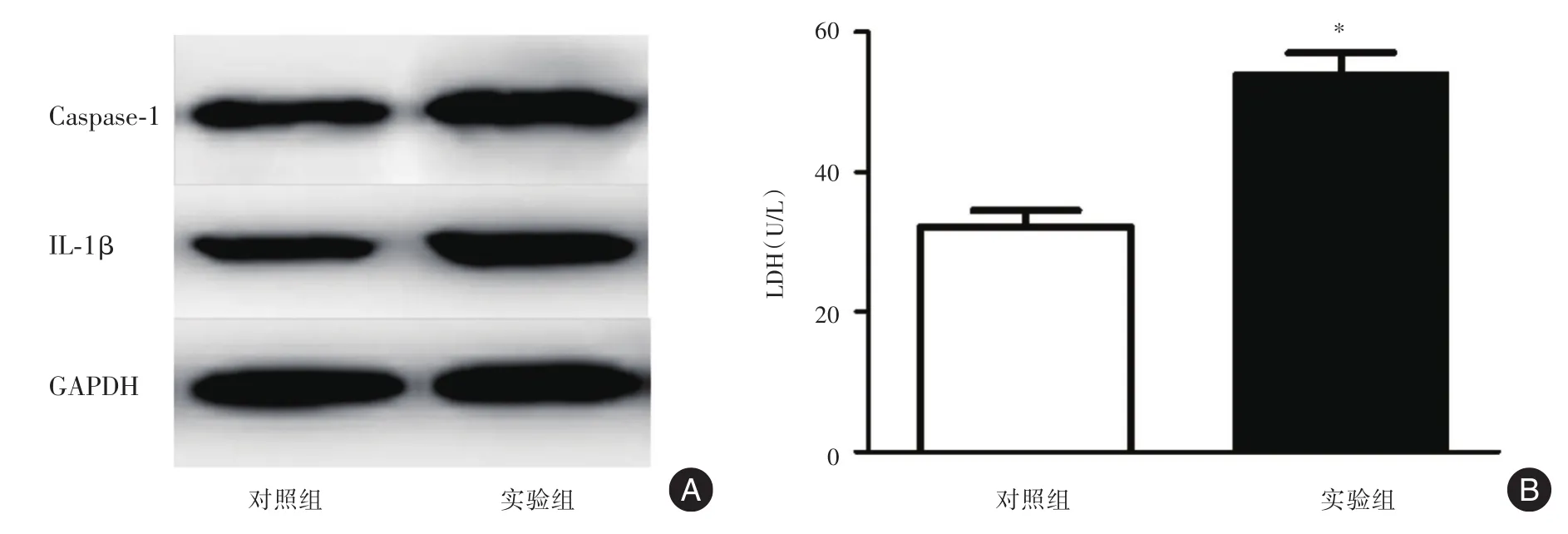
图1 阿托伐他汀增加HepG2细胞Caspase-1和IL-1β表达以及LDH的释放Fig.1 Expression of Caspase-1 and IL-1β and LDH in HepG2 cell treated by atorvastatin
3 讨论
我国每年死于肝癌的患者约有38.3万例,占世界因肝癌死亡人数的50%[12]。因此,深入研究和探索药物对抑制肝癌细胞活性的干预靶点和丰富肝癌的治疗措施是很有必要的。
在众多钾离子通道中,尤以MaxiK通道最为特殊,它是细胞膜上一种钙离子激活的钾离子通道,也是唯一能将机体细胞电信号和化学信号偶联的离子通道,参与了包括动作电位形成、激素分泌以及肌肉松弛等体内的多种生理过程[13-14]。近年来研究显示,MaxiK通道具有炎症反应“放大器”的功能特点,在机体的炎症反应中起着重要的作用[15-16];作为一类钾离子通道,它还通过细胞内外钾离子浓度的调节影响了T细胞的功能,加强其对肿瘤细胞的清除能力[17-18]。上述研究都提示了MaxiK通道与肿瘤细胞之间存在着一定关系,其可能成为一种新的肿瘤治疗药物的作用靶点。
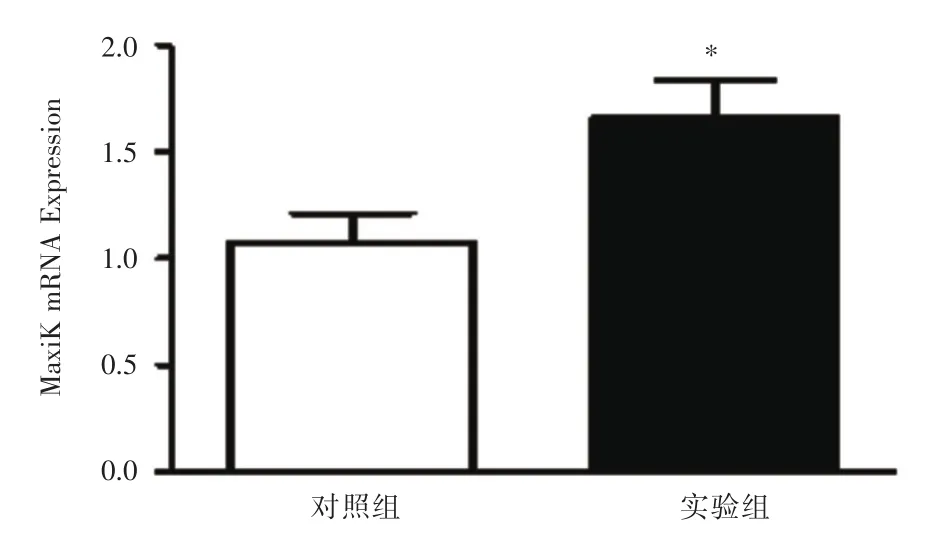
图2 阿托伐他汀上调HepG2细胞MaxiK表达Fig.2 Changes of MaxiK mRNA levels in HepG2 cells treated with atorvastatin

图3 抑制MaxiK能够降低HepG2细胞Caspase-1和IL-1β表达Fig.3 Expression of Caspase-1 and IL-1β in HepG2 cell treated by paxilline
有临床研究表明,他汀类药物除了能影响血清中的胆固醇水平,也可以抑制肿瘤细胞的生长、转移以及血管的生成[19],还可减少炎症因子TNF-α的表达[20]。此外,近年来流行病学研究发现,在慢性丙肝患者中,他汀类药物能够剂量依赖性地减缓肝纤维化的进程[21]。由于肿瘤的发生和进展与微环境有着密切联系,因此认为他汀类药物可能通过其抗炎、抗纤维化的作用发挥抗肝癌作用,但具体作用机制尚不明确。
既往报道大都集中在药物干预后对各类肿瘤细胞的凋亡、自噬等细胞死亡方式的研究上,而对与焦亡的关系上研究较少。在对细胞焦亡方式的研究中表明,介导caspase-1活化的炎性小体家族成员之一的NLRP3的激活可诱发肝脏炎症与纤维化,从而证明NLRP3炎性小体介导的肝细胞焦亡是肝脏损伤的一种新机制[22]。CHU等[11]的研究也表明,相对于正常细胞来说,在肝癌细胞中,caspase-1的mRNA和蛋白表达水平是明显降低的。上述研究都提示细胞的焦亡与肝癌的发病机制存在一定关系。
在本研究中,着重探索阿托伐他汀、MaxiK通道和HepG2细胞焦亡这三者之间的相互关系。通过在一定时间内观察阿托伐他汀浓度的变化对细胞的影响,结果发现其可剂量依赖性地降低肝癌细胞HepG2的活力,可见阿托伐他汀对肝癌细胞的增殖具有抑制作用。在进一步实验中还发现,阿托伐他汀能够上调MaxiK的表达,以及HepG2中细胞焦亡相关Caspase-1和IL-1β的水平;而在通过MaxiK特异性抑制剂paxilline对细胞的干预,观察到Caspase-1和IL-1β的表达明显减少,这两方面数据显示了抑制MaxiK通道会阻碍HepG2细胞的焦亡,从而明确了阿托伐他汀通过激活MaxiK通道来介导HepG2细胞的焦亡。但对于阿托伐他汀通过MaxiK途径介导HepG2细胞焦亡的作用机制尚未完全阐明,后续仍需要进一步探索。
综上所述,本研究验证了阿托伐他汀通过激活MaxiK通道来介导HepG2细胞的焦亡,为其成为有效的药物干预靶点,也为肝癌的防治提供了新的理论依据。
