慢性乙型肝炎病毒感染者Mg2+转运蛋白1表达水平对CD8+T细胞耗竭的影响
2019-08-01林晓娥吴景华王宁张勇谌晓楠祝朝前
林晓娥 吴景华 王宁 张勇 谌晓楠 祝朝前
唐山市工人医院1检验科,3肝胆外科(河北唐山063000);2华北理工大学附属医院检验科(河北唐山063000)
乙型肝炎病毒(hepatitis B virus,HBV)是一种嗜肝DNA病毒,具有较强的复制能力和感染能力,属于全球性公共卫生问题。感染HBV后机体会产生保护性免疫反应,可有效抑制HBV病毒的复制并清除病毒颗粒[1]。在机体抗病毒免疫反应过程中,CD8+T细胞扮演重要角色[2-3]。但是,在慢性HBV感染过程中却普遍存在T细胞功能缺陷的现象,致使最终出现肝硬化、肝功能衰竭、原发性肝癌等更为严重的肝脏疾病[4-5]。有研究[6]显示,在慢性HBV感染过程中T细胞功能缺陷主要由CD8+T细胞耗竭所致,而CD8+T细胞耗竭与其活化状态密切相关。Mg2+转运蛋白1(magnesium transporter protein 1,MagT1)是Mg2+选择性转运体,可调节细胞内自由Mg2+浓度,并介导Mg2+作为细胞内第二信使进行信号传导。研究证实,免疫细胞内Mg2+水平对维持NK和CD8+T细胞活化至关重要[7-8]。因此,在慢性HBV感染过程中MagT1表达异常有可能是导致CD8+T细胞耗竭的重要原因之一,国内外相关报道较少。本研究拟通过检测慢性HBV感染者CD8+T细胞中MagT1表达水平,分析其表达与CD8+T细胞耗竭的关系,旨为临床治疗慢性乙型肝炎提供新的理论依据和思路。
1 资料与方法
1.1一般资料选取2016年6月至2018年1月本院肝病门诊就诊的未经抗病毒治疗的HBV感染者86例作为研究对象,诊断符合中华医学会肝病学分会和中华医学会感染病学分会联合修订的《慢性乙型肝炎防治指南(2015年版)》中乙型肝炎的诊断标准[9],且患者无其他特殊病史,并排除其它类型肝炎病毒感染。根据实验室外周血HBV DNA检测结果,将HBV感染者分为高病毒载量组与低病毒载量组[10]。高病毒载量组共45例,其中男27例,女18例,年龄16~65岁,平均(43.15±11.35)岁,HBV DNA载量≥1.0×105copies/mL,血清HBsAg、HBeAg阳性,HBeAb阴性;低病毒载量组共41例,其中男24例,女17例,年龄15~63岁,平均(41.54±13.35)岁,HBV DNA载量<1.0×105copies/mL,血清 HBsAg、HBeAg阳性,HBeAb阴性。同时,另选取20例健康体检者作为健康对照组,其中男12例,女8例,年龄16~60岁,平均(40.37±15.11)岁。本研究获得本院伦理道德委员会批准。3组研究对象年龄、性别差异无统计学意义(P>0.05),具有可比性。
1.2仪器与试剂CD8+T细胞分离试剂盒购自Stemcell Technologies公司;兔抗人CD3单克隆抗体、兔抗人CD28单克隆抗体、兔抗人MagT1多克隆抗体和兔抗人GAPDH单克隆抗体均购自美国Abcam公司;FITC-anti-human CD279(PD-1)、APCAnti-human CD314(NKG2D)、PE/CF594-Anti-Human Tim-3、FITC-Anti-Human CD38均购自美国BD公司;Mag-Fura2-AM荧光探针购自美国Thermo Fisher Scientific公司;PrimeScriptTMRT Reagent Kit及SYBR®Green PCR Kit购自日本TaKaRa公司;全自动生化分析仪购自深圳迈瑞生物医疗电子股份有限公司。
1.3方法
1.3.1血样采集及CD8+T细胞分离与培养采集患者和健康体检者空腹外周血,采用密度梯度离心法分离外周血单核细胞,再按照试剂盒操作说明书操作,提取CD8+T细胞。将提取的CD8+T细胞重悬于含有10%胎牛血清的RPMI-1640培养基中,接种于6孔板中,分别加入1 mg/L刺激因子anti-CD3和anti-CD28,于继续培养的第4、7天再次加入等量刺激因子,并于10 d收集各组CD8+T细胞用于后续实验研究。
1.3.2外周血和CD8+T细胞中Mg2+含量检测取各组外周静脉血,分离血清,采用全自动生化分析仪检测血清中Mg2+浓度;取各组刚分离的CD8+T细胞,用无血清的RPMI-1640培养基洗涤细胞,取1.5×106/mL的细胞重悬于HEPES缓冲液(不含Mg2+和 Ca2+),加入 3 μmol/L 荧光探针 Mag-Fura4-AM溶液,37℃避光孵育30 min,加入预冷的HEPES缓冲液终止探针孵育,1 500 r/min离心5 min,弃上清,500 mL HEPES缓冲液重悬细胞,上机检测。
1.3.3实时荧光定量PCR法检测CD8+T细胞中MagT1 mRNA表达水平收集培养后的CD8+T细胞,采用Trizol法提取细胞总RNA,利用TaKaRa试剂盒将RNA逆转录成cDNA,再以cDNA为模板使用SYBR®Green PCR Kit进行PCR扩增,引物序列:MagT1 F:5′-ACCTAGCCGGAGCAAAGTTTC-3′,R:5′-CGTCGCAAACGATGAGCAG-3′;β-actin F:5′-CAGGGCGTGATGGTGGGCA-3′,R:5′-CAAACATCATCTGGGTCATCTTCTC-3′。PCR条件:94℃预变性60 s,94℃变性60 s,58℃退火60 s,72℃延伸60 s,共40个循环。以β-actin为内参,采用2-ΔΔCT法进行分析mRNA相对表达量。
1.3.4Western blot检测CD8+T细胞中MagT1蛋白表达水平收集培养后的CD8+T细胞,采用RIPA裂解液抽提细胞蛋白,BCA法进行蛋白定量,取15 μg蛋白进行上样,行SDS-PAGE凝胶电泳,并将蛋白转移至PVDF膜上,采用5%脱脂牛奶室温封闭 1 h,分别加入一抗 MagT1(1∶1 000)和GAPDH(1∶1 000),4℃孵育过夜,PBS洗涤后加入HRP标记的二抗,室温孵育30 min,加入ECL超敏发光液,置于全自动化学发光图像分析仪中曝光检测,用Image-Pro plus 6.0图像分析软件对各组图像条带进行分析,结果用相对表达量表示,即以目标蛋白灰度值/内参GAPDH灰度值。
1.3.5流式细胞术检测CD8+T细胞表面分子表达取各组刚分离的CD8+T细胞,用无血清的RPMI-1640培养基洗涤细胞,取1.5×105/mL的细胞重悬于PBS中,分别加入APC标记的CD314(NKG2D)抗体、FITC标记的CD279(PD-1)抗体、PE/CF594标记的Tim-3抗体以及FITC标记的CD38抗体,充分混匀后室温避光孵育30 min,加入预冷PBS终止反应,1 500 r/min离心5 min,弃上清,500 mL PBS重悬细胞,上流式细胞仪检测。采用FlowJo 7.6.1流式软件分析流式数据,结果以阳性细胞数占总细胞数的百分率表示。
1.4统计学方法采用SPSS 22.0统计分析软件进行统计学分析,计量数据以±s表示,多组间比较采用单因素方差分析,两组间比较采用非配对t检验,相关性分析采用Pearson相关分析法。以P<0.05为差异有统计学意义。
2 结果
2.1慢性HBV感染者外周血和CD8+T细胞中Mg2+浓度比较慢性HBV感染的两组感染者外周血Mg2+浓度与健康对照组比较差异无统计学意义(P>0.05)。与健康对照组比较,低病毒载量组和高病毒载量组CD8+T细胞中Mg2+浓度显著降低(P<0.05),并且高病毒载量组CD8+T细胞中Mg2+浓度显著低于低病毒载量组(P<0.05),见表1。
2.2慢性HBV感染者CD8+T细胞中MagT1蛋白和mRNA水平的比较与健康对照组比较,低病毒载量组和高病毒载量组CD8+T细胞中MagT1蛋白和mRNA水平均显著下调(均P<0.05);而高病毒载量组CD8+T细胞中MagT1蛋白和mRNA水平又显著低于低病毒载量组(均P<0.05),见表2。
表1 各组外周血及CD8+T细胞中Mg2+浓度比较Tab.1 Comparison of Mg2+concentrations in peripheral blood and CD8+T cells of each group ±s,μmol/L

表1 各组外周血及CD8+T细胞中Mg2+浓度比较Tab.1 Comparison of Mg2+concentrations in peripheral blood and CD8+T cells of each group ±s,μmol/L
注:与健康对照组比较,aP<0.05;与低病毒载量组比较,bP<0.05
组别健康对照组低病毒载量组高病毒载量组F值P值例数20 41 45外周血946.21±91.75 921.75±84.32 917.96±90.14 0.039 0.997 CD8+T细胞186.35±24.12 96.77±17.45a 45.36±9.57ab 97.356<0.001
表2 各组CD8+T细胞中MagT1蛋白和mRNA相对水平的比较Tab.2 Comparison of the relative protein and mRNA levels of MagT1 in CD8+T cells of each group ±s
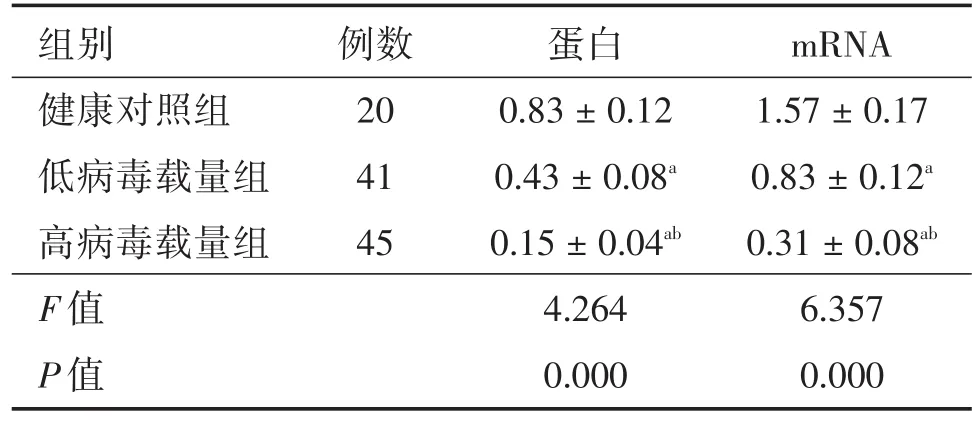
表2 各组CD8+T细胞中MagT1蛋白和mRNA相对水平的比较Tab.2 Comparison of the relative protein and mRNA levels of MagT1 in CD8+T cells of each group ±s
注:与健康对照组比较,aP<0.05;与低病毒载量组比较,bP<0.05
组别健康对照组低病毒载量组高病毒载量组F值P值例数20 41 45蛋白0.83±0.12 0.43±0.08a 0.15±0.04ab 4.264 0.000 mRNA 1.57±0.17 0.83±0.12a 0.31±0.08ab 6.357 0.000
2.3慢性HBV感染者CD8+T细胞表面分子PD-1、Tim-3、NKG2D和CD38表达比较与健康对照组比较,低病毒载量组和高病毒载量组CD8+T细胞耗竭表面分子PD-1和Tim-3表达均显著升高(均P<0.05),CD8+T细胞功能活化表面分子NKG2D和CD38均显著降低(均P<0.05),并且高病毒载量组PD-1和Tim-3表达又显著高于低病毒载量组(均P<0.05),NKG2D和CD38表达又显著低于低病毒载量组(均P<0.05),见表3。
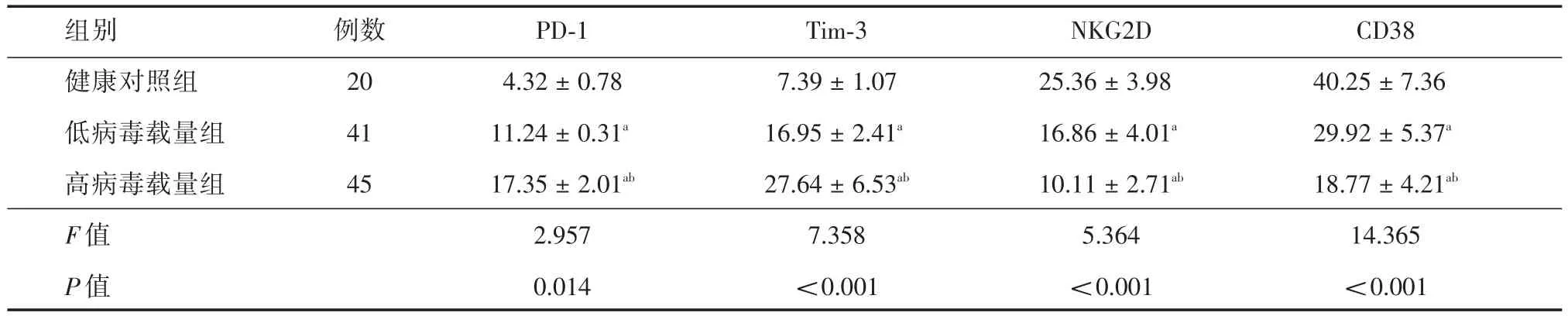
表3 3组CD8+T细胞表面分子PD-1、Tim-3、NKG2D和CD38表达比较Tab.3 Comparison of the expression of PD-1,Tim-3,NKG2D and CD38 in CD8+T cells of each group x± s,%
2.4慢性HBV感染者CD8+T细胞MagT1蛋白表达与分子PD-1、Tim-3、NKG2D、CD38的相关性见表4,慢性HBV感染者CD8+T细胞MagT1蛋白表达与CD8+T细胞耗竭分子PD-1、Tim-3均呈负相关(均P<0.05),与CD8+T细胞功能活化分子NKG2D、CD38均呈正相关(均P<0.05)。
3 讨论
T细胞耗竭是慢性感染状态下T细胞发生的一种功能障碍,主要表现为特异性CD8+T细胞活性下降所致的对免疫应答反应低下,进而不能有效控制病毒复制和清除病毒。有研究[8]显示,Mg2+可以通过调节T细胞表面受体活性参与免疫系统的抗病毒作用。而MagT1是一个非常重要的镁离子通道蛋白,有数据显示,当MagT1基因缺失时,机体极易发生感染并具有发生淋巴瘤的倾向[11]。由此可见,MagT1介导的Mg2+抗病毒作用在病毒性感染疾病中扮演重要作用,可能与其参与调控T细胞活性有关。
Mg2+是细胞正常代谢所必需的二价阳离子,其在细胞内的含量仅次于K+,具有重要的生理功能。长期以来,Mg2+在人类神经系统和心脑血管疾病中的作用备受关注,却很少有人关注其在免疫系统中的作用。本研究结果显示,慢性HBV感染者外周血中Mg2+浓度与健康体检者比较差异无显著性,但对比CD8+T细胞中Mg2+浓度会发现,健康体检者CD8+T细胞内Mg2+浓度显著高于HBV感染者,同时低病毒载量组又高于高病毒载量组。说明,Mg2+浓度随着HBV感染程度的增加而降低,与邵红玲[12]等研究结果一致。提示,Mg2+内流障碍可能是与CD8+T细胞免疫功能下降有一定的关联。
Mg2+在细胞内外的转运主要由通道类Mg2+转运体协助完成。哺乳动物细胞中参与介导Mg2+转运的蛋白主要有 MagT1、TRPM6、TRPM7、Mrs2p、SLC41A1、SLC41A2 和 ACDP2 等[13]。其中,MagT1对Mg2+转运具有高度的选择性,与免疫缺陷性疾病相关度较高[14]。本研究结果显示,慢性HBV感染者CD8+T细胞中MagT1蛋白和mRNA表达水平显著低于健康体检者,同时发现高病毒载量组患者CD8+T细胞中MagT1蛋白和mRNA表达水平又显著低于低病毒载量组。说明,慢性HBV感染过程中伴随着CD8+T细胞中MagT1表达逐渐降低,进而导致CD8+T细胞内Mg2+浓度下降。并且有报道称,MagT1基因缺失介导的免疫细胞内Mg2+浓度下降,可促进T细胞耗竭[11]。进一步证实,MagT1介导Mg2+内流障碍可能会导致CD8+T细胞耗竭。
在慢性HBV感染中,已证实PD-1、Tim-3、CTLA-4等抑制性分子表达上调是CD8+T细胞耗竭的常见指标,而NKG2D、CD38、HLA-DR等活性分子表达上调则是CD8+T细胞激活的常见指标[2,6]。并且大量研究证实,在慢性HBV感染者CD8+T细胞中存在抑制性分子表达上调以及活性分子表达下调[15-16]。本研究结果也显示,与健康体检者比较,慢性HBV感染者CD8+T细胞表面抑制性分子PD-1和Tim-3表达显著上调,活性分子NKG2D和CD38表达显著下调。并且相关性分析显示,慢性HBV感染者CD8+T细胞中MagT1蛋白表达与CD8+T细胞耗竭分子PD-1、Tim-3均呈负相关性,与活化分子NKG2D、CD38均呈正相关性。该结果表明,CD8+T细胞耗竭可能与MagT1表达异常有关。
综上所述,慢性HBV感染过程中CD8+T细胞耗竭可能与MagT1表达异常有关,其具体机制可能是MagT1表达下调导致Mg2+内流障碍,进而引起活化分子NKG2D、CD38表达下调,抑制分子PD-1、Tim-3表达上调,最终造成CD8+T细胞耗竭。
