黑色素瘤缺乏因子2炎性小体在心肌梗死后心肌纤维化中的作用
2019-08-01靳文刘云峰劳钰李冬义陈洁琼刘一炫赵雅红
靳文 刘云峰 劳钰 李冬义 陈洁琼 刘一炫 赵雅红
1广东省第二人民医院心血管内三科(广州510317);2南方医科大学珠江医院(广州510282)
慢性心力衰竭是各种心脏疾病的严重表现或终末阶段,具有发病率高、致残率高、病死率高以及反复发作等特点,已经成为世界范围内危害公众健康最为严重的疾病之一[1-3]。近年来,慢性心力衰竭的治疗药物、方法以及手段已发生显著变化,突出表现在从传统的利尿、强心、扩血管等短期血流动力学治疗向以神经内分泌调节为主的治疗策略转变[4]。然而,我国慢性心力衰竭的患病率仍然居高不下,主要在于:(1)我国人口老龄化加剧和生活方式转变以及诊疗技术的快速进步,急性心肌梗死的发病率逐年升高、存活率获得改善,显著促进了慢性心力衰竭发病率升高[4];(2)心肌梗死后心肌纤维化是慢性心力衰竭的关键病理基础和不良预后的重要影响因素,其发病机制仍未完全阐明[5-6]。炎症反应广泛参与慢性心力衰竭的发生和发展[7]。炎性小体是炎性反应的初始传感器,可能在心肌梗死后心肌纤维化中发挥重要调控作用。本研究通过构建冠状动脉左前降支结扎术构建心肌梗死后心肌纤维化小鼠模型,旨在探讨黑色素瘤缺乏因子2(absent in melanoma 2,AIM2)炎性小体在心肌梗死后心肌纤维化中的潜在作用。
1 对象与方法
1.1 实验动物与分组Aim2-/-小鼠由南方医科大学李杏博士惠赠。Aim2-/-小鼠为C57BL/6品系遗传背景,本研究以其同窝对照野生型(wild type,WT)小鼠作为对照。本研究严格遵守实验动物伦理规章,严格遵循国际实验动物评估和认可委员会(国际实验动物饲养评估认证协会)的认证要求,在此基础上建立小鼠心肌梗死后心肌纤维化模型。本实验研究已经广东省第二人民医院伦理委员会批准。Aim2-/-、WT等小鼠分别予以冠状动脉左前降支结扎法制备心肌梗死后心肌纤维化小鼠,分为Aim2-/-小鼠组、WT小鼠组,每组20只小鼠。
1.2 冠状动脉左前降支结扎法建立心肌梗死后心肌纤维化小鼠模型Aim2-/-、WT等小鼠行冠状动脉左前降支结扎术构建心肌梗死后心肌纤维化模型:行冠状动脉左前降支结扎术,术后1周即可出现心肌梗死后心肌纤维化。简要操作如下:小鼠以2%异氟醚吸入诱导麻醉后以1.5%异氟醚维持麻醉。小鼠进入麻醉状态后固定于手术台,备皮,消毒,连接心电图标准Ⅱ导联。经口气管插管,予以小鼠呼吸机辅助通气。手术过程严格遵循无菌操作。于第4肋间开胸,在左心耳下1 mm处,用6-0号尼龙缝线结扎冠状动脉左前降支近段。实时监测心电图变化。当心电图出现ST段持续抬高,左前降支支配区域心肌变苍白,提示小鼠心肌梗死模型制备成功。关闭胸腔,逐层缝合组织以及皮肤,术后予以丁丙诺啡(0.1 mg/kg)腹腔内注射止痛。如有脱水现象,予以腹腔注射适量无菌生理盐水。腹腔注射青霉素15万单位×3 d。4周后即可出现显著的心肌梗死后心肌纤维化。
1.3 小鼠存活率和生命体征监测每日记录小鼠死亡事件和时间,计算各组小鼠存活率;采用小鼠生命体征监护仪记录心率、血压(收缩压和舒张压)、呼吸频率和幅度、血氧饱和度等。连续4周。
1.4 心脏超声监测小鼠心脏功能各组小鼠均行心脏超声以监测心脏结构和功能。小鼠胸前备皮、10%水合氯醛麻醉固定,使用IE33彩色超声检测仪L15-7io模式(深度2.0 cm,速度60 mm/s),经左室长轴获2D,改M型模式,M线平行二尖瓣后基底部,以M型超声测量以下左心室指标:左室射血分数(left ventricular ejection fraction,LVEF)、心排出量(cardiac output,CO)。每只小鼠在每个切面上检测2次,每次连续读取5个心动周期,取平均值。
1.5 Masson染色检测心肌纤维化常规操作脱蜡;把切片置于Masson染色液泡制4 min;浸泡冰醋酸溶液1 min;置于磷钨酸染5 min;0.2%冰醋酸洗涤2 min;以亮绿或苯胶蓝液复染5 min;再把切片置于0.2%冰醋酸浸洗3次;即予中性树胶把切片面封闭。显微镜下随机以两百倍取视野。每个样本随机取3~5个视野进行分析。
1.6 Western Blot检测Western Blot检测心肌梗死后组织AIM2、TGF-β、CollagenⅠ以及IL-1β的表达,发现左心室梗死区心肌组织AIM2、TGF-1β、CollagenⅠ以及IL-1β的表达。上述抗体均购买自Abcam公司。测定提取的各组心肌组织细胞总蛋白浓度,制胶,取100 μg各组组织蛋白样品上样,电泳,转膜,用封闭液配制一抗(AIM2、IL-1β、TGF-β、CollagenⅠ)工作液,4℃下与育过夜,次日取膜于室温下清洗4次,每次5 min。接着以含有二抗的封闭液与膜孵育1 h,室温下清洗4次,每次5 min。加入化学发光底物,显影,拍照。使用ImageJ软件进行检测条带灰度值与GAPDH的比值(磷酸化蛋白以磷酸化蛋白灰度值与相应总蛋白灰度值比较)表示各组相应蛋白的表达强度。目的蛋白的相对表达水平=目的蛋白的灰度值/内参蛋白的灰度值。上述实验重复3次。
1.7 组织免疫荧光检测心肌组织IL-1β和CollagenⅠ的表达首先将组织切片烤片、脱蜡、水化,抗原微波修复15 min,PBS清洗3次,37℃下5%BSA封闭40 min后加一抗工作液(IL-1β和CollagenⅠ)4℃孵育过夜后室温复温30 min,PBS清洗3次,每次5 min。接着,在37℃、避光情况下,加入二抗工作液孵育2 h,PBS清洗3次,每次5 min。防淬灭封片剂封片,4℃避光保存。最后在荧光显微镜下观察拍照。
1.8 统计学方法采用SPSS 16.0统计软件进行分析,实验数据以±s表示,两组间样本的比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Aim2-/-小鼠心肌梗死后生存率和心功能获得改善生存分析结果显示:与WT小鼠相比,Aim2-/-小鼠的心肌梗死后生存率获得显著改善(P<0.05)。心脏超声检查结果显示:与WT小鼠相比,Aim2-/-小鼠的心肌梗死后LVEF和CO增强(P<0.05)。见图1。

图1 Aim2-/-和WT小鼠心肌梗死后生存曲线和心功能变化Fig.1 Survival curve and cardiac function changes after myocardial infarction in Aim2-/-and WT mice
2.2 Aim2-/-小鼠心肌梗死后心肌纤维化减轻Masson染色结果显示:与WT小鼠相比,Aim2-/-小鼠的心肌梗死后心肌纤维化程度减轻。见图2。
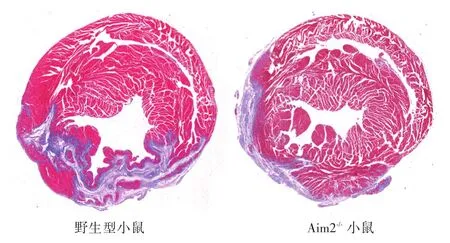
图2 Aim2-/-和WT小鼠心肌梗死后心肌纤维化(Masson染色)Fig.2 Myocardial fibrosis after myocardial infarction in Aim2-/-and WT mice(Masson staining)
2.3 Aim2-/-小鼠心肌梗死后心肌纤维化区域IL-1β和CollagenⅠ表达减轻免疫组织荧光检测结果显示:与WT小鼠相比,Aim2-/-小鼠的心肌梗死后心肌纤维化和缺血纤维化组织中IL-1β、CollagenⅠ表达均减弱。见图3。
2.4 Aim2-/-小鼠心肌梗死后心肌纤维化组织TGF-β、CollagenⅠ以及IL-1β的表达减轻Western Blot 检测结果显示:与WT相比,Aim2-/-小鼠的心肌梗死后心肌纤维化组织中TGF-β、IL-1β、CollagenⅠ表达均减弱。见图4。
3 讨论
AIM2是PHYIN蛋白家族成员,广泛存在于心肌成纤维细胞(Cardiac fibroblasts,CFs)[8],主要定位于细胞质,为损伤相关分子模式分子双链DNA、线粒体DNA受体,具有两个特征性结构域:N端热蛋白结构域(pyrin domain,PYD)和C端200氨基酸重复序列的造血干扰素诱导核蛋白(hematopoietic interferon-inducible nuclear proteins with 200 amino acid repeats,HIN-200)结构域,主要通过HIN-200结构域特异性识别细胞质中的双链DNA、mtDNA,释放PYD而招募接头蛋白ASC(apoptosis-associated speck-like protein containing a CARD),形成 AIM2炎性小体(AIM2-ASC-Pro-Caspase-l),依赖于半胱氨酸天冬氨酸特异性蛋白酶-1(cysteinyl aspartate specific protease 1,Caspase-1)的活化进一步裂解pro-IL-1β、pro-IL-18,产生并分泌IL-1β、IL-18,或裂解gasdermin D(GSDMD),触发细胞焦亡,分泌IL-1β、IL-18等炎症因子并释放至细胞外,快速启动免疫炎性反应[9]。本研究首次发现Aim2-/-小鼠心肌梗死后存活率和心脏功能(左室射血分数和心排血量)改善(P<0.05)、心肌纤维化程度减轻,心肌梗死后心肌纤维化组织IL-1β、TGF-β、CollagenⅠ等表达降低,提示AIM2炎性小体参与调控心肌梗死后心肌纤维化,可能是心肌梗死后心力衰竭的重要治疗靶点。
炎性小体作为心肌梗死炎症反应的初始传感器,在心肌梗死后心肌纤维化中发挥重要调控作用[10]。ASC、Caspase-1是AIM2炎性小体组成和活化的关键分子。已有研究[10]发现与野生型小鼠相比,ASC、Caspase-1基因敲除小鼠在心肌缺血再灌注损伤后CFs的增殖和炎症因子分泌等活性显著降低,心肌梗死后心肌纤维化改善。其次,IL-1β和IL-18是炎性小体活化后分泌的主要炎症因子,能够有效促进CFs功能活化和心肌纤维化[11-12]。以上研究结果提示炎性小体成员ASC、Caspase-1是促进心肌梗死后心肌纤维化的重要分子。AIM2作为模式识别受体和炎性小体家族重要成员,是否促进心肌梗死后心肌纤维化?为此,本研究利用Aim2-/-小鼠及其同窝对照野生型小鼠,采用冠状动脉左前降支结扎术构建心肌梗死后心肌纤维化模型,观察小鼠存活状况。与WT小鼠相比,Aim2-/-小鼠的存活率以及心脏功能指标LVEF和CO显著改善,提示Aim2-/-小鼠能够改善心肌梗死后心力衰竭。Masson染色结果显示Aim2-/-小鼠心肌梗死后心肌纤维化程度减轻,Western Blot和组织免疫荧光技术检测结果显示心肌梗死后心肌纤维化组织CollagenⅠ分子表达降低,提示Aim2-/-小鼠存活率和心脏功能改善与心肌梗死后心肌纤维化减轻密切相关。
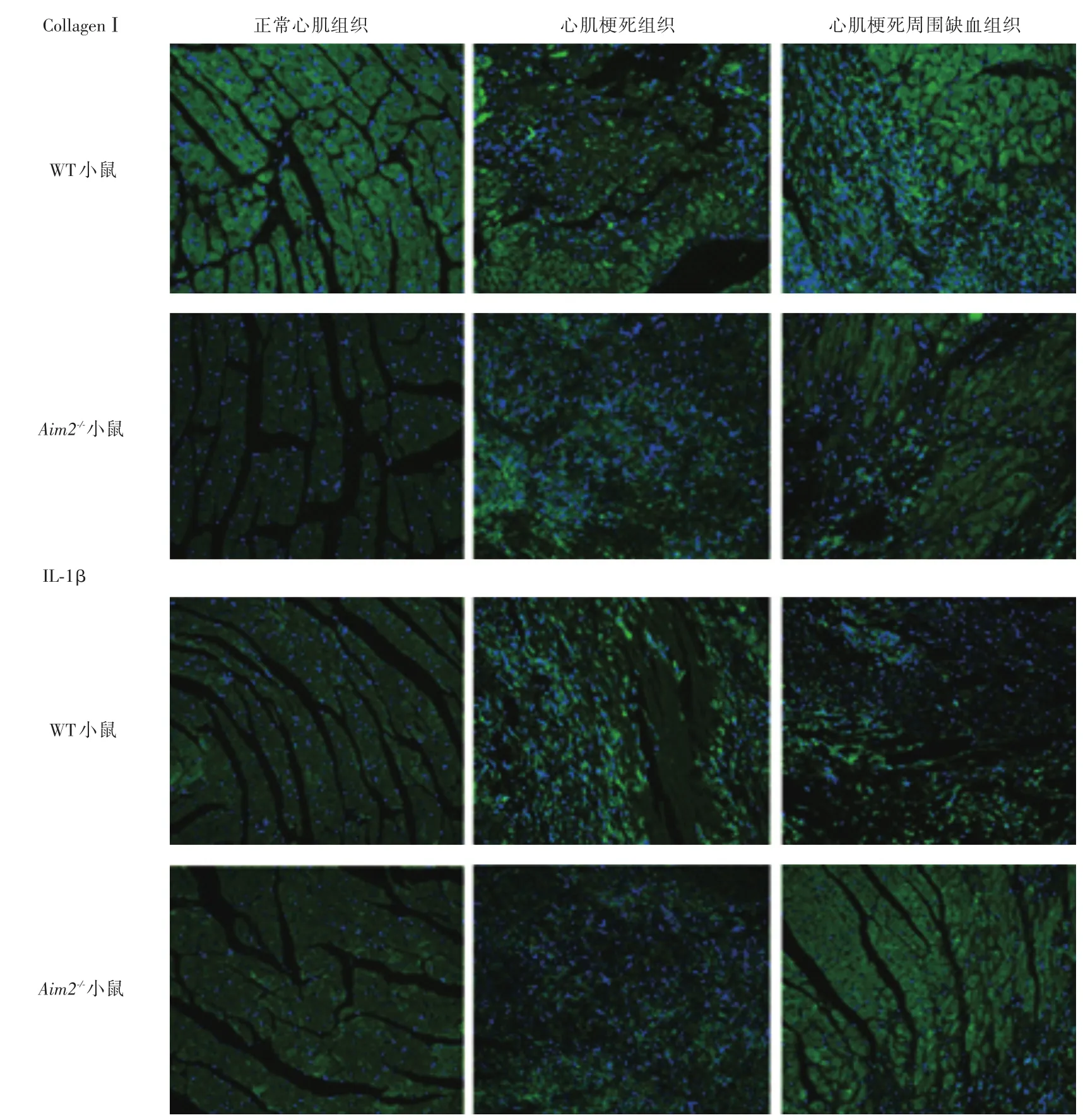
图3 Aim2-/-和WT小鼠心肌梗死后正常心肌、心肌梗死纤维化、心肌梗死缺血纤维化等组织中CollagenⅠ和IL-1β的表达Fig.3 Expression of Collagen I and IL-1β in normal myocardium,ischemic myocardial fibrosis and infarcted myocardial fibrosis of Aim2-/-and WT mice after myocardial infarction
心脏固有CFs是构成心肌组织的主要细胞和心脏CFs的最主要来源,遍布于心肌组织,包绕着心肌细胞并与心肌细胞外基质(extracellular matrix,ECM)相连接,具有调控ECM代谢、合成分泌多种细胞因子、介导心肌电/机械信号传导,参与血管新生等功能[13]。由于能够耐受心肌缺血,CFs在心肌梗死后早期即可迅速对坏死心肌释放的损伤相关分子模式分子作出反应,直接表现为CFs增殖、迁移、向肌成纤维细胞(cardiac myofibroblasts,CMFs)转分化、ECM产生等能力增强,间接表现为通过自分泌和旁分泌大量细胞因子[如转化生长因子β(transforming growth factor β,TGF-β)、IL(interleukin,IL)-1β]作用于心肌组织中CFs、心肌细胞、免疫细胞等各种靶细胞[13-14]。TGF-β、IL-1β等是介导CFs功能活化的重要因子。其中,TGF-β主要通过TGF-β-Smad2/3信号通路促进CFs向CMFs转分化、ECM产生等方式调控心肌梗死后心肌纤维化[15]。IL-1β通过与其受体结合介导 JNK、p-38MAPK、Erk等信号通路激活NF-κB促进CFs的增殖、分化、迁移以及炎症因子分泌[12,15]。可见,CFs既是心肌梗死后心肌纤维化过程中的主要作用细胞,也是炎症因子重要来源和靶点,在心肌梗死后心肌纤维化过程中发挥主导作用。本研究中Western Blot和(或)组织免疫荧光技术检测结果显示:与WT小鼠相比,Aim2-/-小鼠心肌梗死后心肌纤维化组织IL-1β、TGF-β表达降低,提示Aim2-/-小鼠心肌梗死后心肌纤维化组织CFs的细胞因子分泌功能减退。
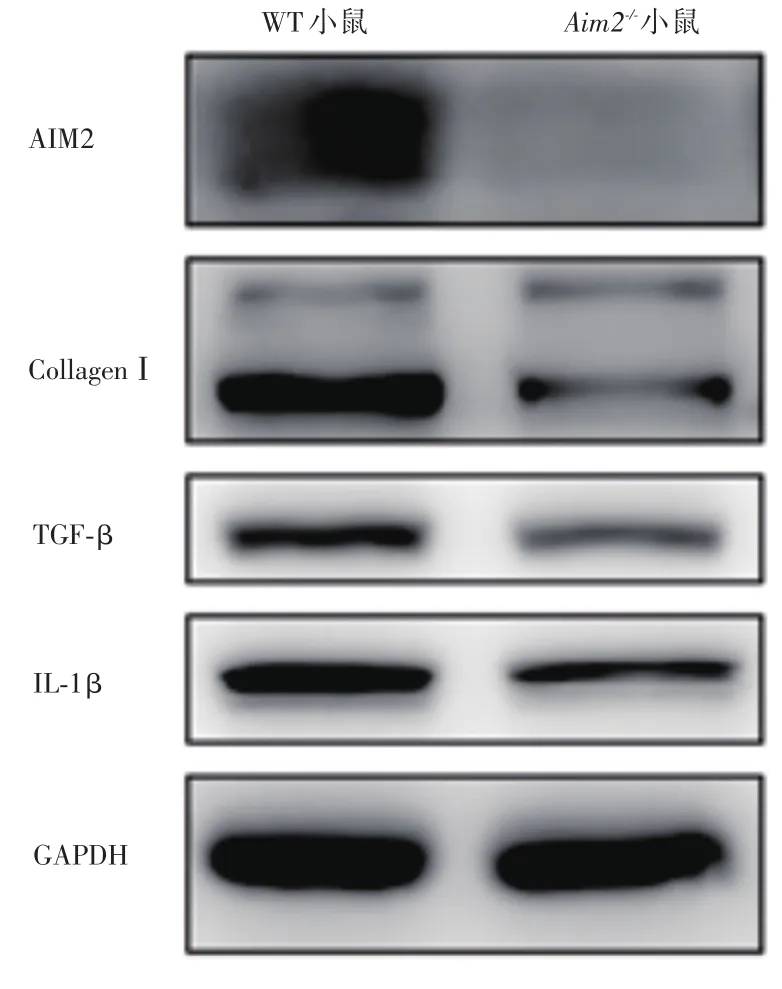
图4 Aim2-/-和WT小鼠心肌梗死后心肌纤维化组织TGF-β、CollagenⅠ以及IL-1β的表达Fig.4 Expression of TGF-β,CollagenⅠand IL-1β in myocardial fibrosis tissue of Aim2-/-and WT mice after myocardial infarction
本研究存在的局限性在于针对AIM2炎性小体如何调控TGF-β促进心肌梗死后心肌纤维的机制尚不清楚。在今后的研究中,将通过体内外细胞实验探讨AIM2炎性小体调控心肌梗死后心肌纤维化的分子机制。
综上,本研究结果提示:AIM2炎性小体是心肌梗死后心力衰竭的重要调控分子,可能与其促进心肌梗死后心肌纤维化的作用密切相关。
