甲醇制丁烯反应机理研究
2019-07-31贺振富
贺振富
(国家能源集团公司,北京 100011)
近30年来,甲醇制烯烃(MTO)反应机理备受瞩目,提出了20多种不同的MTO反应机理,分为串联型机理和并联型机理两大类。串联型机理认为乙烯首先生成产物,但在SAPO-34上发生的MTO反应初期,丙烯生成量通常高于乙烯[1]。在并联型机理中,Dahl和Koboe[2-3]提出“烃池”反应机理,认为在催化剂上首先形成大相对分子质量的烃类物质并吸附在催化剂孔道内,一方面这些物质作为活性中心不断与甲醇反应引入甲基基团,另一方面这些活性中心不断进行脱烷基化反应,生成乙烯和丙烯等低碳烯烃分子。目前,“烃池”机理已经得到了普遍认可[4-5],介绍了B酸中心在MTO反应过程中的作用。严志敏[6]认为,在MTO反应过程中B酸中心直接参与了中间物种的生成,但未对反应物与B酸中心相互作用机制及生成的中间物种作进一步说明。
碳烯离子机理[7]提出,在沸石催化剂酸、碱性中心的协调作用下,甲醇经α-消除反应脱水得到碳烯[CH2],[CH2]结构中含有1个电中性的二价C原子,C原子上有2个未成键的电子,[CH2]通过聚合,或插入甲醇、二甲醚分子中即可生成烯烃。Stöcker[8]认为MTO在分子筛表面反应分为3步:1)生成甲氧基,2)初始 C-C 键,3)生成C3=、C4=。Haw等[9]考虑了催化剂酸强度、酸中心密度等因素,进一步将MTO过程分为先后5步:1)甲醇、二甲醚和水快速达到平衡;2)新鲜催化剂的动力学诱导期;3)生成碳氢化合物;4)碳氢化合物反应生成烯烃;5)催化剂积炭失活。

目前,普遍认为[13-18],MTO反应过程中,甲醇脱水生成二甲醚,甲醇和二甲醚平衡混合物与SAPO-34分子筛酸性中心作用,在催化剂表面生成甲氧基,甲氧基对MTO反应过程中第1个C-C键的形成起关键作用。这使得二甲醚与甲醇平衡混合物脱水继续转化为乙烯、丙烯为主的低碳烯烃,少量低碳烯烃进一步由环化、脱氢、氢转移、缩合、烷基化等反应生成相对分子质量不同的饱和烃、芳烃、C6+烯烃及焦炭等。然而,这些研究均未真实揭示出催化剂与反应物之间相互作用。
目前,尚未发现从杂化轨道理论的角度来分析MTO反应中催化剂与反应物的相互作用、研究反应机理的相关报道。笔者利用电子轨道理论和关于含Si、Al元素催化剂酸中心的认识为理论依据和研究方法,从研究反应物甲醇与催化剂B酸中心相互作用为切入点,分析相互作用过程中物质结构变化等,尝试揭示甲醇制烯烃反应机理。
1 杂化轨道理论及其优势
1931年,鲍林(Pauling L)等在价键理论的基础上提出了杂化轨道理论,丰富和发展了现代价键理论。杂化轨道理论认为:具有能量较低的电子亚层的一个或多个电子会激发而变为激发态,进入能量较高的电子亚层中去,即所谓的跃迁现象,而新形成一个或多个能量较高的电子亚层。此时,原来处于较低能量的电子亚层的电子具有的能量增加到与能量较高的电子亚层的电子相同。这些电子的轨道便混杂在一起,即杂化轨道,电子的状态即杂化态。
杂化轨道理论深入探讨化学反应过程中反应物原子内部和催化剂活性中心原子内部电子轨道的变化,通过研究电子轨道上电子转移规律,来揭示化学反应过程中物质的结构变化及反应机理的本质。这是目前实验科学无法实现、也无法到达的目标。
笔者将杂化电子轨道理论与含Si、Al元素催化剂酸中心的认识论相结合,从原子内部微观电子迁移与成键过程,综合分析甲醇制丁烯反应的机理本质。
2 甲醇制丁烯反应机理分析
甲醇在SAPO-34或ZSM-5分子筛上反应,生成1-丁烯(CH2=CH-CH2-CH3)、2-丁烯(CH3-CH=CH-CH3)及2-甲基丙烯(CH2=C-(CH3)2),反应方程式如下:
4CH3OH→CH2=CH-CH2-CH3+4H2O
(1)
4CH3OH→CH3-CH=CH-CH3+4H2O
(2)
4CH3OH→CH2=C-(CH3)2+4H2O
(3)
文献[19-20]认为,含Si、Al元素固体酸催化剂的催化活性来源于其酸性;而催化剂酸性取决于Al原子的O原子配位数。2、3配位的Al原子形成L酸中心;4、5或6配位的Al原子形成B酸中心。以4配位B酸中心为例,研究甲醇在B酸中心作用下反应生成丁烯的机理。
2.1 4配位B酸中心HAlO4
图1为4配位B酸中心的失活与再生电子轨道变化图。按照文献[21]提供方法,4配位B酸中心HAlO4是由1个Al原子、4个O原子和1个H原子组成,电子轨道结构示意图如图1(a)所示。4配位B酸中心HAlO4可提供1个H+,失去H+就成为失活4配位B酸中心AlO4-,电子轨道结构如图1(b)所示。反之,AlO4-得到1个H+就可恢复活性。
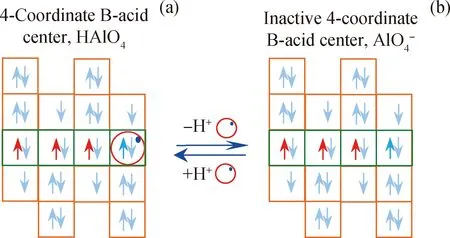
图1 4配位B酸中心的失活与再生Fig.1 Inactivation and regeneration of 4-coordinate B-acid center(a)HAlO4;(b)AlO4-
2.2 CH3+和C↑↓〇H2生成
甲醇在SAPO-34或ZSM-5分子筛上反应,就是甲醇分子与分子筛B酸中心相互作用而发生化学反应生成烯烃的过程。根据文献[21]提供方法,以4配位B酸中心HAlO4为例,分析CH3+和中间体C↑↓〇H2生成过程。
图2为H+攻击甲醇分子中C-O键生成CH3+过程的电子轨道变化示意图。图2(a)是甲醇分子电子轨道结构图,4配位B酸中心释放H+攻击甲醇分子中C-O键,H原子和C、O原子共用1对电子生成CH3-HOH结构,如图2(b)。H原子电负性2.20,C原子电负性2.55,O原子电负性3.44,C、O原子外层均有4对电子,C原子吸引共用电子对能力为0.64,O原子吸引共用电子对能力为0.86,共用电子对更容易被O原子吸引,结果O原子和H原子结合,形成了结构稳定的H2O分子,如图2(c)所示。CH3-HOH失去H2O后形成了CH3+,如图2(d)所示,CH3+结构中C原子外层有1个空轨道。

图2 H+攻击甲醇分子中C-O键生成CH3+ Fig.2 The formation methyl carbocation by H+ attacking C-O bond in methanol molecule(a)CH3OH;(b)CH3-HOH;(c)H2O;(d)CH3+
图3为CH3+与失活B酸中心作用生成H-form C↑↓〇H2的电子轨道变化示意图。图3(a)中,失去H+后的失活B酸中心与CH3+继续作用,CH3+中空轨道会吸附在失活B酸中心Al、O原子共用电子对处,形成CH3-AlO4结构,图3(b)所示。在CH3-AlO4结构中,H+转移到相邻Al、O和C原子重叠轨道上,形成Al、O、C和H 4个原子轨道重叠且共用1对电子结构,即CH2-HAlO4,如图3(c)所示。图3(c)中,H原子电负性2.20;O原子电负性3.44,其外层有4对电子,吸引每对电子能力为0.86;Al原子电负性1.61,其外层有4对电子,吸引每对电子能力为0.40;C原子电负性2.55,其外层有4对电子,吸引每对电子能力为0.64。那么,H原子、O原子和Al原子吸引共用电子对能力为3.46,大于C、H原子吸引共用电子对能力(2.84)。最后,C原子失去对这对电子作用,Al、O和H原子形成HAlO4结构,使失活4配位B酸中心AlO4-恢复活性,如图3(d)所示。CH3+失去H+后反应生成中间体H-form C↑↓〇H2(↑↓表示孤对电子,〇表示空轨道),C↑↓〇H2结构中C原子外层有1对孤对电子和1个空轨道,其电子结构如图3(e)所示。中间体C↑↓〇H2是用电子轨道理论研究甲醇制烯烃反应机理中得出的重大发现。
本研究采用GIS技术和隶属函数模型对胶东半岛耕地地力进行评价,并对评价结果进行分析,并提出了耕地可持续利用建议与措施。主要结论如下:
中间体H-form C↑↓〇H2电子轨道结构与碳烯[CH2]不同:[CH2]含有1个电中性的二价C原子,其上有2个未成键电子;而H-form C↑↓〇H2结构中C原子外层有1对孤对电子和1个空轨道。

图3 CH3+与失活B酸中心作用生成H-form C↑↓〇H2Fig.3 The formation of H-form C↑↓〇H2 by CH3+ interacting with the inactive B-acid center(a)AlO4-;(b)CH3-AlO4;(c)CH2-HAlO4;(d)HAlO4;(e)H-form C↑↓〇H2↑↓—A lone pair of electrons;〇—Empty orbit
2.3 丁烯生成分析
2.3.1 1-丁烯的生成
图4为C↑↓〇H2生成1-丁烯过程分析。由图4(a)可知,4个C↑↓〇H2结构有4个C原子,分别记为1-C、2-C、3-C和4-C。在图4(b)中,1-C原子上孤对电子占据2-C原子上的空轨道,2-C原子上孤对电子占据1-C原子上的空轨道,2个C原子共用2对电子形成了C=C键;3-C原子上的空轨道与2-C原子上C、H原子重叠轨道再次重叠;4-C原子上的空轨道与3-C原子上C、H原子重叠轨道再次重叠;轨道重叠处的H+转移到相邻C原子上,这样2-C与3-C、3-C与4-C形成了2个C-C键;4个 C↑↓〇H2形成CH2=CH-CH2-CH3结构,即生成1-丁烯,其电子结构如图4(c)和4(d)所示。

图4 C↑↓〇H2生成1-丁烯过程分析Fig.4 Analysis of the process of C↑↓〇H2 formation 1-butene(a)C↑↓〇H2;(b)C↑↓〇H2-C↑↓〇H2-C↑↓〇H2-C↑↓〇H2(1);(c)CH2=CH-CH2-CH3(1);(d)CH2=CH-CH2-CH3(2)
2.3.2 2-丁烯的生成
图5为中间体C↑↓〇H2生成2-丁烯过程分析。由图5(a)可知,4个C↑↓〇H2结构有4个C原子,分别记为1-C、2-C、3-C和4-C。在图5(b)中,2-C原子上孤对电子占据3-C原子上空轨道,3-C原子上孤对电子占据2-C原子上空轨道,2个C原子共用2对电子形成C=C键;1-C原子上空轨道与2-C原子上C、H原子重叠轨道再次重叠,形成C、H和C 3个原子共用1对电子结构,3个原子重叠处H+转移到相邻的1-C原子外层含有孤对电子的轨道上形成C-C键,如图5(b);同理,3-C原子和4-C原子也形成C—C键,4个C↑↓〇H2形成 CH3-CH=CH-CH3结构,即生成2-丁烯,如图5(c)和5(d)所示。
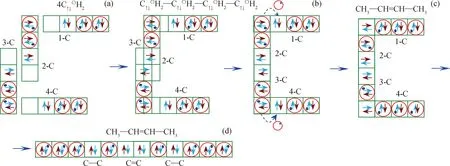
图5 C↑↓〇H2生成2-丁烯过程分析Fig.5 Analysis of the formation of 2-butene process by C↑↓〇H2(a)C↑↓〇H2;(b)C↑↓〇H2-C↑↓〇H2-C↑↓〇H2-C↑↓〇H2;(c)CH3-CH=CH-CH3(1);(d)CH3-CH=CH-CH3(2)
2.3.3 2-甲基丙烯生成
图6为C↑↓〇H2生成2-甲基丙烯过程分析。由图6(a)可知,4个C↑↓〇H2结构有4个C原子,分别记为1-C、2-C、3-C和4-C。图6(b)中,1-C原子上孤对电子占据2-C原子上空轨道,2-C原子上孤对电子占据1-C原子上空轨道,2个C原子共用2对电子形成C=C键;3-C原子空轨道与2-C原子上C、H原子重叠轨道再次重叠,形成C、H和C 3个原子共用1对电子结构,重叠处H+转移到相邻的3-C原子外层含有孤对电子轨道上,形成了C-C键,如图6(b)。相同方式,2-C原子和4-C原子形成了C-C键,结果4个C↑↓〇H2形成CH2=C-(CH3)2结构,即2-甲基丙烯(异丁烯),结构如图6(c)、6(d)所示。

图6 C↑↓〇H2生成2-甲基丙烯(异丁烯)过程分析Fig.6 Analysis of the process of C↑↓〇H2 forming 2-methyl propylene (isobutylene)(a)C↑↓〇H2;(b)C↑↓〇H2-C↑↓〇H2-C↑↓〇H2-C↑↓〇H2;(c)CH2=C-(CH3)2(1);(d)CH2=C-(CH3)2(2)
2.4 丁烯生成机理
根据上面分析,甲醇在4配位B酸中心HAlO4作用下生成丁烯反应机理概括如下:
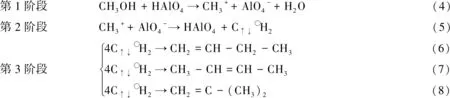
反应式(4)×4、式(5)×4和式(6)相加得到反应式(1),生成1-丁烯;反应式(4)×4、式(5)×4和式(7)相加得到反应式(2),生成2-丁烯;反应式(4)×4、式(5)×4和式(8)相加得到反应式(3),生成2-甲基丙烯(异丁烯)。上述分析揭示了甲醇分子在4配位B酸中心HAlO4作用下生成丁烯的反应本质。
实际上,无论是在4配位B酸中心、还是5配位B酸中心和6配位B酸中心作用下,甲醇反应生成丁烯的反应机理相同。
3 结 论
在B酸中心作用下,甲醇反应制丁烯机理分3步:

(3)H-form C↑↓〇H2是构成烯烃的基本结构单元,4个C↑↓〇H2可以生成1-丁烯、2-丁烯和2-甲基丙烯(异丁烯)。
