免疫检查点分子在子宫内膜癌中的表达及临床意义
2019-07-30张丽萍林雪萍宋辉雷萍朱巧英
张丽萍,林雪萍,宋辉,雷萍,朱巧英
610045成都,四川省妇幼保健院 检验科
子宫内膜癌(endometrial carcinoma,EC)是女性生殖系统3大恶性肿瘤之一,发病率居世界女性恶性肿瘤的第6位[1]。近年来,我国女性EC发病率呈逐年上升趋势[2- 3]。早期EC主要以手术治疗为主,预后良好,5年生存率可达74%~91%[4]。而对于转移或复发性患者,化疗、放疗等治疗方法疗效有限,5年生存率仅20%~26%[4],迫切需要探索新的有效的治疗方法。2013年,Science杂志将肿瘤免疫治疗列为重要的科学突破,提示免疫疗法将在癌症治疗领域发挥里程碑式的作用[5]。其中,免疫检查点抑制剂(抗PD-1/PD-L1)已经用于治疗多种实体肿瘤,且疗效显著。然而,目前免疫检查点抑制剂疗法应用于EC仍处于试验阶段。
免疫检查点分子异常表达是肿瘤免疫逃逸的机制之一。由癌细胞、DC细胞、巨噬细胞或骨髓来源的抑制细胞表达的抑制性配体,与T细胞表面受体分子结合后激活负性通路,抑制T细胞增殖或抗肿瘤活性[6]。目前已发现多条免疫检查点通路与肿瘤免疫逃逸相关,如PD-1/PD-L1,CTLA-4/CD80,TIM-3/Gal-9和LAG-3/FGL1[7- 9]。在EC中,免疫检查点的研究目前主要集中在PD-1/PD-L1通路。2013年,美国癌症基因组图谱( The Cancer Genome Atlas, TCGA )项目将373例EC分为4种分子亚型:POLE突变型(7%);微卫星不稳定型(microsatellite instability,MSI)(28%);拷贝数低型(39%)和拷贝数高型 (26%)[10]。之后,Stelloo等[11]通过免疫组化、一代测序等技术将EC分为POLE突变型,MSI型,无特异性分子变异(no specific molecular profile, NSMP)和TP53突变型,分别对应于上述TCGA的四种分子亚型。研究发现,POLE突变型和MSI亚型的肿瘤突变负荷(tumor mutation burden, TMB)明显升高[10],而高TMB的肿瘤更容易从PD-1/PD-L1抑制剂中治疗获益[12- 13]。此外,POLE突变的EC组织中浸润T细胞、CD8+ T细胞以及PD-1表达显著升高[14]。近期的几个案例报道也显示,PD- 1单抗治疗POLE突变型EC疗效显著[15- 16]。这些结果提示POLE突变与MSI亚型的EC可能更适合PD-1/PD-L1阻断治疗[17- 18]。然而,其他各种免疫检查点分子在EC组织中的表达及意义目前并不清楚,限制了其他免疫疗法的应用及患者筛选。
本研究采用TCGA数据库中最新的EC病例及其基因数据(n=521),验证了4种分子亚型与患者临床特征以及肿瘤免疫表型的关系。同时分析了多种免疫检查点分子在EC中的表达情况,及其与肿瘤微环境、患者预后的关系。这些结果揭示了不同EC亚型中各种免疫抑制分子的表达特征,为免疫治疗在EC中的应用提供参考。
1 材料与方法
1.1 TCGA数据库中EC病例信息
截止2018年11月,TCGA数据库共收集EC患者560例。下载患者临床信息、肿瘤组织全外显子测序数据(maf文件)、RNA-seq数据(counts文件)。经整理,三类数据齐备的病例数为521例,可用于后续分析。
1.2 生物信息学分析
根据TCGA下载的全外显子测序结果(maf文件),采用MSIseq软件[19]对肿瘤的MSI状态进行预测。POLE、TP53基因的突变信息直接从maf文件中提取。对于POLE基因,选取其核酸外切酶结构域的突变,这些突变导致DNA聚合酶ξ失去错配修复功能,从而广泛引起基因突变[17]。按照Stelloo提出的基因分型规则,将EC组织分为POLE突变型、MSI型、NSMP型以及TP53突变型[11]。
对于RNA-seq的原始reads数据,采用TPM(transcripts per million)的方法进行标准化处理[20]。各种免疫细胞、肿瘤间质细胞在肿瘤组织中的丰度由这些细胞的基因标志物进行计算。基因标志物采用Prat等[21]整理的不同免疫细胞、间质细胞的标志基因。具体某种细胞丰度的计算采用文献报道的方法[22],即以该细胞所有标志基因的平均表达值作为细胞丰度指标。
1.3 统计学分析
四种EC分子亚型与病例组织学类型、分期、分级、年龄的相关性采用卡方检验或Fisher精确法检验。各种免疫细胞成分、免疫检查点分子在不同分子亚型、不同组织学类型中的表达差异采用t检验或秩和检验。TMB在不同患者组别中的差异分析采用秩和检验。采用Kaplan-Meier曲线比较患者总生存期(overall survival, OS)和无复发生存期(relapse-free survival, RFS),log-rank检验计算统计学显著性。对于不同的免疫检查点基因,通过基因表达值的中位值将患者分为高、低表达两组。FGL1基因表达值与各种细胞成分的相关性分析采用Pearson方法。所有统计计算采用R软件(版本3.5.1)进行,双侧P<0.05作为差异有统计学意义。
2 结 果
2.1 基于全外显子测序和RNA测序数据对EC进行分子分型
521例EC患者的中位年龄64岁(区间31 ~ 90岁)。按照病理类型,子宫内膜样腺癌389例(74.7%),浆液性腺癌110例(21.1%),混合型癌22例(4.2%)。病理学分级为G1、G2、G3的患者分别为96例(18.4%)、115例(22.1%)、310例(59.5%)。按照Stelloo的分型规则[11],全部患者被分为POLE突变型(41例)、MSI型(154例)、NSMP型(171例)和TP53突变型(155例)。四种分子亚型与组织病理学类型、肿瘤分期、肿瘤分级、患者年龄均具有显著关联(图1A)。其中TP53突变型主要与浆液性癌、肿瘤高分级、患者高年龄相关。与TP53突变型/NSMP型相比,POLE突变型和MSI型EC中总白细胞(CD45)、T淋巴细胞及CD8+T细胞成分显著升高(P<0.001,图1B)。然而,这些细胞在POLE突变型和MSI型之间并没有显著差异。生存分析表明,四种分子亚型中,POLE突变型预后较好,TP53突变型预后最差(OS和RFS均为P<0.001,图1C)。
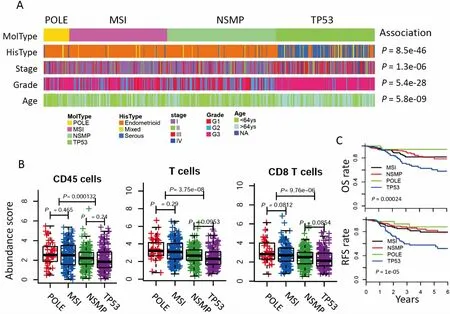
图1 TCGA数据库中EC的分子分型
Figure 1. Molecular Subtypes of EC from TCGA
A.Correlationbetweenfourmolecularsubtypesandclinicalandpathologicalparameters.PvaluewascalculatedbyChi-squaretestorFisherexacttest.B.Analysisofinfiltratinglymphocyteabundanceinfourmolecularsubtypes.Pvaluewascalculatedbyt-test.C.Kaplan-MeiermethodwasusedtoplotOSandRFSoffourmolecularsubtypes.Pvaluewascalculatedbylog-ranktest.
2.2 免疫检查点分子在4种EC分子亚型中的表达情况
PD-1及其配体分子PD-L1和PD-L2在POLE/MSI亚型中表达显著高于TP53/NSMP亚型(P<0.01,图2)。PD-1/PD-L1/PD-L2表达在POLE与MSI两种亚型之间差异无统计学意义。类似地,CTLA-4(P<0.001)及配体CD80的表达(P=0.006)在POLE/MSI两种亚型中的表达高于另外两种亚型。不过,CTLA- 4的另一个配体CD86(P=0.062)在四种亚型中无明显变化。虽然TIM- 3在POLE/MSI亚型中表达高于NSMP/TP53亚型(P=0.006),但其配体Gal- 9在四种亚型中的表达差异无统计学意义(P=0.096)。POLE/MSI亚型中LAG- 3表达较NSMP/TP53亚型升高,差异具有显著统计学意义(P<0.001)。作为LAG- 3的配体,FGL1分子则主要在MSI及NSMP两种亚型中高表达(图2)。

图2 四种分子亚型中不同免疫检查点分子的表达分析
Figure 2. Expression of Diverse Immune Checkpoint Molecules in Four Molecular Subtypes of EC
Expressionofreceptors/ligands(PD-1/PD-L1/PD-L2,CTLA-4/CD80/CD86,TIM-3/Gal-9,LAG-3/FGL1)infourmolecularsubtypeswasanalyzed,anddifferenceingeneexpressionamonggroupswascomparedbyt-test.
2.3 免疫检查点分子与EC患者预后的关系
在各种免疫检查点受体分子中,CTLA-4和PD-1高表达的患者OS显著延长(P<0.05,图3A)。TIM-3和LAG-3高表达组OS也有延长趋势,但差异无统计学意义(P>0.05)。在相应配体分子中,CD80、PD-L1、Gal-9表达均与OS无显著相关。但是,FGL1高表达组的OS较低表达组更好,差异具有统计学意义(P=0.007,图3A)。多数免疫检查点分子(包括CTLA-4/CD80、PD-1/PD-L1、TIM-3/Gal-9和LAG-3)与RFS并无显著相关(P>0.05,图3B)。然而,FGL1高表达与RFS延长显著相关(P<0.001,图3B)。
2.4 LAG- 3/FGL1通路是EC潜在的免疫治疗靶点
进一步分析LAG-3/FGL1基因表达与病理类型的关系,发现LAG-3在子宫内膜样癌(endometrioid)、混合型癌(mixed)、浆液性癌(serous)中的表达差异无统计学意义(图4A)。FGL1在子宫内膜样癌中的表达显著高于另外两种病理学类型(P<0.001,图4A)。生存分析表明,在子宫内膜样癌中,FGL1高表达与RFS延长显著相关(P=0.012,图4B)。FGL1高表达组与低表达组相比OS有延长趋势,但差异无统计学意义(P=0.140,图4B)。在浆液性/混合型癌中,FGL1表达与OS或RFS的差异均无统计学意义(P>0.05,图4B)。
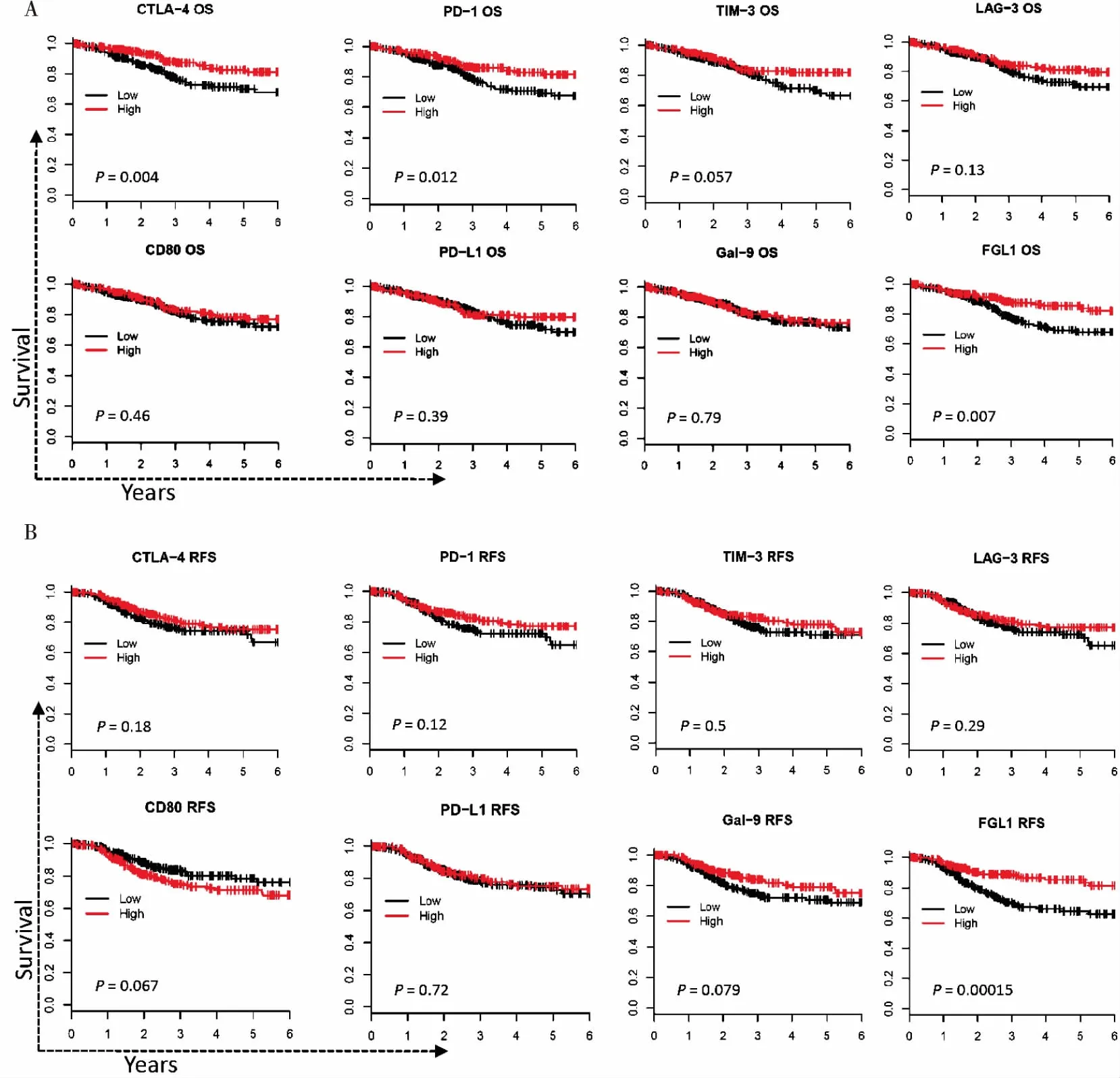
图3 各种免疫检查点分子与EC患者预后的相关性分析。根据每个基因的表达值,按中位值作为阈值将患者分为高(High)、低(Low)表达两组。采用Kaplan- Meier法绘制两组患者的生存曲线,用log- rank检验计算统计显著性。
Figure 3. Correlation between Expression of Immune Checkpoint Molecules and Prognosis of EC Patients
Accordingtotheexpressionvalueofeachgene,patientsweredividedintohigh-andlow-expressiongroupsusingmedianasthethreshold.Kaplan-Meiercurvesoftwogroupswerecomparedbylog-ranktest.(A)AnalysisforOS.(B)AnalysisforRFS.
通过分析LAG-3/FGL1表达与肿瘤微环境中浸润淋巴细胞的关系,发现LAG-3与CD8+T淋巴细胞成分显著相关(r>0.75,图4C),而FGL1与CD8+T淋巴细胞无明显相关性(r<0.1,图4C)。同样,FGL1与Treg细胞、巨噬细胞等免疫负调控细胞也无明显相关性(r<0.1,图4C)。我们推测FGL1主要表达于癌细胞,因此比较了癌组织与23例正常对照组织中FGL1的表达。与正常组织相比,子宫内膜样癌组织中FGL1表达显著升高(P<0.001,图4D)。而浆液性/混合型癌组织与正常组织相比,FGL1表达差异无统计学意义(P=0.300,图4D)。此外,FGL1高表达的肿瘤组织中,肿瘤突变负荷显著升高(P=0.020,图4E)。
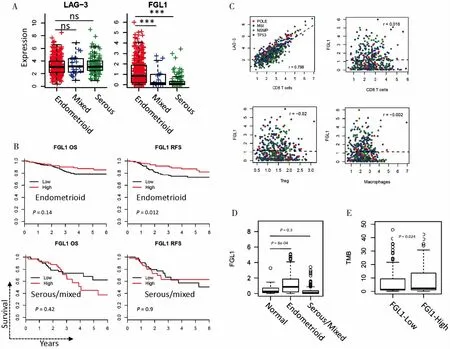
图4LAG-3/FGL1免疫检查点通路分析
Figure4.Analysis ofLAG-3/FGL1Immune Checkpoint Pathway
A.ExpressionofLAG-3andFGL1inendometrioid,mixedandserouscarcinomas.Comparisonbetweengroupswasconductedbyt-test;ns=notsignificant;***=P<0.001.B.SubgroupanalysisofrelationshipbetweenFGL1andprognosis.CorrelationbetweenFGL1expressionandOSinendometrioidcarcinoma,thatbetweenFGL1expressionandRFSinendometrioidcarcinoma,thatbetweenFGL1expressionandOSinserous/mixedcarcinoma,andthatbetweenFGL1expressionandRFSinserous/mixedcarcinomawereanalyzed,respectively.Pvaluewascalculatedbylog-ranktest.C.Pearsoncorrelation(riscorrelationcoefficient)betweenLAG-3/FGL1andtheinfiltrationabundanceofvariousimmunecells.D.ExpressionofFGL1innormaltissue,endometrioidcarcinomasandserous/mixedcarcinomasweredifferent.t-testwasusedtocomparethedifferencebetweengroups.E.RelationshipbetweenFGL1expressionandTMB.PatientsweredividedintotwogroupsaccordingtothemedianvalueofFGL1expression.DifferenceofTMBbetweengroupswascalculatedbyMann-Whitneytest.
3 讨 论
近年来,免疫治疗在抗肿瘤领域取得巨大进展。其中,免疫检查点抑制剂如Ipilimumab(靶向CTLA-4)、Nivolumab和Pembrolizumab(靶向PD-1)已经获批用于临床治疗,靶向LAG-3的抑制剂也已开展临床试验。针对晚期/复发性EC,虽然目前尚无大规模随机对照临床试验结果,但多项小样本试验、个案报道提示免疫治疗有巨大潜力。比如,PD- 1抗体Pembrolizumab治疗MMR基因缺陷型复发性EC,总反应率和疾病控制率分别为55%和89%[23]。另一项研究报道了2例多次复发、难治性EC患者,应用PD- 1抑制剂Nivolumab进行治疗,治疗反应良好[16]。然而,临床试验KEY- Note 028纳入了24例PD- L1表达评分大于1的、MSI- H型EC患者,经Pembrolizumab治疗后,总有效率仅为12.5%[24]。这些结果表明,虽然免疫治疗能让部分EC患者获益,如何筛选获益患者、以及药物选择仍有待进一步研究。
EC的四种分子亚型与免疫检查点抑制剂治疗反应有潜在关联。POLE突变型和MSI型肿瘤具有广泛的基因突变,TMB更高。研究表明,在非小细胞肺癌(non-small cell lung cancer,NSCLC)中高TMB与PD- 1/PD- L1抑制剂获益显著相关[12- 13]。可能是因为高TMB的肿瘤有机会产生更多肿瘤新抗原,由此刺激抗肿瘤免疫应答反应。文献还报道,POLE突变型EC组织中浸润T细胞和CD8+T细胞数目,以及PD-1表达显著升高[14]。本研究对TCGA数据库中更新后的521例EC患者进行再分析,同样证实POLE突变型和MSI型的肿瘤中总白细胞、T细胞以及CD8+T细胞浸润程度显著升高。这与TCGA样本的HE染色一致,其结果显示POLE突变型肿瘤中淋巴细胞浸润最丰富,而MSI型的浸润程度介于POLE突变型和微卫星稳定型之间[15]。本研究也再次证实POLE突变型和MSI型EC中PD-1和PD-L1的表达明显高于另外两种亚型。Eggink等[25]通过免疫组化的方法也同样证明该现象。TIM-3作为免疫检查点分子,在肿瘤免疫逃逸中发挥作用,可作为潜在的肿瘤免疫治疗靶点[26]。本研究虽然发现TIM-3在POLE/MSI型EC中高表达,但其配体Gal-9在四种分子亚型中表达差异无统计学意义,与预后的相关性也无统计学意义。因此,靶向TIM-3/Gal-9通路在EC中的意义尚需进一步研究。此外,我们发现免疫抑制分子CTLA-4/CD80在POLE突变型和MSI型中的表达显著高于TP53突变型及NSMP亚型。因此,抗PD-1/PD-L1和抗CTLA-4治疗在POLE突变型和MSI型中的应用均值得进一步深入研究。
LAG-3是活化T细胞表面的另一个免疫抑制性受体。LAG-3在肿瘤浸润淋巴细胞表面中表达上调,而阻断LAG-3可以提高抗肿瘤T细胞反应[27- 28]。此外,同时阻断LAG-3和PD-1两条通路比单独阻断任何一条通路具有更好的抗肿瘤效应,提示LAG-3与PD-1在肿瘤免疫逃逸机制中起协同作用[9, 27- 28]。因此LAG-3是一个重要的免疫治疗靶点,目前已经在血液肿瘤(NCT02061761)和实体肿瘤(NCT01968109)中开展相关临床试验。本研究发现LAG-3在EC的四种分子亚型中的表达趋势与PD-1、CTLA-4相似,提示抗LAG-3可能作为EC治疗靶点。FGL1最近刚被鉴定为LAG-3的配体,在肿瘤免疫抑制中发挥重要作用[9]。本研究发现,FGL1在EC中的表达趋势与其他免疫抑制分子有一定差别。比如FGL1在POLE突变亚型中表达并不高,而在MSI中表达升高。此外,FGL1在NSMP中表达也异常升高。进一步分析发现,FGL1的表达与T细胞、Treg细胞、巨噬细胞等间质细胞成分均无相关性,而在子宫内膜样癌中显著高于正常对照组织。这与文献报道一致,FGL1在NSCLC中主要表达于癌细胞,而肿瘤间质表达较低[9]。在NSCLC组织中,FGL1高表达与患者不良预后显著相关[9]。本研究发现在子宫内膜样癌中,FGL1高表达的患者RFS较好,而在浆液性或混合型癌中FGL1表达与患者预后的关系无统计学意义。这表明,LAG-3/FGL1通路调控较为复杂,在不同癌种、不同病理学类型中可能有不同机制。总之,LAG-3/FGL1通路在EC中异常表达,提示该通路可作为EC免疫治疗的另一个候选靶点,为后续基础研究和临床研究提供了思路。
综上所述,抗PD-1/PD-L1治疗EC在小样本试验中已经显示出较好的治疗反应和临床获益。本研究通过分析TCGA数据库中较大样本的EC基因数据,发现PD-1、CTLA-4和LAG-3分子在POLE突变型和MSI型EC中表达升高。特别是LAG-3/FGL1通路的表达特征具有重要临床意义。因此,单独靶向其中任意一条通路或联合阻断多条通路,均可作为EC免疫治疗的候选策略。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
