非小细胞肺癌EGFR- TK非经典突变临床研究进展*
2019-07-30赵云飞综述李晓琴刘春玲审校
赵云飞 综述,李晓琴,刘春玲 审校
830011 乌鲁木齐,新疆医科大学附属肿瘤医院 肿瘤内科(赵云飞、刘春玲); 510000 广州, 广东省第二人民医院 肿瘤二科(李晓琴)
肺癌是目前对全人类生命健康威胁最大的恶性肿瘤之一[1-2]。肺癌按照组织学类型分为小细胞肺癌及非小细胞肺癌(non-small cell lung cancer,NSCLC),其中80%~85%肺癌为NSCLC[3]。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)Gefitinib于2003年被美国食品药品监督管理局批准用于治疗晚期NSCLC[4],该类药物通过抑制酪氨酸酶磷酸化达到抑制肿瘤生长及延长晚期NSCLC患者无进展生存期(progress-free survival,PFS)的效果[5-6]。EGFR敏感突变患者可接受EGFR-TKIs治疗[7-8]。在亚洲,此类患者约占NSCLC患者总人数的50%[9]。19号外显子的缺失突变(Del19)和21号外显子点突变(L858R)约占EGFR总突变的84.60%,此二类突变类型已被确定为TK敏感突变。除敏感突变外,发生在18~21号外显子中的其他突变被称为非经典突变,约占总EGFR突变的12.10%[10]。EGFR-TKIs在晚期EGFR敏感突变类型的NSCLC患者中的疗效显著在多项临床实验中被证实[11-12]。由于EGFR非经典突变的NSCLC患者突变率低,其靶向药物治疗方案缺乏高级别循证医学数据支持,而各类EGFR非经典突变对各类EGFR-TKIs治疗结局差别巨大[13]。因此针对EGFR非经典突变的相关研究具有重要的医学价值。
1 EGFR突变现状
EGFR基因突变约95%以上发生在18~21号外显子中,约3.30%发生在其他外显子中。在18~21号外显子突变中,敏感突变约占84.60%,18号外显子非经典突变约占3.70%,19号外显子非经典突变约占0.60%,20号外显子非经典突变约占6.90%,21号外显子非经典突变约占0.90%[10,14-15](图1)。
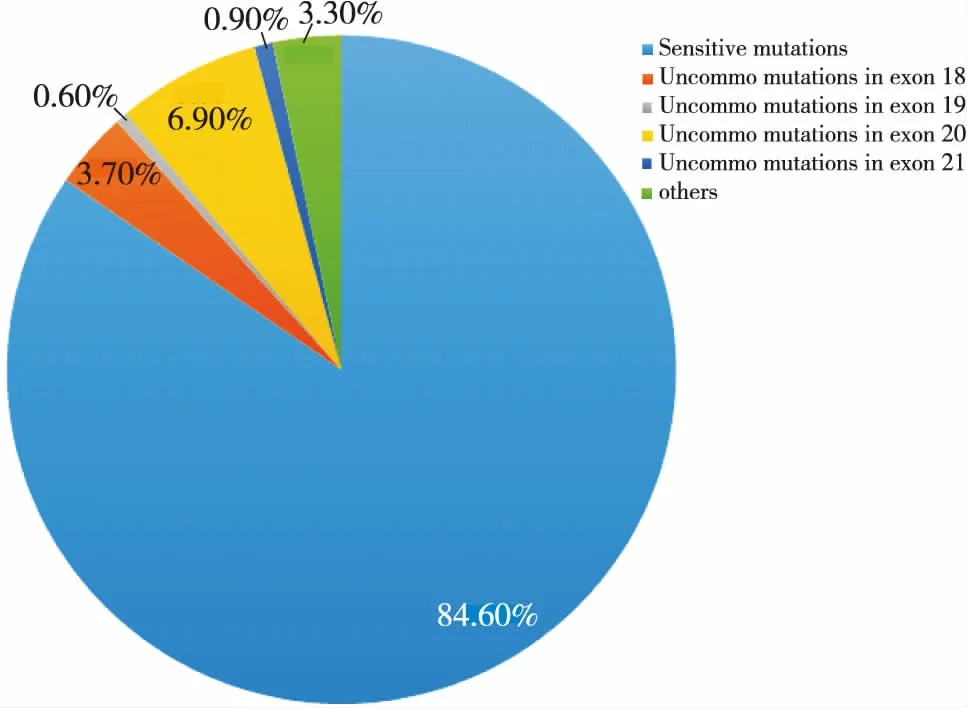
图1 EGFR基因突变形式构成比
Figure 1. Constituent Ratio of EGFR Gene Mutation Forms
2 EGFR非经典突变基因相关研究
2.1 18号外显子的相关研究
18号外显子非经典突变主要表现为密码子G719X、E709X点突变与密码子709处缺失突变[13]。
2.1.1 G719X突变 EGFR中的G719X(X表示A,S,C等)突变是指点突变,导致719位的甘氨酸被其他残基取代,分别为丙氨酸(G719A),丝氨酸(G719S),半胱氨酸(G719C)。G719X突变约占总EGFR突变的3.10%[10]。 Choi 等[16-18]发现G719S突变致癌性较敏感突变弱,并在体外实验中进一步发现Gefitinib能以增加剂量的方式抑制G719S的自身磷酸化。与敏感突变L858R相比,Gefitinib需要以更高的浓度抑制G719S突变[19]。在临床实验中,Chiu等[20]发现在G719X突变患者中,口服一代TKIs(包括Gefitinib与Erlotinib)的客观缓解率(objective remission rate,ORR)和疾病控制率(disease control rate,DCR)分别为36.8%和72.4%,证实了G719X突变较敏感突变相比更低的中位生存时间(6.3月vs11.1月)。Otsuka等[21]报道在接受一代TKIs治疗的G719X突变患者中,接受Erlotinib治疗较接受Gefitinib治疗的患者拥有更长的PFS。二代TKIs中Neratinib在G719X突变类型的患者中表现出显著的疗效,3/4的G719X突变患者表现出部分缓解,肿瘤直径缩小超过50%,ORR为75%,DCR为100%,但由于其对EGFR敏感突变患者无效,因此,Neratinib在肺癌治疗中的地位仍不确定[22-23]。此外,Yang等[24]在LUX-Lung试验系列中发现,接受Afatinib治疗的G719X突变患者,ORR为77.8%(14/18)。表明二代TKIs在G719X突变患者中较一代TKIs拥有更加显著的疗效。
2.1.2 E709X突变 E709X点突变为18号外显子的另一非经典突变,E709X突变约占总EGFR突变的0.30%[10]。其对一代TKIs疗效反应较敏感突变低,Wu等[25]学者研究发现:在接受一代TKIs治疗的25例E709X突变患者中对EGFR-TKIs的DCR为72.2%(13/18),中位PFS为6.2月(范围0.6~77.4月),中位总生存期为29.3月(范围5.4~104.6月)。在体外实验中,与一代或三代TKIs相比,E709X点突变患者对Afatinib或Neratinib具有高度敏感性[13]。
2.1.3DelE709-T710insD Del E709-T710insD是密码子709处最常见的缺失突变[13],约占总EGFR突变的0.30%[10]。目前缺乏临床研究数据。Kobayashi等[13]的体外基础研究表明二代EGFR-TKIs较一代TKIs对DelE709-T710insD转染的Ba/F3细胞抑制作用更强。
2.2 19号外显子的相关研究
19号外显子非经典突变表现为插入突变和点突变。
2.2.1 19号外显子插入突变 19号外显子插入突变约占EGFR突变的0.60%[10],包括:I744-K745ins-KIPVAI、K745-E746insIPVAIK、K745-E746insVPVAIK、K745-E746insTPVAIK。目前缺乏临床试验数据。体外试验均显示19号外显子插入突变对Afatinib敏感[10]。
2.2.2 19号外显子点突变D761Y 19号外显子点突变主要表现为D761Y,有研究认为它的出现可能与EGFR-TK耐药相关,但耐药程度弱于20号外显子点突变T790M[26- 27]。目前缺乏临床试验数据。
2.3 20号外显子的相关研究
20号外显子非经典突变主要表现为插入突变与点突变。
2.3.1 20外显子插入突变 20号外显子插入突变包括:V769-D770insASV、D770-N771insSVD、H773-V774insH、A763-Y764insFQEA、H773-V774insPH、H773-V774insNPH、N771-P772insH、H771-P772insN、H773-V774insAH、D770delinsGY、V774-C775insHV。以上突变约占总EGFR突变的5.80%[10,28- 29]。除A763-Y764insFQEA外,EGFR20号外显子插入突变对一、二代TKIs靶向治疗不敏感[30- 31]。研究发现A763-Y764insFQEA突变在体外实验中可被亚微摩尔浓度的一代TKIs抑制。3例携带 A763-Y764insFQEA突变的NSCLC患者经每日150毫克Erlotinib治疗后,影像学表现病灶缩小或稳定。因此,有研究者认为A763-Y764insFQEA是EGFR-TK敏感突变[32]。
在最新体外实验中发现,Poziotinib有效抑制了具有EGFR20号外显子插入突变的Ba / F3细胞系的生长。Poziotinib在具有EGFR20号外显子插入突变的Ba / F3细胞系中平均IC50值(50%的抑制浓度)为1.0nM,使得Poziotinib较Osimertinib疗效增强约100倍,并且在体外比Afatinib强40倍。在Poziotinib的II期临床试验中,起始剂量为每日口服16mg,超过半数(55%)患者接受剂量减少,最常见的不良事件为:皮疹和腹泻。 根据实体瘤反应评估标准(Response Evaluation Griteria in Solid Tumors,RECIST)1.1, 11名患者ORR为64%。虽然临床数据尚未成熟,但截至2018年1月,11例患者中5例有疾病进展,尚未达到中位PFS[33]。针对EGFR20号外显子插入突变的氨基甲酸酯药物正在研发中,其在携带EGFR20号外显子插入突变的 Ba/F3 细胞和EGFR P772-H773insPNP患者衍生的肺癌细胞系DFCI127中表现出优异的抑制信号传导作用[34]。体外研究报道,EGFR20号外显子插入突变对Osimertinib敏感[35],但仍缺乏临床试验数据。
2.3.2 20号外显子点突变 20号外显子点突变主要为:S768I,约占总EGFR突变的1.10%[10]。在体外实验中,S768I突变对Afatinib较Osimertinib更敏感[36]。在LUX- Lung 2、3和6试验的联合分析中,接受Afatinib治疗的S768I突变患者,ORR为100%,中位PFS为14.7个月[24]。
2.3.3 20号外显子耐药突变T790M 20号外显子中T790M点突变的发生率可高达50%[37],但在新诊断的患者中很少发现突变[38]。T790M为EGFR- TKIs治疗的耐药突变已经被证实,排除非经典突变范围[32]。
2.4 21号外显子的相关研究
21号外显子非经典突变主要表现为点突变L861Q,约占总EGFR突变的0.90%[10,39- 40]。L861Q 突变是由21号外显子第2828位点的 T 被 A 取代所致,具有类似于L858R突变的致癌活性[35]。日本的一项多中心回顾性研究显示L861Q突变患者接受一代EGFR- TKIs的ORR为37.5%、DCR为87.5%[21]。Yang 等[24]的LUX- Lung 试验系列研究中,16例L861Q突变患者使用Afatinib的ORR为56.3%、PFS为8.2个月、OS为17.1个月,显示与一代 EGFR- TKIs比较,二代Afatinib疗效更佳,可以获得更长的 PFS 和更高的ORR。对于第3代的EGFR- TKIs,Banno等[36]体外研究发现L861Q突变对于Osimertinib敏感,但目前缺少临床试验数据。
3 小 结
总之,NSCLC中,由于非经典突变发生率低,针对非经典突变的研究缺乏高等级循证医学数据支持,但目前研究表明其客观有效率及无进展生存期较敏感突变对EGFR- TKIs反应低且对各种EGFR- TKIs反应差别较大。根据EGFR非经典突变靶向治疗的疗效制定治疗方案,对这类NSCLC患者的治疗尤为重要。目前,针对Ins20非经典突变的新药研究有重大进展,为非经典突变患者带来了更多的生存希望。当前,精准治疗已经是肿瘤的治疗模式之一,非经典突变的治疗对不同EGFR- TKIs治疗反应差别较大且当TKIs治疗失败后,不同非经典突变类型患者的后续治疗方案是否有所差异,仍需我们继续探索。但随着检测手段的多样化及简易化,可实现动态监测患者基因状态,为临床靶向治疗提供了坚实的精准治疗证据及后续治疗选择。随着更多检测方法的应用,例如高通量测序,越来越多的非经典突变及复合突变被发现,这对临床医生提出了更大挑战,如何给予患者更加适合的靶向治疗选择仍需我们进一步深入研究。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
