ADH1B对鼻咽癌细胞的增殖及迁移能力的影响*
2019-07-30吴梦鸽张睿刘芮吟费继敏杨翠萍
吴梦鸽,张睿,刘芮吟,费继敏,杨翠萍
650118 昆明,昆明医科大学第三附属医院 头颈外二科(吴梦鸽、张睿、刘芮吟、费继敏); 650223 昆明,中国科学院昆明动物研究所(杨翠萍)
鼻咽癌(nasopharyngeal carcinoma,NPC)是一种来源于鼻咽上皮细胞的恶性肿瘤,常发生于鼻咽顶后壁的顶部,以低分化鳞状细胞癌和未分化癌最为常见[1]。中国人群的NPC发病率及死亡率明显高于世界平均水平,目前以约全球20%的人口负担全球NPC发病死亡的40%[2],已成为头颈肿瘤的主要癌种和病死因素[3]。由于该病具有发病部位隐匿、深在且侵袭、迁移能力强等组织生物学特性,故病变一般发现晚,手术完全切除困难,同步放化疗是目前NPC的主要治疗方式[4]。对于早期NPC,放疗能有效改善患者的预后,但晚期患者常存在放疗抵抗,超过20%的NPC患者在治疗后最终发生远处转移,患者5年生存率仅为43.8%[5]。晚期NPC患者治疗失败等难题至今尚未找到全面解决的良策,故寻找与NPC治疗和预后相关的新的分子标志,对NPC的临床防治具有重要意义。由基因ADH1B编码的ADH1B蛋白是将乙醇转化为乙醛的主要酶[6]。大量的证据表明,ADH1B基因的差异性表达有导致头颈部肿瘤[7]、肝癌[8]、乳腺癌[9]、胰腺癌[10]、结直肠癌[11]等癌症的风险,但该基因在NPC中的研究甚少。本研究通过测定鼻咽癌细胞株以及正常的鼻咽上皮细胞株中ADH1B的mRNA表达量,并构建鼻咽癌ADH1B过表达细胞系,利用生长曲线实验及划痕实验来解析ADH1B对鼻咽癌细胞增殖及迁移能力的影响,旨在为NPC的临床治疗提供新思路和靶点。
1 材料和方法
1.1 生物信息学分析ADH1B在头颈鳞癌中的表达情况
利用生物信息学分析网站GEPIA(http://gepia.cancer- pku.cn/)来进行分析,数据来源于癌症和肿瘤基因图谱(Cancer Genome Atlas,TCGA)。进入网站,选择用箱图来显示表达量,输入基因为ADH1B和肿瘤类型为HNSC,点击分析获得结果和P值。
1.2 细胞培养
永生化正常人鼻咽上皮细胞NP69、鼻咽癌细胞CNE- 1、CNE- 2、5- 8F、6- 10B均由中山大学肿瘤防治中心曾木圣研究员提供,HEK- 293T细胞由中国科学院昆明动物研究所肿瘤信号转导实验室提供。其中CNE- 1、CNE- 2、5- 8F、6- 10B的培养基为补充有10%胎牛血清(GIBCO,10099141,澳洲)的RPMI- 1640培养基(CORNING,10- 040-CVR,美国),NP69的培养基为补充有10%胎牛血清的DMEM/F- 12培养基(CORNING,10- 092- CVR,美国),HEK- 293T的培养基为补充有10%胎牛血清的DMEM/High glucose培养基(CORNING,10- 013-CVRC,美国)。所有细胞的培养条件如下:温度为37℃,并控制CO2浓度为5%。细胞长至80%~90%传代。
1.3 质粒构建与稳转细胞系的建立
针对ADH1B设计过表达的质粒,对照为pCDH空载体。将合成好的ADH1B的CDS区核苷酸序列目的片段连接至载体pCDH,抽取质粒进行NheⅠ(NEB,R3131,美国)和NotⅠ(NEB,R3189,美国)酶切鉴定,扩增阳性目的质粒。通过磷酸钙转染法将目的质粒导入HEK- 293T细胞进行病毒制备,病毒液用0.45 μM的滤膜 (Millipore,SLHV033RB,爱尔兰)过滤后感染目的细胞CNE- 1、CNE- 2、5- 8F、6- 10B,使用polybrene (SantaCruz,sc- 134220,美国)促进感染效率,用相应浓度的嘌呤霉素(invivogen,ant- pr- 1,美国)筛选阳性细胞,扩增并用RT- qPCR鉴定目的基因的过表达效率。
1.4 qRT- PCR
首先用Trizol法(AMBION,15596026,美国)抽提细胞总RNA,用超微量核酸蛋白测定仪(Nanodrop,ND2000,美国)测定RNA浓度,用PrimeScript反转试剂盒(Takara,RR047A,美国),在PCR仪(Biorad,T100,美国)进行反转录反应(Reverse Transcription- PCR,RT- PCR),将RNA反转为cDNA。然后在实时荧光定量PCR仪(Life,7500,美国)进行qPCR反应,每个样本设置3个重复孔。热循环参数如下:50℃,2min;95℃,2min;95℃,10min;95℃,15s,60℃ 1min,40×。
所用引物由昆明硕擎生物技术有限公司合成,ADH1B的上下游引物分别为:5’- AAGGGGGCTGTTTATGGTG- 3’; 5’- GCCATCACGCCACAGTTTC- 3’。 β- actin的上下游引物分别为:5’- CATGTACGTTGCTA-TCCAGGC- 3’;5’- CTCCTTAATGTCACGCACGAT- 3’。
1.5 生长曲线
为测定细胞增殖能力,取对数期生长的细胞,消化制成细胞悬液,进行浓度测定。按照所需细胞数1.0×104/孔,用完全培养基配制相应的细胞悬液按照1 mL/孔种至12孔板(NEST,712001,中国),37℃、5% CO2培养6天;每天进行计数,根据浓度分别算出细胞数,绘制生长曲线。
1.6 细胞划痕实验
分别取一盘6孔板(NEST,703001,中国)中细胞生长状态良好、细胞密度相近的实验组和对照组细胞,用枪头垂直划痕并在0h拍照。放入37℃ 5% CO2培养箱培养。按12h、24h时间点取样,拍照。将实验组和对照组所有图片进行对比,得出实验结果。
1.7 统计学处理
应用SPSS 16.0软件进行统计学分析。qRT- PCR和细胞划痕实验采用t检验,生长曲线采用重复测量资料的方差分析,检验水准α=0.05,P<0.05为差异有统计学意义。文中*表示P<0.05,**表示P<0.01,***表示P<0.001。
2 结 果
2.1 ADH1B在鼻咽癌细胞中的表达被抑制
为了明确ADH1B在NPC中的表达情况,我们首先在临床肿瘤样本中寻求基因表达谱的变化,目前已有的基因表达谱中没有NPC临床肿瘤组织中的数据,但是TCGA数据中ADH1B在519例HNSC患者样本和44例正常样本的表达的差异结果显示,ADH1B在肿瘤样本中比正常样本低,差异有统计学意义(P<0.05,图1)。NPC作为头颈肿瘤的主要癌种和病死因素,病理类型中90%为低分化鳞癌及未分化癌,推测ADH1B在NPC发生发展中发挥了重要的作用。因此,我们分析了ADH1B在正常永生化鼻咽上皮细胞NP69及鼻咽癌细胞CNE- 1、CNE- 2、5- 8F、6- 10B中的相对mRNA表达。结果显示,ADH1B的mRNA表达在所有鼻咽癌细胞中显著下调,分别下调了99.95%、99.94%、99.97%、99.96%(P<0.001,图2)。

图1ADH1B在头颈鳞状细胞癌及正常组织中的相对表达量 (*P<0.05)
Figure1.Relative Expression ofADH1Bin Head and Neck Squamous Cell Carcinoma and Normal Tissue

图2 不同鼻咽癌细胞中ADH1B的相对mRNA表达
Figure 2. Relative mRNA Expression ofADH1Bin Different Nasopharyngeal Carcinoma Cell Lines
NP69(normalimmortalizednasopharyngealepithelialcells)andCNE-1,CNE-2,5-8F,6-10B(nasopharyngealcarcinomacells)wereincludedinanalysis.***P<0.001.
2.2 构建ADH1B在鼻咽癌细胞中的过表达稳转细胞系
在鼻咽癌细胞中ADH1B表达被抑制的基础上,构建ADH1B过表达载体及对照载体pCDH,转染HEK- 293T细胞包装病毒后收上清感染鼻咽癌细胞系CNE- 1、CNE- 2、5- 8F、6- 10B,在1μg/mL的嘌呤霉素作用下,构建了不同的鼻咽癌稳转细胞系,并用qRT- PCR方法验证了ADH1B过表达的效率(P<0.001,图3),从实验结果显示四株鼻咽癌细胞均被过表达,分别过表达了9 766、1 757、1 032、3 987倍。
2.3 过表达ADH1B抑制鼻咽癌细胞的增殖能力
肿瘤细胞的特点之一是肿瘤细胞增殖出现异常,因此利用建立好的ADH1B稳定过表达细胞系,通过生长曲线实验来验证其对鼻咽癌细胞增殖能力的影响。生长曲线结果显示,与对照组pCDH相比,过表达ADH1B组鼻咽癌细胞的增殖均受到了抑制,差异有统计学意义(P<0.05,图4)。第6天过表达ADH1B组的细胞数量分别是pCDH对照组的73.75%、70.87%、73.02%、71.52%。
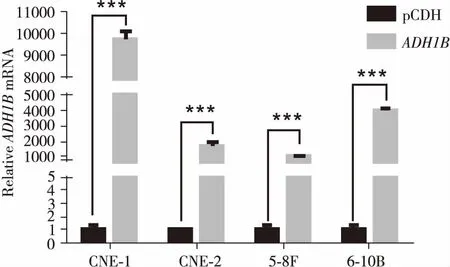
图3 RT- qPCR验证鼻咽癌细胞ADH1B过表达效率
Figure 3.Efficiency ofADH1B(Nasopharyngeal Carcinoma Cell Line) Overexpression Verified by RT-qPCR
pCDHwassetascontrolgroup.***P<0.001.
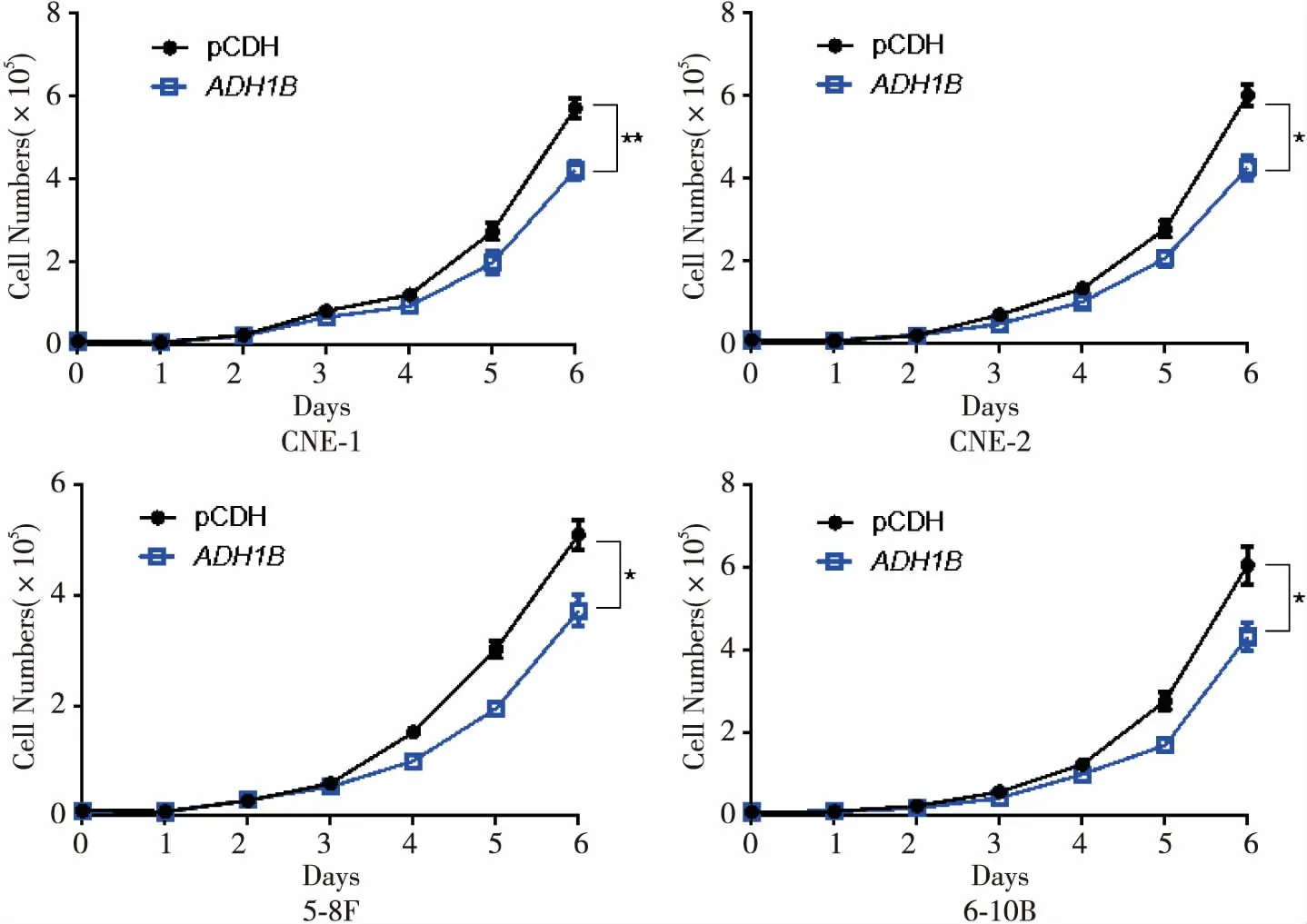
图4 过表达ADH1B抑制鼻咽癌细胞的增殖能力(*P<0.05,**P<0.01)
Figure 4.Proliferation of Nasopharyngeal Carcinoma CellsInhibited byADH1BOverexpression (*P<0.05,**P<0.01)
2.4 过表达ADH1B抑制鼻咽癌细胞的迁移能力
NPC的另一显著特点即迁移能力强,因此,我们设计了细胞划痕实验,通过比较同一时间点细胞愈合的面积,发现过表达ADH1B后鼻咽癌细胞的迁移能力也明显受到抑制(P<0.001,图5)。其中CNE- 1细胞对照组24h划痕创口面积为9.21%,过表达ADH1B的实验组划痕创口面积为36.3%(P<0.001);CNE- 2细胞对照组24h划痕创口面积为18.1%,过表达ADH1B的实验组划痕创口面积为45.4%(P<0.001);5- 8F细胞对照组24h划痕创口面积为27.2%,过表达ADH1B的实验组划痕创口面积为44.6%(P<0.001);6- 10B细胞对照组24h划痕创口面积为25.1%,过表达ADH1B的实验组划痕创口面积为41.2%。
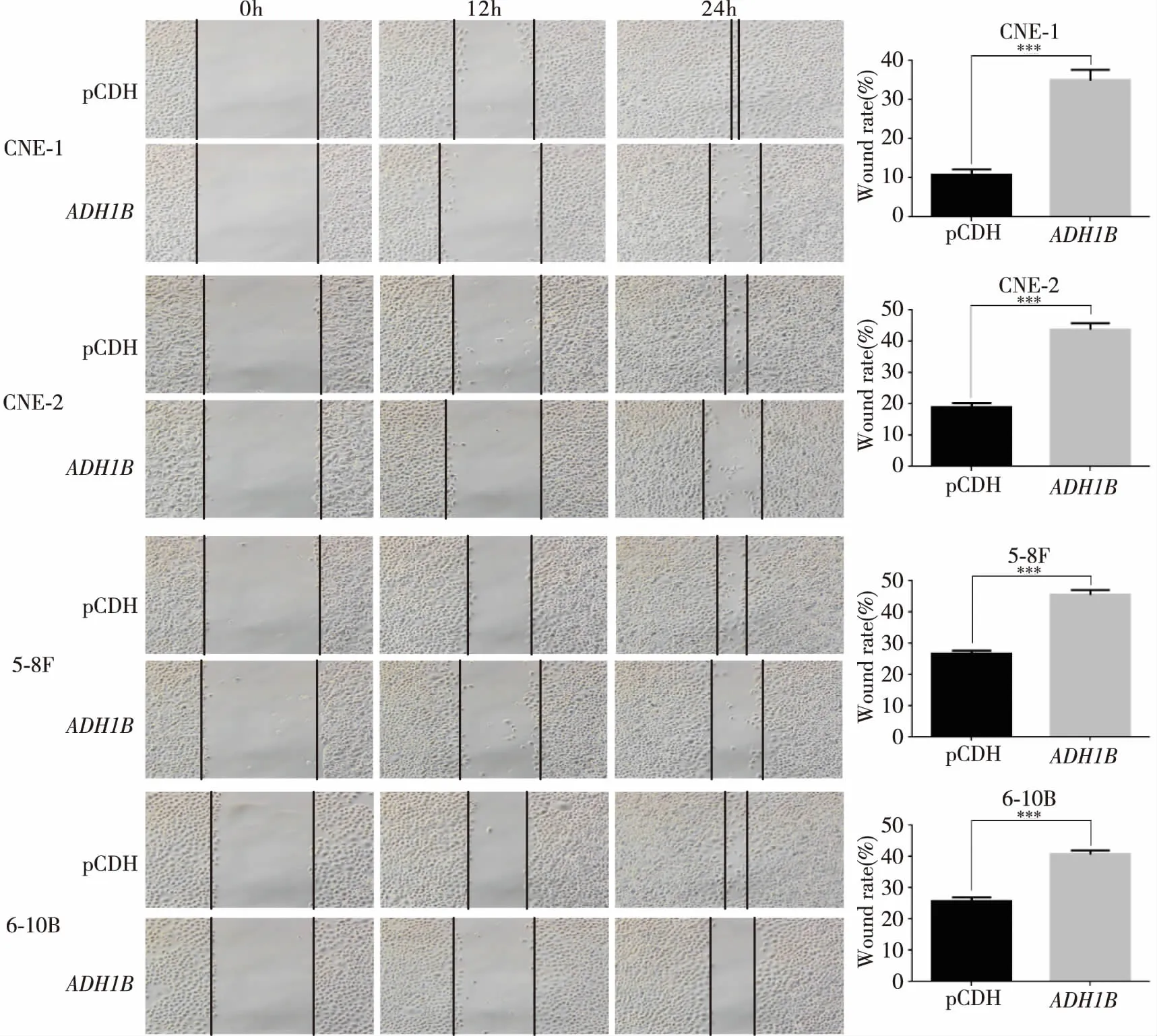
图5 过表达ADH1B抑制鼻咽癌细胞的迁移能力(***P<0.001)
Figure5.Migration of Nasopharyngeal Carcinoma Cells Inhibited byADH1BOverexpression (***P<0.001)
3 讨 论
我国NPC的发病率和死亡率居世界首位,并且在老年人口中相对较高。鉴于我国社会人口老龄化的形势将愈加严峻,未来NPC的发病率有可能还会持续上升[12]。同步放化疗一直是NPC主要和首选的治疗手段。早期NPC高度可逆,但局部治疗失败和远处转移仍是晚期NPC患者不良预后的主要原因[13]。NPC的病因尚未完全明确,目前认为NPC的发生是多因素的,为EB病毒(Epstein- Barr Virus,EBV)潜伏感染[14]、酒精、职业接触粉尘以及吸烟等环境因素相互作用的多步骤发展过程。其中,酒精是NPC确定的危险因素[15-16]。基于足够的流行病学证据,国际癌症研究机构(IARC)已经将酒精饮料定义为“对人类致癌”类食品,如口腔癌、咽癌、喉癌、食道癌、肝癌、结直肠癌和女性乳腺癌等。
作为乙醇脱氢酶(ADH)家族的一员,ADH1B基因编码I类ADH的β亚基,是组成功能性酶蛋白的主要亚基,ADH1B基因与其他人ADH基因(ADH4,ADH5,ADH6和ADH7)一起定位于染色体4q23[17]。ADH1B将乙醇代谢为乙醛,乙醛通过醛脱氢酶进一步氧化成乙酸。如果累积超过一定阈值,乙醛可以与DNA嵌入形成致癌物质,从而增加癌症发生的机会[18]。对ADH的研究开始于1937年首次从酿酒酵母(Saccharomycescerevisiae)中纯化出ADH蛋白,以往对ADH1B的研究多集中在酒精代谢和饮酒行为等问题,在肿瘤的形成及发生发展中的研究相对较少。近年来,有研究者在多种肿瘤模型的研究中发现了ADH1B基因的差异表达对肿瘤有很大的影响[19]。Li等[20]通过一种新的方法- 交叉值关联分析(Cross- Value Association Analysis,CVAA)研究发现,从Broadhos Institute的基因组数据分析鉴定肿瘤类型与肿瘤类型正常样品之间差异表达的基因,ADH1B(排名第一)在几乎所有癌症类型中都被抑制,并且细胞体外实验证实了ADH1B有抑制癌细胞的能力。Polimanti等[21]研究ADH1B分子途径,发现ADH1B基因参与多种抗肿瘤药物的代谢,包括异环磷酰胺和环磷酰胺。Gharpure等[22]也在卵巢癌中发现ADH1B的差异表达能使细胞分泌MMP- 7、CD- 26和组织蛋白酶来促进癌症进展。
ADH1B在鼻咽癌的发生发展中是否起到了一定作用目前仍不明确。本研究发现,ADH1B在HNSC患者样本中显著低表达,且ADH1B在鼻咽癌细胞中被下调,通过在鼻咽癌细胞中过表达ADH1B后,模拟正常细胞内ADH1B蛋白的表达,可以显著抑制鼻咽癌细胞的增殖和迁移能力,逆转细胞的恶性程度,提示ADH1B在NPC的发生发展中发挥了重要功能。因此,ADH1B在调节鼻咽癌细胞增殖、迁移中具有关键作用,或可作为NPC治疗中的潜在治疗靶标或预测指标。然而,ADH1B通过何种方式来影响鼻咽癌细胞的恶性生物学行为,其上游及下游是否存在特异性的调控通路,目前尚未得知,需要收集大量的样本进行深入研究,结合其他因素进行多指标、多因素综合分析,进一步研究解析其作用机制。这将对NPC的临床防治具有重要意义,并为NPC的防治开拓新思路和提供一定的理论意义和应用价值。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
