基于SEER数据库构建小细胞肺癌术后患者生存预测模型*
2019-07-30潘辉张亚雷肖大凯郭志华张晋昕何嘉曦
潘辉,张亚雷,肖大凯,郭志华,张晋昕,何嘉曦
510120 广州,广州医科大学附属第一医院 转化医学实验室(潘辉、肖大凯),胸外科(潘辉、张亚雷、郭志华、何嘉曦); 510080 广州,中山大学 公共卫生学院(张晋昕)
小细胞肺癌(small cell lung cancer, SCLC)是肺癌的一种病理亚型,其恶性程度高,极具侵袭性,且临床预后不佳。据统计,全球每年约有34 000例新增SCLC病例[1],在肺癌患者中的构成比约为13%~20%[2]。SCLC患者的预后不理想,局限期患者的5年生存率为20%,而广泛期患者的3年生存率仅有10%~15%[3-4]。
早期的一些研究表明单纯放射治疗比手术治疗有优势,放疗能有效延长SCLC患者的总生存期[5]。最新的研究则发现,外科手术治疗后无需放疗,患者同样能获得较好的总生存期[6]。这些研究结果都提示,对于SCLC患者,应该改变以往的治疗策略,并重视外科切除的治疗方式。
临床分期是影响SCLC患者预后的重要因素。针对小细胞肺癌,临床上常用的分期系统包括美国退伍军人医院的肺研究组分期系统(Veterans Administration Lung Study Group, VALSG)、国际肺癌研究联盟分期系统(International Association for the study of Lung Cancer, IASLC)和美国癌症联合委员会(AJCC)的TNM分期系统。各分期方法各有优势,但对肿瘤特点均未综合利用各因素信息[7-11]。
为了证实手术治疗对各分期小细胞肺癌患者的预后作用,我们通过分析美国国立癌症研究所大型肿瘤登记注册数据库“监测、流行病学和结果数据库”(Surveillance, Epidemiology, and End Result database, SEER)中的小细胞肺癌大样本数据,探索影响术后患者预后的因素,构建手术治疗后SCLC患者的生存预测模型,并以列线图(Nomogram)的形式呈现,用于为肿瘤医生和患者提供可信的预测信息。该模型拟考虑的因素包括患者肿瘤大小、肿瘤浸润范围、淋巴结清扫数量、阳性淋巴结数量、手术方式等。最后与TNM分期系统、VALSG分期系统和IASLC分期系统进行比较。
1 资料与方法
1.1 患者选择和数据收集
本研究基于SEER数据库的SCLC患者临床数据。美国国立癌症研究所建立的SEER数据库是世界公认的肿瘤患者随访数据权威来源之一,记录了美国部分州县40年来肿瘤患者的相关信息,为临床研究提供了可靠的数据支持[12]。通过SEER*Stat软件检索SEER数据库中2004至2012年病理诊断为SCLC的患者。
入选标准:1、数据库中病理诊断为SCLC患者为研究人群(ICD-O-3恶性肿瘤形态学编码为8041-8045),病理类型包括SCLC、燕麦细胞癌、梭形细胞、中间细胞和混合性细胞;2、肿瘤部位:肺叶及支气管(SEER数据的部位编码为340-349);3、2004年至2012年间接受手术治疗的患者。排除标准:1、死亡证明或尸检证实为SCLC的病例除外;2、随访信息不完整。本研究提取的临床数据包括:确诊时的年龄、性别、种族、肿瘤部位、手术方式、肿瘤大小、肿瘤侵犯范围、淋巴结转移情况、淋巴结清扫数量、放射性治疗的顺序、病理分化类型、远处转移情况、生存时间和生存状况。
1.2 统计分析
本研究使用统计软件SPSS 22.0、GraphPad Prism 5和R version 3.5.0软件进行数据统计分析。对入选病例进行生存分析:采用Kaplan-Meier法计算生存率和中位生存时间并绘制生存曲线,采用Log-rank检验方法比较手术组与非手术组的生存率差异。两组的协变量差异性的比较,定性资料采用卡方检验,定量资料采用t检验或者t’检验。
基于Cox比例风险模型,使用R软件构建小细胞肺癌手术患者生存预测模型。基于赤池信息准则(AIC),使用向后逐步回归法筛选模型的变量。模型评价采用一致性指数(C-index)。采用自抽样方法(Bootstrap)对模型进行内部验证,以降低模型的过度拟合。使用了R语言里“rcorrp.cens”程序包和“Himsc”程序包比较本研究的预测模型与其它分期系统预测准确性差异是否具有统计学意义。
2 结 果
2.1 手术切除治疗对小细胞肺癌患者的效用
依据制定的SEER数据检索策略,2004年至2012年间,符合入选条件的SCLC患者45 226例,接受手术治疗的患者867例。为了探索不同临床分期手术治疗对SCLC患者的治疗效用,将患者分为手术组和非手术组,并用Kaplan-Meier法绘制两组的生存曲线。如图1所示,手术组患者的总生存期要明显优于非手术组。这种现象不仅仅出现在无转移的患者上,即使患者出现远端转移,手术治疗仍能显示出其治疗优势。而且,无论是VSLSG还是IASLC分期系统,手术治疗对局限期和广泛期的患者都能延长患者的总生存期。
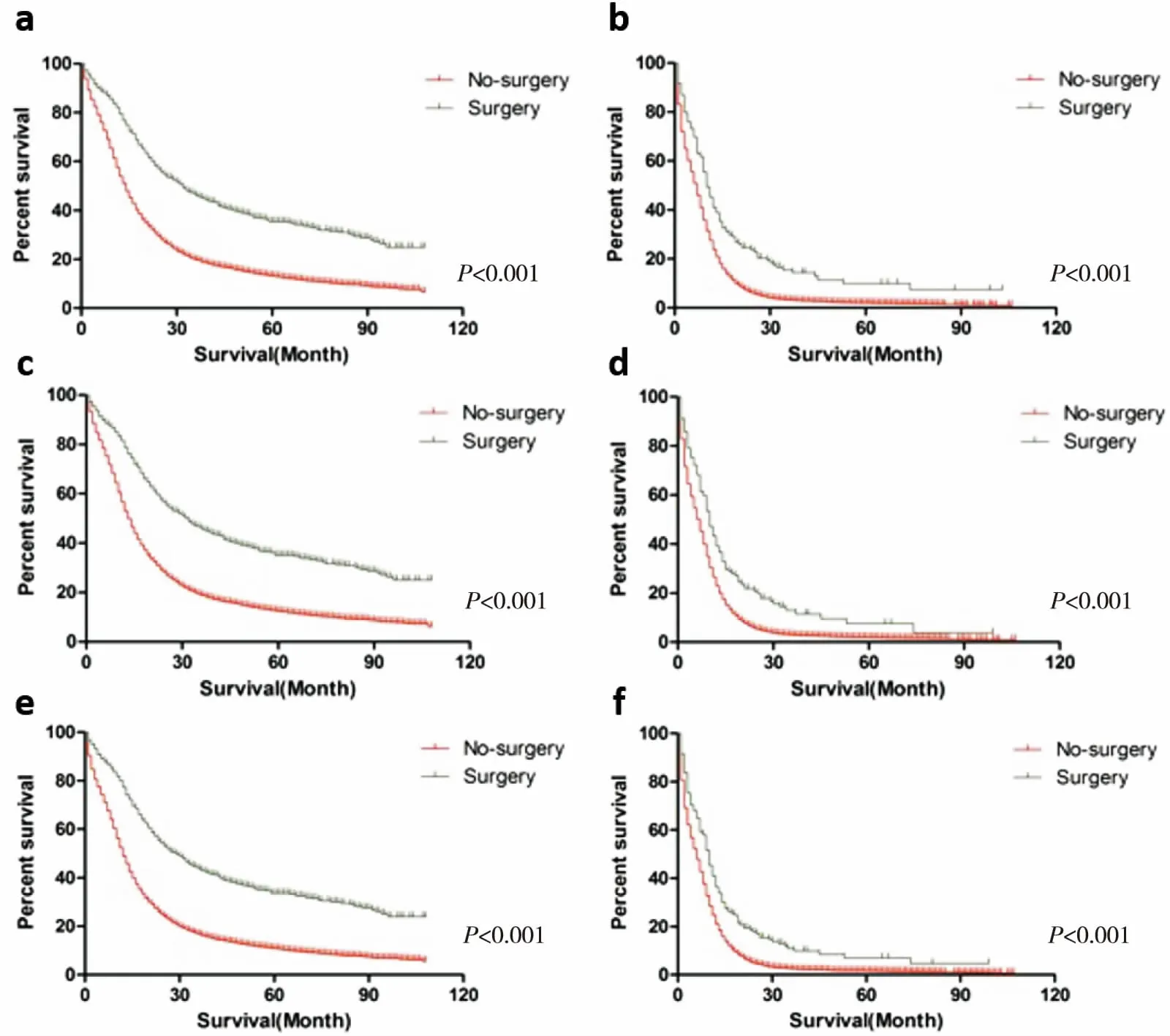
图1 不同分期小细胞肺癌患者手术治疗与否总生存期的比较
Figure 1. Overall Survival of Operative and Non-Operative SCLC Patients in Different Groups
a.SurvivalofSCLCpatientswithoutmetastasis;b.SurvivalofSCLCpatientswithmetastasis;c.SurvivalofLD-VALSGSCLCpatients;d.SurvivalofED-VALSGSCLCpatients;e.SurvivalofLD-IASLCSCLCpatients;f.SurvivalofED-IASLCSCLCpatients.
2.2 手术患者的临床特点及生存状况
根据制定的排除标准,从SEER数据库中共筛选出手术患者867名进行分析。其中457例患者为女性,410例为男性,患者的中位年龄为67岁(34~90岁),肿瘤平均大小为(3.06±2.12)cm,平均检测淋巴结(6.45±7.65)枚。研究人群中,以白种人为主(91.3%)。手术治疗方面,不同的根治性切除方式均有涉及,包括消融、亚肺叶切除、肺叶切除、全肺切除和其它术式。352例患者接受联合放射治疗。手术治疗SCLC患者的中位生存期为26个月(1~108个月)。患者1年生存率为73.5%,3年生存率为41.2%,5年生存率为31.1%。患者临床病理特征见表1。单因素和多因素分析显示,患者的年龄、性别、肿瘤大小、淋巴结清扫数量、手术方式、放疗情况、淋巴结侵犯情况、病理分化程度和远处转移情况是独立的预后影响因素(表2)。
表1 手术小细胞肺癌患者临床病理特征
Table 1. Characteristics of Postoperative Small Cell Lung Cancer Patients
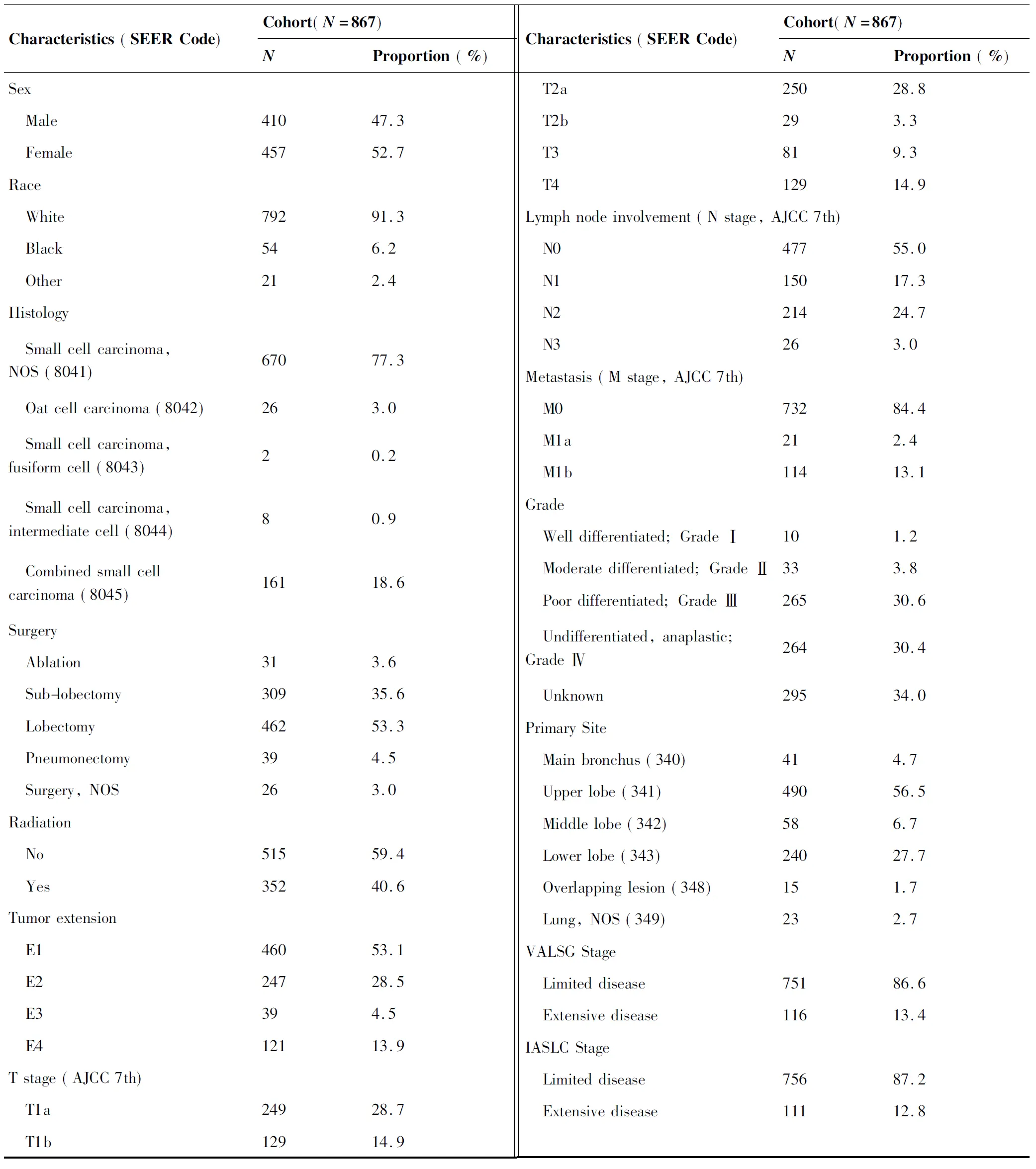
Characteristics (SEER Code)Cohort(N=867)NProportion (%)Sex Male41047.3 Female45752.7Race White79291.3 Black 54 6.2 Other 21 2.4Histology Small cell carcinoma, NOS (8041)67077.3 Oat cell carcinoma (8042) 26 3.0 Small cell carcinoma, fusiform cell (8043)2 0.2 Small cell carcinoma, intermediate cell (8044)8 0.9 Combined small cell carcinoma (8045)16118.6Surgery Ablation 31 3.6 Sub-lobectomy30935.6 Lobectomy46253.3 Pneumonectomy 39 4.5 Surgery, NOS 26 3.0Radiation No51559.4 Yes35240.6Tumor extension E146053.1 E224728.5 E3 39 4.5 E412113.9T stage (AJCC 7th) T1a24928.7 T1b12914.9
SEER: Surveillance, Epidemiology, and End Result database; VALSG: Veterans Administration Lung Study Group; IASLC: International Association for the study of Lung Cancer.
表2 手术小细胞肺癌患者单因素、多因素生存分析及模型变量筛选结果
Table 2. Univariate and Multivariate Analysis of Overall Survival of Small Cell Lung Cancer Patients and Variables Selected in Model 1

VariablesUnivariate analysisMultivariate analysisAICHR95%CIPHR95%CIPP Age1.031.02-1.03<0.0011.04 1.03-1.05<0.001<0.001Tumor size (cm)1.021.01-1.02<0.0011.02 1.01-1.02<0.001<0.001No. of lymph node examination0.970.95-0.98<0.0010.98 0.97-1.000.047 0.039Sex0.042 Male1 —1 — Female0.810.68-0.960.0140.820.68-0.980.031 Race 0.456 0.518no selected White1—1— Black0.900.62-1.310.5680.79 0.53-1.190.262 Other1.160.69-1.930.5830.920.54-1.570.754 Histology 0.003 0.319 no selected Small cell carcinoma, NOS1—1— Oat cell carcinoma0.900.55-1.470.6750.800.49-1.320.385 Small cell carcinoma, fusiform cell0.660.09-4.700.6780.890.12-6.420.905 Small cell carcinoma, intermediate cell1.100.45-2.650.8392.310.92-5.790.074 Combined small cell carcinoma0.960.77-1.210.7281.10 0.87-1.410.420 Surgery<0.001 0.005 selected Ablation1—1—reference Sub-lobectomy0.750.49-1.140.1771.33 0.85-2.090.207 0.199 Lobectomy0.410.27-0.63<0.0010.86 0.53-1.400.544 0.600 Pneumonectomy0.660.37-1.170.1541.090.58-2.040.797 0.581 Surgery, NOS1.240.69-2.210.4851.23 0.68-2.250.495 0.454Radiation No1——reference Yes0.960.81-1.150.6500.67 0.54-0.82<0.001<0.001Tumor extension<0.0010.102 no selected E11 —1 — E21.511.23-1.84<0.0011.20 0.97-1.480.099 E32.061.36-3.110.0011.58 1.01-2.480.045 E42.131.67-2.70<0.0011.290.96-1.730.094 Lymph node involvement <0.001<0.001 N01—1—reference N11.501.19-1.900.0012.00 1.55-2.59<0.001<0.001 N21.991.63-2.44<0.0011.951.53-2.47<0.001<0.001 N33.792.42-5.96<0.0011.86 1.13-3.050.015 0.005Site0.0100.823 no selected Main bronchus1 —1 — Upper lobe0.560.39-0.800.0020.99 0.65-1.520.968 Middle lobe0.610.38-0.970.0371.10 0.65-1.870.717 Lower lobe0.600.41-0.880.0101.03 0.66-1.600.903 Overlapping lesion0.600.26-1.350.2170.65 0.28-1.520.323 Lung, NOS1.060.59-1.900.8550.81 0.43-1.540.523 Grade 0.019 0.024 Well; Grade Ⅰ1—1—0.231 Moderate; Grade Ⅱ2.390.70-8.170.1630.26 0.08-0.830.023 referencePoor; Grade Ⅲ2.910.93-9.110.0670.520.31-0.860.012 0.050 Undifferentiated; anaplastic; Grade Ⅳ2.970.95-9.330.0620.90 0.72-1.130.351 0.052 Unknown3.711.18-11.590.0240.90 0.72-1.120.342 0.020Metastasis <0.001 <0.001 M01—1—reference M1a1.350.72-2.530.3520.870.45-1.670.669 0.554 M1b2.862.29-3.58<0.0012.061.57-2.70<0.001<0.001
AIC: Akaike information criterion.
2.3 主要研究对象的预后预测列线图
依照赤池信息准则(AIC),使用R软件的stepAIC程序包,以逐步选取法选取出共变量进行构建Cox比例风险模型。Nomogram 模型以前面构建的Cox 风险比例模型为基础,以图形样式展示个体3年和5年整体存活率,如图2所示。预测模型一致性指数为0.706,95%置信区间为0.681至0.731。
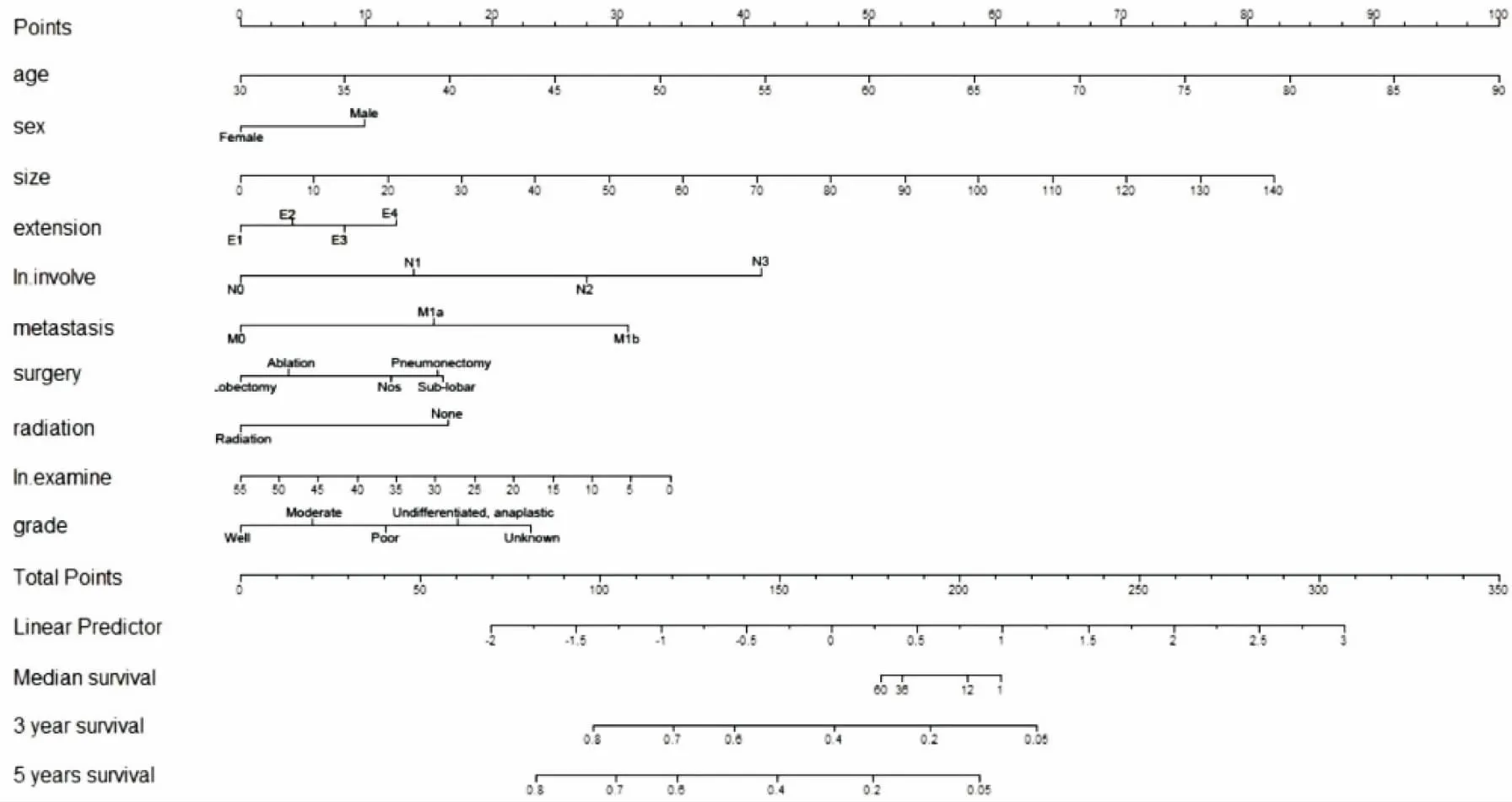
图2 小细胞肺癌手术患者生存预测列线图
Figure 2. Prediction of Overall Survival of Postoperative Small Cell Lung Cancer patients
2.4 基于不同分期系统构建小细胞肺癌手术患者的生存预测模型及比较
临床上普遍使用的小细胞肺癌分期系统分别是VALSG、IASLC和AJCC第7版TNM分期系统。基于以上的分期系统,同时加入患者的年龄、性别、手术方式、放射治疗情况、肿瘤分化和淋巴结清扫数目等协变量。例如AJCC的模型,我们在以上协变量基础上加入T分期、N分期和M分期作为模型的预测因子。而Nomogram模型,则选择肿瘤大小、肿瘤浸润程度、淋巴结转移情况和远端转移情况。同样VALSG模型和IASLC模型,则添加“局限期”或“广泛期”,代替肿瘤、淋巴结和远端转移的状况。
使用一致性指数(C-index)比较各种模型的预测准确性,Nomogram模型表现最佳,一致性指数为0.706,而AJCC模型、IASLC模型和VALSG模型的一致性指数分别为0.700,0.667和0.665。我们使用R语言中“rcorrp.cens”程序包比较各个模型的一致性指数差异是否有统计学意义。结果显示出Nomogram模型和AJCC模型较其余两个模型具有更好的分辨度,而且Nomogram模型是这四个模型中预测效能最佳的。另外,我们还用似然比(Likelihood Ratio)比较各个模型的优劣,同样Nomogram模型显示出最佳的预测效能(表3)。
表3 各Cox回归模型的一致性指数与相互比较
Table 3. C-indexes and Comparison of Cox Models

ModelC-indexSDSE95% CINomogram0.7060.0260.0130.681-0.731AJCC 7th0.7000.0250.0130.676-0.725IASLC0.6670.0260.0130.641-0.692VALSG0.6650.0260.0130.640-0.691Models(rcorrp.cens)Z value in Method1Z value in Method 2P value in method 1P value in method 2Model 1 vs Model 210.42710.174<0.001**<0.001**Model 1 vs Model 39.2814.199<0.001**<0.001**Model 1 vs Model 49.4904.395<0.001**<0.001**Model 2 vs Model 36.8218.294<0.001**<0.001**Model 2 vs Model 46.7538.263<0.001**<0.001**Model 3 vs Model 40.2931.121>0.05>0.05Models(Likelihood Ratio)Log-likeli-hood of first modelLog-likeli-hood of se-cond modelChi-squareP value Model 1 vs Model 2-3016.7-3030.728.03<0.001**Model 1 vs Model 3-3016.7-3067.9102.39<0.001**Model 1 vs Model 4-3016.7-3068.9104.25<0.001**Model 2 vs Model 3-3030.7-3067.974.36<0.001**Model 2 vs Model 4-3030.7-3068.976.49<0.001**Model 3 vs Model 4-3067.9-3068.92.13>0.05
AJCC: American Joint Committee on Cancer; IASLC: International Association for the study of Lung Cancer; VALSG: Veterans Administration Lung Study Group.
*Model 1, Nomogram model;Model 2,AJCC model;Model 3, IASLC model;Model 4, VALSG model
2.5 Nomogram模型的校正和验证
为了减少C-index 出现过度拟合(over-fitting)的现象,将对一致性指数进行校正。本研究采用Bootstrap的统计技术,由资料中病例进行重抽样(Resampling)用以估计统计量的分配。经过校正后,模型的C-index为0.71。校正后,模型仍能表现出不错的预测效能。另外一个评价Nomogram模型的方法是标准曲线(Calibration Cure)。标准曲线是比较Nomogram 预测结果与Kaplan-Meier法结果的一致性。如果两者比较的结果越接近,结果越一致,标准曲线越靠近对角线。本研究中绘出了SCLC手术患者3年和5年的标准曲线。如图3所示,标准曲线比较靠近对角线,预示着Nomogram模型预测结果与Kaplan-Meier法预测结果一致性高。
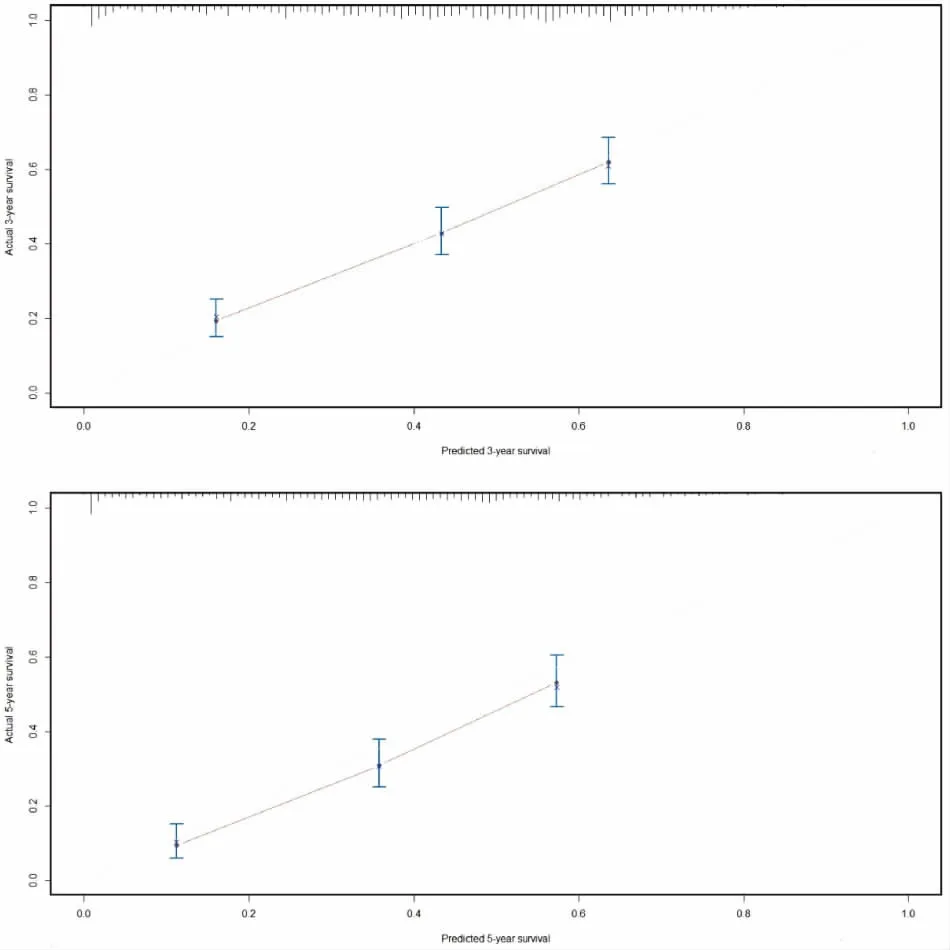
图3 预测模型标准曲线
Figure 3. The 3-Year and 5-Year Calibration Curves
3 讨 论
SCLC是肺癌中恶性程度最高的病理亚型,以放化疗治疗为主。最新研究结果都提示,针对小细胞肺癌患者,应该改变以往的治疗策略,并重视外科切除的治疗方式[13]。通过纤支镜或穿刺活检等方法,早期发现部分SCLC,对患者施以根治性手术。本研究基于SEER肿瘤临床数据库,这是一个覆盖了美国28%人口的大型临床数据库。通过对入选数据分析,手术治疗能很好地延长早期SCLC患者的生存时间。对于中晚期患者,慎重地选择手术治疗这一手段仍然有效。
1957年,美国退伍军人医院的肺研究组(Veterans Administration Lung Study Group, VALSG)订立了SCLC的分期标准。1992年,国际肺癌联盟(IASLC)的分期系统对边缘模糊的描述进行细化和修正。然而,无论是哪个版本的分期系统,都没有很好地阐明肿瘤本身、淋巴结转移和远传转移的作用。虽然美国肺癌联合委员会(AJCC)的TNM分期系统则对肿瘤、淋巴结转移和远端转移的信息考虑得更为详细,然而在侵犯性肿瘤中,肿瘤大小的重要性没有得到很好的验证。以往关于非小细胞肺癌的研究已经证实和报道肿瘤大小是一个至关重要的预后影响因素,但是肿瘤大小与SCLC的预后的研究则鲜有报道。VALSG分期和IASLC分期系统都考虑了肿瘤的部位和侵犯范围,但也没有利用到肿瘤大小这一重要的信息。恰恰相反,AJCC第7版分期系统对于早期的患者加入了肿瘤大小的信息,但是对于晚期患者,则轻视了肿瘤大小的重要性。
近年来,Nomogram模型已经广泛应用多种实体肿瘤的预后预测,因为模型包含了更多的预测因素,因此比传统的分期模型预测精度更高[14]。因此,针对手术治疗的SCLC人群,我们充分考虑了患者的肿瘤特点,并加入其它重要的临床特点构建了Nomogram生存预测模型。本研究中,我们将肿瘤大小进行单因素和多因素分析,都显示此变量为独立的预后预测因子。因此我们在构建Nomogram模型时将肿瘤大小以连续变量(既往以分类变量形式分析)的形式加入模型中。模型同时也纳入了淋巴结清扫的信息。淋巴结清扫指的是在患者接受手术根治性治疗时移除的淋巴结总数。进行单因素分析时,我们发现此因素与患者生存存在很强联系(HR=0.966,P<0.05),而且清扫淋巴结的个数越多,对患者的生存越有利。Liang等[15]发表一篇关于非小细胞肺癌的Nomogram生存预测模型,研究结果显示淋巴结清扫数量是一个重要的预测因子并被纳入模型中。该文章的结果同样进一步支持了我们的观点。用一致性指数大小比较各模型的效能,Nomogram优于AJCC模型(0.706vs0.700),IASLC模型优于VALSG模型(0.667vs0.665),各模型间一致性指数差异具有统计学意义。
由于本研究的Nomogram模型是基于SEER数据库构建,因此存在不可否认的缺陷。首先,虽然SEER数据库内收集了美国国内多个医学中心的患者临床数据,但是许多关键的临床信息,如患者的化疗方案,实验室检测数据都没有记录。这些临床信息很多被证实与SCLC患者的预后相关,如果能增加这些信息,势必可进一步提升模型的精确度;第二,Nomogram模型的验证使用了Bootstrap方法,这是内部验证的方法。如果有其他来源的数据对模型进行外部验证,能更好地证实模型的可信度;第三,SEER数据库主要收集的是西方人群的特点,对于模型的普适性还需要进一步验证。除此之外,患者如果拥有理想的身体条件往往倾向选择手术治疗,而身体条件差的患者可能会拒绝手术而选择放化疗。因此,在评估手术治疗是否能提升患者的总生存期存在偏倚。
总的来说,本研究表明了无论是早期还是晚期SCLC患者,手术治疗都能延长患者生存期。另外,我们综合了肿瘤大小、肿瘤侵犯范围等多个临床预测因子构建了SCLC手术患者的生存预测模型,模型的预测精度优于传统的分期系统。鉴于SEER数据库临床数据的不足,我们需采集中国患者的临床信息来验证模型的普适性,另外可增加患者的化疗方案、实验室检验数据乃至基因突变的信息,进一步探索预测可靠性更高的模型。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
