超声波辅助同步提取籼米和金针菇混溶蛋白的工艺优化及其营养特性
2019-07-26王灵玲施晓天杨文建胡秋辉
王灵玲,潘 鑫,方 勇*,施晓天,李 彭,马 宁,裴 斐,杨文建,胡秋辉
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏省粮油品质控制及深加工技术重点实验室,江苏 南京 210023)
籼米碎米和金针菇菌根是农产品加工过程中出现的原料副产物[1]。籼米蛋白具有低过敏性和高生物价的特点,是一种优质的植物蛋白,与动物蛋白相比,成本低,开发利用空间大,但因其赖氨酸缺乏,限制了以籼米蛋白为主的功能性产品的开发与利用[2]。赖氨酸能增强记忆,提高智力。金针菇是一种食用菌,其赖氨酸含量丰富,谷氨酸和天冬氨酸等呈味氨基酸含量高,有“益智菇”之称[3]。根据氨基酸互补原理,将籼米蛋白和金针菇蛋白进行复配是一种有效手段。但是2 种原料蛋白简单混合可能会导致组分分布不匀,营养不均的现象。
蛋白提取方法主要有物理法、化学法和酶法提取[4-5]。朱广成等[6]采用物理法提取金针菇蛋白,提取过程无污染,但得率低。王美玉等[7]采用碱法制备燕麦蛋白,提取率高。Shen Lianqing等[8]用酶法提取茶蛋白,虽然反应条件温和,但提取率较低。史瑞婕等[9]采用酶法和碱法结合法提取杏鲍菇蛋白,其提取率与纯度优于碱法提取。目前,关于蛋白质提取方法的研究热点主要是借助物理手段研究蛋白的提取工艺,Zhang Longtao等[10]采用超声辅助碱法提取大米蛋白,一定程度上提高了溶解性。Yang Xue等[11]用超声和酶法结合提取大米蛋白,提高了蛋白的提取率与纯度。但是同步提取2 种蛋白的方法鲜见报道。本研究旨在提供同步提取籼米碎米和金针菇菌根混溶蛋白的工艺条件,提高混溶蛋白均匀性,缩短提取时间,避免重复劳动,简化蛋白复配流程。用氨基酸分析仪测定游离氨基酸含量,根据世界卫生组织/联合国粮农组织(World Health Organization/Food and Agriculture Organization,WHO/FAO)提出的必需氨基酸参考模式,和氨基酸平衡原理对混溶蛋白进行营养特性分析,为其高附加值利用提供理论依据。
本研究采用超声波辅助同步提取籼米碎米和金针菇菌根混溶蛋白,通过单因素试验筛选影响提取率的因素水平,以提取率和纯度为综合考虑指标,设计正交试验优化工艺条件,利用氨基酸分析、色泽和体外消化等指标对比同步提取的蛋白与单独蛋白的产品外观和营养价值,以期获得营养价值全面的混溶蛋白产品。
1 材料与方法
1.1 材料与试剂
籼米碎米 南京远望富硒农产品有限责任公司;金针菇菌根 南京仙林农贸市场;胃蛋白酶、胰蛋白酶南京奥体福尼生物科技有限公司;氢氧化钠、盐酸、硫酸、硫酸铜、硼酸、硫酸钾(均为分析纯) 南京化学试剂有限公司;所有实验用水均为超纯水。
1.2 仪器与设备
L-8900型全自动氨基酸分析仪 日立高新技术公司;K-37自动凯氏定氮仪 瑞士步琦有限公司;PS-20超声波清洗机 宁波新芝生物科技股份有限公司;CM-5色差仪柯尼卡美能达有限公司;FD-STD冷冻干燥机 北京照生行仪器设备有限公司;FE28 pH计 梅特勒-托利多仪器(上海)有限公司;GL-21M高速冷冻离心机 上海市离心机械研究所有限公司;FW100高速万能粉碎机天津市泰斯特仪器有限公司;TE124S电子天平 赛多利斯科学仪器(北京)有限公司;JJ-2组织捣碎机 江苏省金坛市中大仪器厂。
1.3 方法
1.3.1 籼米蛋白和金针菇蛋白单独提取工艺
籼米蛋白提取参照万娟等[12]的方法,略作修改,取一定量籼米,磨粉(过80 目筛)与0.09 mol/L NaOH溶液按料液比1∶6(g/mL),置于-20 ℃冰箱4 h,常温融化,在25 ℃恒温水浴提取4 h,离心(8 000 r/min)取上清液,调节pH值至5.5,水洗数次,冻干成粉。
金针菇蛋白提取参考张乐[13]和朱广成等[6]的方法,略作修改。取一定量金针菇菌根,烘干磨粉(过80 目筛)与0.14 mol/L NaCl按料液比1∶15(g/mL)混合,置于-20 ℃冰箱4 h,常温融化,在30 ℃,120 W条件下超声20 min,离心(8 000 r/min)取上清液,调节pH值至4,水洗数次,冻干成粉。
1.3.2 混溶蛋白提取工艺流程
原料(籼米与金针菇菌根)→研磨过筛(80 目)→按比例备料→冻融(-20 ℃,4 h)→超声碱提(0.09 mol/L NaOH)→离心(8 000 r/min,20 min)→上清液调节pH值至5.5→离心(8 000 r/min,20 min),取沉淀→水洗数次→冷冻干燥。
1.3.3 同步提取混溶蛋白的单因素试验设计
以混溶蛋白的提取率为指标,分别对原料比,碱提料液比、超声时间、超声温度和超声功率5 个因素进行单因素试验。设定原料比为10∶1、9∶2、8∶3、7∶4、6∶5(g/g),碱提料液比为1∶5、1∶10、1∶15、1∶20、1∶25(g/mL),超声时间为10、15、20、25、30 min,超声温度为20、30、40、50、60 ℃,超声功率为200、300、400、500 W。
1.3.4 同步提取混溶蛋白工艺优化
根据单因素试验结果设计正交试验,以同步提取混溶蛋白的提取率与纯度为参考指标,设计L9(34)正交试验表,进行提取工艺参数的优化。
1.3.5 蛋白质含量测定
采用凯氏定氮法,参照GB 5009.5—2016《食品中氨基酸的测定》[14]方法进行测定。由公式(1)、(2)计算提取率与纯度:

式中:X为混溶蛋白的提取率/%;A为混溶蛋白的质量/g;B为籼米和金针菇菌根总质量/g;W为蛋白质的纯度/%;L为冻干粉混溶蛋白的质量/g;N为冻干粉的总质量/g。
1.3.6 蛋白质色差测定
参照Yu Zhilong等[15]方法,采用CM-5色差仪测量各蛋白样品的外观色泽,通过标准白板校准(L1*,99.54;a1*,-0.07;b1*,-0.29),将每个样品放在标准板上记录L*、a*、b*值。总色差是根据公式(3)计算:
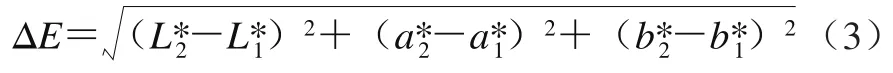
式中:L1*、a1*和b1*为从白板获得的颜色参数;L2*、a2*和b2*为从样品测量的颜色参数。
1.3.7 蛋白质体外消化率
采用胃蛋白酶-蛋白酶体外消化模型[16-17]。取一定质量的样品溶于0.1 mol/L HCl溶液中,于37 ℃水浴中预热5 min,酶与底物质量比1∶100加入胃蛋白酶,在37 ℃恒温振荡器上反应2 h,再用1 mol/L NaOH溶液调节pH 7.0终止消化反应。最后以酶与底物质量比为1∶250(g/g)加入胰蛋白酶,消化2 h后煮终止反应,取样分析。
体外消化率采用三氯乙酸氮溶指数法[18-19]测定和计算。取5 mL不同消化液于5 mL 10%三氯乙酸中,4 000 r/min离心20 min,沉淀用10%三氯乙酸洗涤2 次,离心得到三氯乙酸不溶组分。三氯乙酸不溶性氮含量采用凯氏定氮法测得(GB 5009.5—2016)。体外消化率按公式(4)计算:

式中:Y为体外消化率/%;Q为蛋白样品中三氯乙酸不溶性氮的质量/g;P为蛋白样品中消化后三氯乙酸不溶性氮的质量/g;M为蛋白样品的质量/g。
1.3.8 氨基酸组成测定及营养价值评价
1.3.8.1 氨基酸分析
参照Liu Ying等[20]的方法略作修改。称取0.200 0 g样品,用30 mL浓度为6 mol/L的HCl溶液于110 ℃水解样品24 h,滤纸过滤后用6 mol/L HCl溶液定容至50 mL,取3 mL旋蒸至干,加入30 mL浓度为0.02 mol/L HCl溶液,过0.22 μm滤膜进样瓶,采用氨基酸分析仪测定氨基酸含量。游离氨基酸含量按公式(5)计算:

式中:H为游离氨基酸含量/(mg/g);E为游离氨基酸物质的量/mol;F为该氨基酸的摩尔质量/(g/mol);G为稀释倍数;K为样品总质量/g。
1.3.8.2 蛋白质营养价值评价
根据氨基酸平衡理论[21],计算氨基酸比值、氨基酸比值系数和比值系数分,计算公式如下:

比值系数分=100-CV×10 (8)
式中:C为待评蛋白质某必需氨基酸含量/(mg/g);D为WHO/FAO模式中相应必需氨基酸含量/(mg/g);CV为氨基酸比值系数的变异系数。
1.4 数据处理
采用Origin 2018软件作图,采用JMP10(Student-t测验)分析软件进行差异显著性分析。
2 结果与分析
2.1 同步提取籼米和金针菇混溶蛋白单因素试验结果
2.1.1 原料比和料液比对混溶蛋白提取率的影响

图1 原料比(A)和料液比(B)对籼米和金针菇混溶蛋白提取率的影响Fig. 1 Effect of raw material ratio (A) and material to liquid ratio (B)on the extraction efficiency of protein
由图1A可知,籼米和金针菇混溶蛋白的提取率随着原料比的增大呈现先上升后降低的趋势。当原料比为8∶3(g/g)时,该混溶蛋白的提取率达到最大值47%。
由图1B可知,碱提料液比从1∶5(g/mL)增大至到1∶15(g/mL),相应的提取率从40%提高到68%。而当碱提料液比从1∶15(g/mL)升高到1∶25(g/mL),提取率先降低后趋于平缓。这可能因为随着碱提料液比变大,其溶剂体积增加,使溶剂与溶质接触更加充分,促进混溶蛋白部分溶解,当接触程度最大化后,再增加碱提料液比,对提取率便无显著影响[22]。
2.1.2 超声温度和超声时间对混溶蛋白提取率的影响
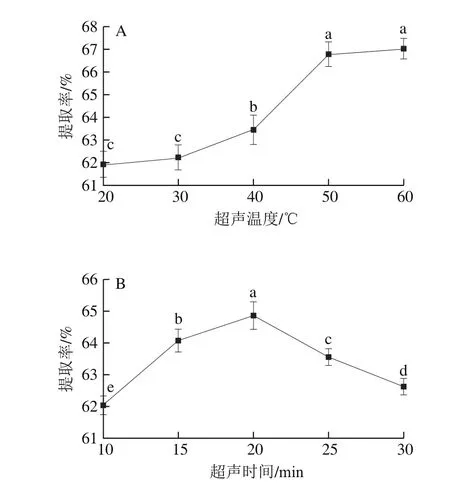
图2 超声温度(A)和超声时间(B)对籼米和金针菇混溶蛋白提取率的影响Fig. 2 Effect of ultrasonication time (A) and temperature (B) on the extraction efficiency of protein
如图2A所示,超声温度从20 ℃升高至60 ℃,籼米碎米和金针菇菌根混溶蛋白提取率增大。这是因为随着温度的不断上升,水分子热运动加剧,两者接触概率提高,蛋白溶解度增大。此外,温度的上升也会使蛋白质分子空间得以拉伸,促进可溶性蛋白质和小分子氨基酸的形成[23]。但是,超声温度从50 ℃升高至60 ℃,虽然分子运动加快,但其提取率无显著变化,这可能是因为较高温引起蛋白质的变性或者固化的作用[24]。
如图2B所示,当超声时间从10 min增加至20 min,混溶蛋白提取率增大。这可能是因为伴随超声时间的延长,蛋白质一些亲水基团充分暴露,与水分子反应,增加蛋白提取率[25-26]。超声时间从20 min到30 min提取率下降,可能是因为已经从原料中溶解出来的少许蛋白质与淀粉重新进行缔合[26]。
2.1.3 超声功率对混溶蛋白提取率的影响

图3 超声功率对籼米和金针菇混溶蛋白提取率的影响Fig. 3 Effect of ultrasonic power on the extraction efficiency of protein
由图3可知,籼米和金针菇混溶蛋白提取率随超声功率的提高而不断提高。这是因为随着超声功率的不断提高,空化作用增强,释放出更多的蛋白,使混溶蛋白的提取率增加[27]。超声功率升高为500 W时,混溶蛋白提取率高达69%。最终确定籼米和金针菇混溶蛋白提取的最佳提取功率为500 W。
2.2 同步提取混溶蛋白工艺的正交试验优化
在单因素试验基础上,设计L9(34)正交试验,并以混溶蛋白提取率和纯度作为综合评价指标,筛选出同步提取的最佳工艺参数,试验设计及结果见表1。
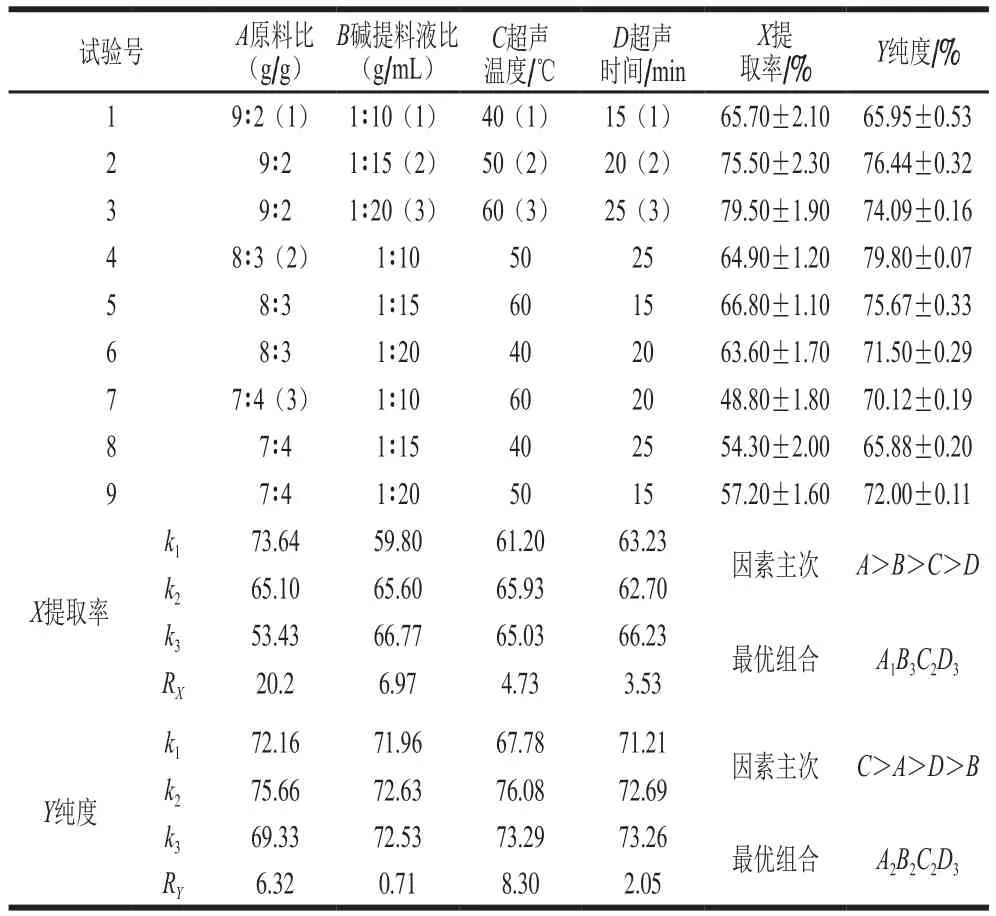
表1 同步提取籼米及金针菇混溶蛋白正交试验设计及结果Table 1 Orthogonal array design with experimental results
提取率的高低体现了同步提取籼米碎米和金针菇菌根蛋白的可能性大小,纯度的高低表明了同步提取混溶蛋白的市场应用前景的大小,两者综合考虑分析,以提取率为主要考虑指标,蛋白质纯度为次要指标筛选最佳工艺参数。由表1可知,原料比对提取率和纯度都有较大影响,超声时间对提取率和纯度影响较小。当原料比为9∶2(g/g)和8∶3(g/g)时,提取率与纯度高,但原料比对提取率是第1影响因素,对纯度是第2影响因素,因此选择A1。当碱提料液比为1∶15(g/mL)和1∶20(g/mL)时,提取率与纯度都较高,但料液比对于纯度是最次要因素,即料液比对提取率影响大,而对纯度影响小,因此选择B3。超声温度为50 ℃时,提取率与纯度都高,因此选择C2。超声时间为25 min,提取率与纯度都高,因此选择D3。综上,优化正交试验结果,得出最佳工艺参数条件(A1B3C2D3):原料比9∶2(g/g)、料液比1∶20(g/mL)、超声温度50 ℃、超声时间25 min。经验证实验,籼米和金针菇混溶蛋白的提取率为(69.30±1.30)%,纯度为(80.07±0.63)%,即同步提取籼米和金针菇混溶蛋白的工艺条件是可行的。
2.3 籼米和金针菇混溶蛋白的营养特性评价
2.3.1 籼米和金针菇混溶蛋白的游离氨基酸含量
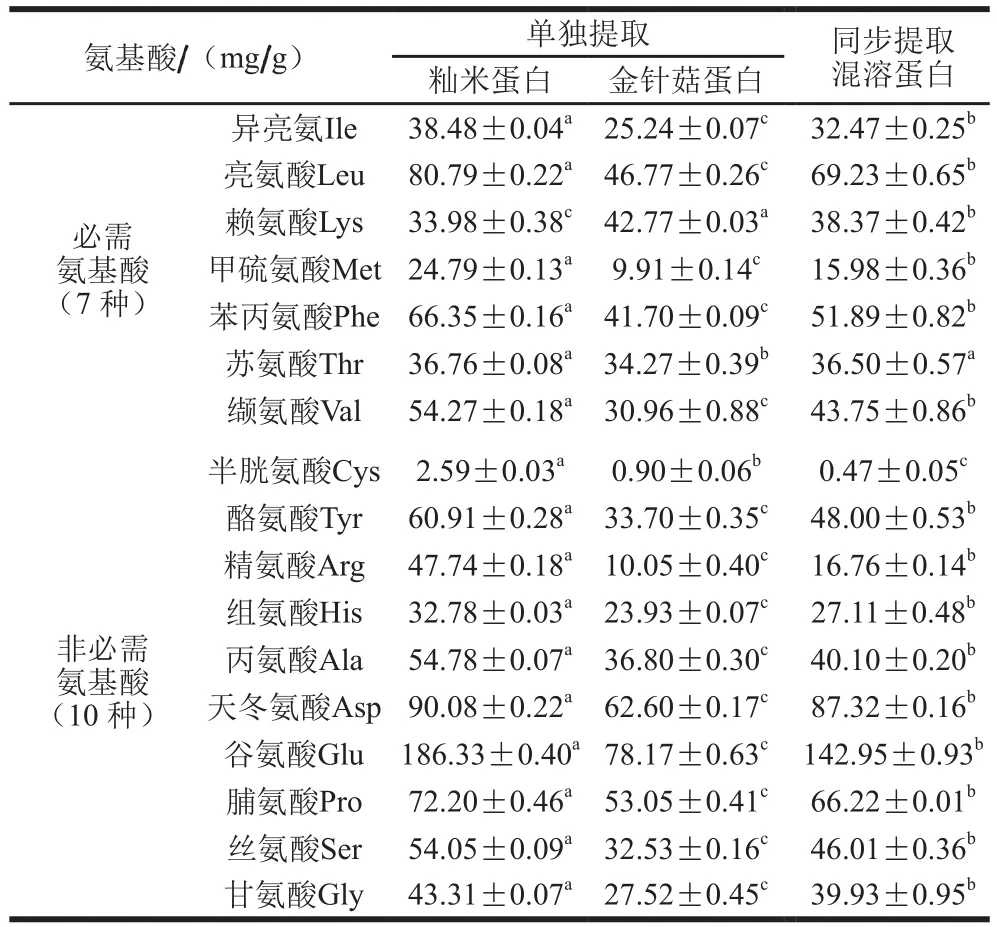
表2 同步提取蛋白与单独提取混溶蛋白游离氨基酸含量比较Table 2 Comparison of free amino acid contents in separately and simultaneously extracted proteins
由表2可知,籼米蛋白必需氨基酸含量丰富,但是其赖氨酸含量较低(考虑了甲硫氨酸和半胱氨酸的转化作用),这与杨倩等[28]研究结果相似。而金针菇蛋白中赖氨基酸含量丰富,同步提取后,混溶蛋白的赖氨酸含量提高。不仅如此,亮氨酸、苯丙氨酸等其他16 种氨基酸也进行了不同程度的互补,使籼米和金针菇混溶蛋白的氨基酸含量更加均衡,进一步强化了混溶蛋白的营养价值。超声辅助同步提取的混溶蛋白的半胱氨酸并没有得到互补,这可能与甲硫氨酸循环有关。甲硫氨酸在与三磷酸腺苷作用下为活性物质提供甲基,生成的S腺苷甲硫氨酸在甲基转移酶作用下,形成S腺苷同型半胱氨酸,脱去腺苷,生成同型半胱氨酸,进一步通过酶的催化作用,重新生成甲硫氨酸[29]。
2.3.2 籼米和金针菇混溶蛋白的营养价值评分
本实验采用氨基酸比值系数法评价各蛋白的营养价值。如果食物蛋白质氨基酸组成含量比例与参考模式一致,则各种氨基酸的氨基酸比值系数应等于1,氨基酸比值系数值最小的为第1限制氨基酸。由表3可知,籼米蛋白第1限制氨基酸是赖氨酸,经同步提取的混溶蛋白的第1限制氨基酸为含硫氨酸(甲硫氨酸+半胱氨酸)。如果蛋白中氨基酸组成含量比例与参考模式中接近,则其氨基酸比值系数值应接近1,SRC接近100[21]。籼米蛋白比值系数分为63.20,而籼米和金针菇混溶蛋白比值系数分为79.70,其比值系数分提高,更易被人体吸收,进一步证明了同步提取籼米与金针菇混溶蛋白这种方法能显著提高其营养价值。
2.3.3 籼米和金针菇混溶蛋白产品的色泽外观与体外消化率
如表4所示,L*值大,样品偏白,a*值小,说明偏绿,b*值大,表示偏红。同步提取的混溶蛋白的总色差ΔE为(50.31±0.48),与单独提取的2 种原料蛋白有显著差异,这是因为同步提取后不同颜色的两种原料蛋白融合,这也进一步说明了同步提取的可行性。混溶蛋白的体外消化率为(89.40±0.90)%,高于脱酰胺处理的大米蛋白[30],这可能是因为超声辅助提取改变了混溶蛋白的结构,提高了溶解度[31]。混溶蛋白的消化率与金针菇蛋白无显著差异,但却低于籼米蛋白,这可能是因为金针菇中多糖和酚类物质的存在使混溶蛋白杂质含量增大,影响了混溶蛋白的体外消化率[32-33],但其具体作用机理尚不清楚。这些问题是下一步研究需要明确的。
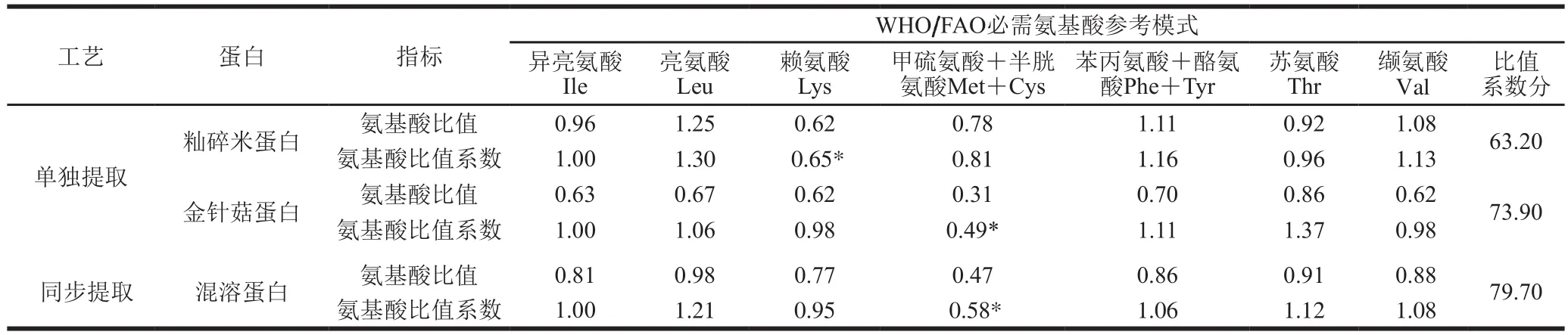
表3 同步提取籼米和金针菇混溶蛋白与单独提取蛋白营养价值对比Table 3 Comparison of nutritional values of mixed and separate proteins

表4 同步提取籼米和金针菇混溶蛋白与单独提取蛋白色泽外观和体外消化率Table 4 Comparison of color and in vitro digestibility of mixed and separate proteins
3 结 论
超声辅助同步提取籼米和金针菇菌根混溶蛋白的最优工艺条件为原料比9∶2(g/g)、超声温度50 ℃、料液比1∶20(g/mL)、超声时间25 min、超声提取功率500 W,测得提取率为(69.30±1.30)%,纯度(80.07±0.63)%,氨基酸比值系数分为79.70,色差值为50.31±0.48,体外消化率为(89.40±0.90)%,得到的产品营养价值高。因此,超声辅助同步提取是一种可以改善籼米蛋白和金针菇蛋白营养组成的有效技术手段,比单独提取两种蛋白再将其进行复配的工艺简单、能耗低,获得的混溶蛋白营养价值较全面。
