高通量抗生素残留初筛试剂盒的研制及应用
2019-07-26高晓月李贺楠郭文萍陈淑敏李莹莹
范 维,高晓月,李贺楠,郭文萍,陈淑敏,孙 勇,李莹莹*
(中国肉类食品综合研究中心,北京食品科学研究院,北京 100068)
抗生素作为一种杀菌或抑菌药物,在养殖、临床、农业等方面得到广泛应用,但滥用会导致其残留于动物体内,通过食物链进入人体,影响人类疾病治疗与康复,甚至引起严重的食品安全和出口贸易问题[1-4]。当前,我国畜禽养殖业主要使用的抗生素包括四环素类、氨基糖苷类、β-内酰胺类及大环内酯类等[5-6],为了增强抗生素疗效,缩短疗程,减少细菌耐药性,现经常把不同类抗生素进行配伍使用,这无形中加大了抗生素残留检测难度,预示着高通量的检测方法将成为未来检测发展趋势。目前,抗生素残留检测方法主要有色谱法[7-8]、微生物法[9]和免疫分析法[10]等,其中色谱法较为常用,可以进行定性定量检测,结果灵敏准确,但设备投入大,不同类别抗生素前处理和检测条件不同,很难做到联合检测[11-12];免疫分析法虽灵敏度高,但是检测成本昂贵,只能检测单一类抗生素[13],不易于高通量;相较于前两种方法,微生物法是抗生素残留检测最早采用的方法,其成本低廉、操作简单、具有广谱性,可作为一种高通量抗生素初筛方法在中小型食品企业得到普及。
目前已有的微生物法多用于牛奶中抗生素残留检测,在禽畜肉中应用较少,这主要是由于禽畜肉基质较为复杂,抗生素提取存在难度[14]。而对于微生物显色法试剂盒的开发,由于微生物本身活性受外界因素影响较大,且这种活性需要活化传代维持,因此如何能在保障其活性的前提下,将其进行保存和运输,并且不影响显色反应,是目前制约其研制的技术难点。本实验结合前期的研究成果[15],在确定了适用于禽畜肉中抗生素提取方法以及检测液配方的基础上,进一步克服了因菌种活化传代耗时较长及液体菌种无法运输等问题,开发出一种可检测动物源性食品中抗生素残留的高通量微生物显色初筛试剂盒,并对试剂盒的各方面性能加以验证。
1 材料与方法
1.1 材料与试剂
1.1.1 样品与菌种
禽畜肉购自超市或农贸批发市场。嗜热脂肪芽孢杆菌(Bacillus sterothermophilus CICC 10392) 食品安全菌种保藏中心。
1.1.2 试剂
β-内酰胺类:阿莫西林、氨苄西林、青霉素G、青霉素V、氯唑西林、乙氧萘青霉素、双氯青霉素、水合氨苄青霉素;四环素类:四环素、土霉素、金霉素、强力霉素;氨基糖苷类:庆大霉素、链霉素、新霉素、安普霉素、丁胺卡那霉素;大环内酯类:红霉素、罗红霉素、泰乐霉素标准品 德国Dr. Ehrenstorfer公司;营养琼脂(NA)培养基、脑心浸液肉汤(BHI)培养基、溴钾酚紫葡萄糖蛋白胨培养基、蛋白胨、牛肉浸膏、葡萄糖、溴甲酚紫 北京陆桥技术有限责任公司;海藻酸钠、明胶、卡拉胶、聚乙烯醇、二醋酸纤维素、硼酸、氯化钙、磷酸氢二钠均为分析纯。
抗生素标准储备液:将氨基糖苷类和β-内酰胺类各抗生素标准品分别用去离子水溶解并定容至100 μg/mL,-20 ℃避光可保存1 个月;将大环内酯类和四环素类各抗生素标品分别用甲醇溶解并定容至100 μg/mL,-18 ℃避光可保存12 个月以上。
检测液:蛋白胨10.0 g、牛肉浸膏3.0 g、葡萄糖10.0 g、NaCl 5.0 g、溴甲酚紫指示剂0.04 g、蒸馏水定容至1 000 mL,pH值调至7.0,121 ℃高压灭菌10 min[15]。
1.2 仪器与设备
FC酶标仪 芬兰雷勃仪器有限公司;DHP-9272恒温培养箱 上海一恒科学仪器有限公司;UltiMate3000-TSQ QUANTUM ULTRA液相色谱-质谱联用仪(配有电喷雾离子源) 美国Thermo公司;1200-6410液相色谱-质谱联用仪(配有电喷雾离子源)、1260高效液相色谱(配有可变波长紫外检测器) 美国安捷伦公司;TD4离心机 鑫港仪器有限公司;PHS-3C pH计 上海雷磁仪器有限公司。
1.3 方法
1.3.1 菌悬液制备
在无菌状态下,从NA培养基上挑取已活化好的株菌,接入BHI培养基中,充分振荡,以3 000 r/min离心5 min,弃去上清液,向离心管中重新加入BHI培养基,如此反复离心洗涤3 次后,用BHI培养基充分溶解沉淀,根据波长为600 nm处的吸光度,制备一定浓度的菌悬液。
1.3.2 菌种微胶囊包埋方法确定
1.3.2.1 菌种包埋方法选择
分别采用海藻酸钠法[16]、明胶法[16]、卡拉胶法[16]、二醋酸纤维素法[17]及聚乙烯醇法[17]对一定浓度的指示菌进行包埋,通过对包埋小球进行包埋操作难易程度分析、机械强度及菌种成活率测试,选取适合微生物显色法的包埋方法。
1.3.2.2 菌种包埋条件优化
配制10 mL溴钾酚紫葡萄糖蛋白胨培养基,向其中加入一定量的聚乙烯醇,使其质量浓度分别为0.08、0.1、1.2 g/mL搅拌混匀,于121 ℃灭菌10 min。待冷却至40 ℃后,向上述溶液中分别加入10 mL初始吸光度(A600nm)为0.5、0.8、1.0、1.2的指示菌悬液,混合均匀,用6号针头缓慢滴入pH值分别为5.2、6.0、6.8、7.5的硼酸-磷酸盐溶液中,于4 ℃静置1 h,抽滤出包埋颗粒,用生理盐水洗净,密封4 ℃保存、备用。通过对包埋小球进行机械强度、菌种成活率、抗生素敏感性及反应时间测试,确定最佳包埋条件。
1.3.2.3 机械强度测试
两块载玻片之间放置粒径相近的包埋小球,在上面的载玻片上加100 g砝码,观察小球外形有无变化,用裂痕和压碎程度表征小球的机械强度。
1.3.2.4 菌种成活率测试
将4 ℃保存1 周的包埋菌株放到150 μL检测液中,每菌株设置25 个平行,于62 ℃恒温培养,4 h内使检测液变黄的即为成活,对比观察不同包埋条件菌种的成活情况,计算成活率。
1.3.2.5 抗生素敏感性实验
向96 微孔板中依次分别加入150 μL检测液,50 μL菌悬液(或一颗包埋菌株颗粒)和100 μL 0.1 μg/mL的抗生素标准溶液,于62 ℃培养,观察检测液变色情况及反应时间。
1.3.3 样品前处理
1.3.3.1 具体操作[15]
称取均质好的10 g肌肉(瘦肉)样品置于50 mL离心管中,加入10 mL pH 7.4的磷酸钠缓冲溶液,旋涡1 min,密封置100 ℃沸水浴中加热5 min,10 000 r/min离心3 min,上清液即为样品提取液。
1.3.3.2 方法验证
以四环素为例,分别向猪、牛、羊、鸡、鸭的肌肉(瘦肉)样品中注射不同浓度的四环素标准溶液,每组进行3 个平行,按1.3.3.1节的操作进行样品前处理,之后将样品提取液进行色谱测定,确定该前处理方法的提取效率,并将各样品提取液进行微生物显色法验证,确定检测效果。
1.3.4 试剂盒操作及结果判定
根据样品数量取出已固定有指示菌包埋颗粒的微孔,依次向每孔中加入检测液150 μL,阳性对照、阴性对照、空白对照及样品提取液各200 μL,对照组和样品组各取3 个平行。于62 ℃恒温培养至阴性对照变成黄色,观察其他孔颜色变化。其中阳性对照为抗生素标准溶液;阴性对照为无抗生素残留的肌肉(瘦肉)提取液;空白对照为0.85%生理盐水。结果判定:样品孔检测液呈黄色为阴性(-),紫色为阳性(+)。
1.3.5 试剂盒检出限确定
1.3.5.1 单标抗生素检出限
用去离子水将20 种抗生素标准储备液进行梯度稀释,用试剂盒进行检测,确定各单标抗生素的检出限。
1.3.5.2 配伍抗生素检出限
对常配伍使用的四环素类和氨基糖苷类抗生素、β-内酰胺类和氨基糖苷类抗生素进行混合,配伍方案及系列梯度中各抗生素终质量浓度见表1。用试剂盒对混合抗生素梯度进行检测,确定混合抗生素的检出限。
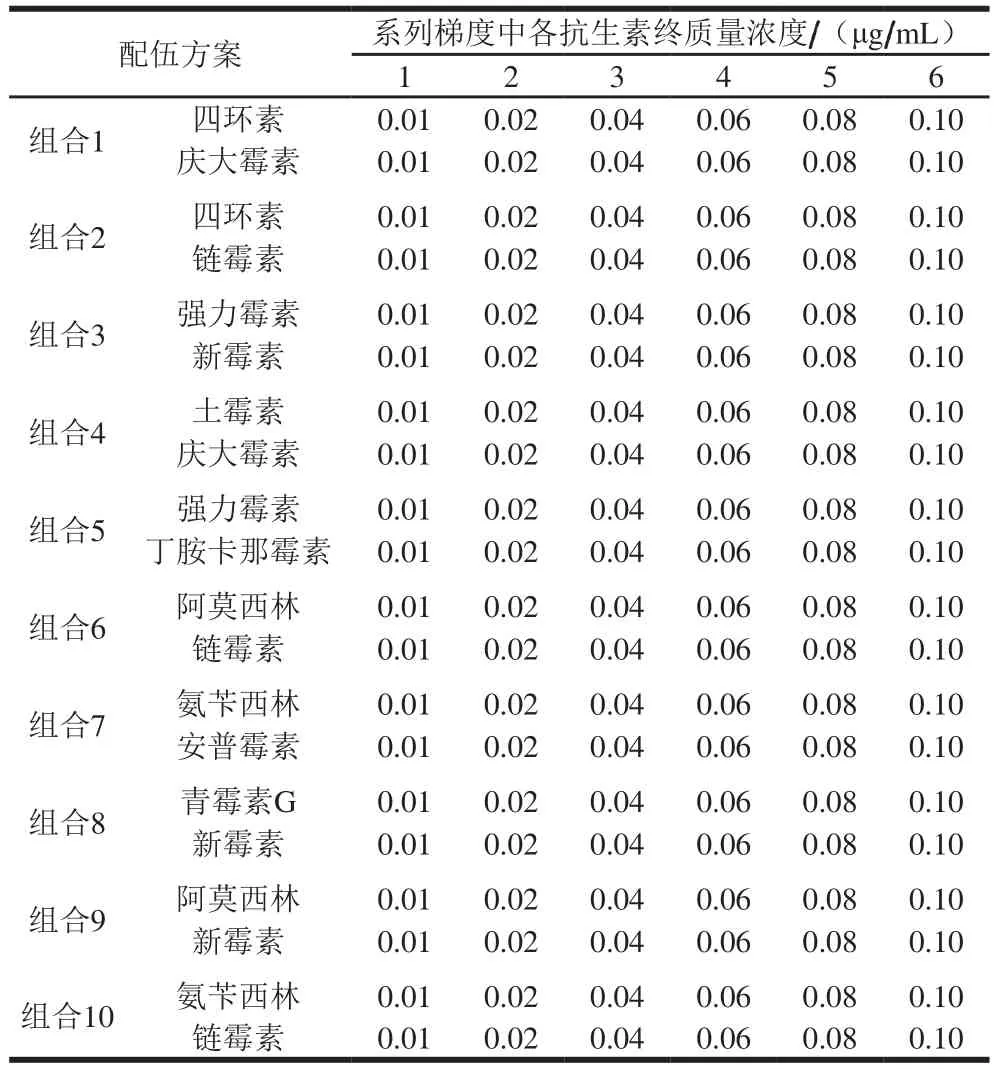
表1 抗生素配伍方案及系列梯度Table 1 Antibiotic combinations with concentration gradients
1.3.6 试剂盒稳定性
试剂盒密封好后于4 ℃保存1、3、5、10、15、18、20 d,用单标抗生素稀释梯度进行检出限和反应时间验证,确定试剂盒最佳使用期限。
1.3.7 试剂盒的评价
从不同市场分别购进猪肉20 份、牛肉15 份、羊肉15 份、鸡肉10 份、鸭肉10 份,共计70 份,分别用序号1~70标识,为保证有一定的阳性检出率,对一部分购买样品进行人工添加。
用本实验研制的试剂盒对样品进行检测,之后用色谱法进行验证。大环内酯类:参照SN/T 1777.2—2007《动物源性食品中大环内酯类抗生素残留测定方法》[18]进行检测;四环素类和氨基糖苷类:分别参照GB/T 21317—2007《动物源性食品中四环素类兽药残留量检测方法》[19]和GB/T 21323—2007《动物组织中氨基糖苷类药物残留量的测定》[20]方法进行检测;β-内酰胺类:参照SN/T 2050—2008《进出口动物源食品中14 种β-内酰胺类抗生素残留量检测方法》[21]和GB 29682—2013《水产品中青霉素类药物多残留的测定》[22]方法进行测定。
2 结果与分析
2.1 菌株包埋方法的确定
从表2可知,虽然明胶和卡拉胶的菌株成活率较高,但两者机械强度较低,颗粒易破碎使得被包埋细胞泄出,并且明胶在切块时易黏连,不易操作,且通过后期显色实验发现,这两种载体存在显色不均的情况,因此这两种材料不适合作显色反应的载体。采用醋酸纤维素作包埋载体,虽然颗粒机械强度高,但成活率极低,其原因可能是醋酸纤维素中添加的丙酮对菌株细胞伤害较大[23],故也不适合作包埋载体。采用海藻酸钠作载体,成球容易,菌株成活率高,但通过后期进一步实验发现,海藻酸钠化学稳定性差,与肉提取液(磷酸盐缓冲液)混合极不稳定,易吸胀破裂,影响显色反应。因此,选择聚乙烯醇作为包埋载体,其菌株成活率达到80%,机械强度高,化学性质稳定,抗微生物分解性能强,且易操作[17]。

表2 不同包埋方法的难易程度及表观特征Table 2 Difficulty and apparent characteristics of different embedding methods
2.2 菌株包埋条件优化结果
对现有的聚乙烯醇-硼酸包埋法进行改进,改用硼酸-磷酸盐溶液作为交联剂,并对相关条件进行优化。从表3可知,当聚乙烯醇质量浓度为0.1 g/mL时,成球效果最佳。

表3 聚乙烯醇质量浓度对包埋效果的影响Table 3 Effect of polyvinyl alcohol concentration on embedding efficiency

表4 交联剂pH值对包埋及检测效果的影响Table 4 Effect of pH value of cross-linking agent on the efficiency of embedding and detection
交联剂pH值对包埋及检测效果影响情况见表4。将交联剂改为硼酸-磷酸盐是因为硼酸自身毒性以及提供的酸性环境会降低菌种活性,加入磷酸盐,一方面可以缩短在硼酸中的交联时间减少毒性,另一方面可以改善pH值,为菌种提供适宜生存条件,提高菌种存活率[24]。从表4可知,当pH值较低时,成球形状不规则,小球自身低pH值会使检测液中的指示剂变色,影响显色反应,且过酸会降低指示菌成活率;而当交联剂pH值较高时,小球加入到检测液后会升高其pH值,从而延长反应时间。因此,选择pH 6.0的硼酸-磷酸盐溶液作为交联剂。

表5 菌种初始A600 nm对检测效果的影响Table 5 Effect of initial bacterial suspension concentration on detection efficiency
从表5可知,当菌种初始A600nm为0.5时,抗生素对菌株的抑制效果较好,但由于菌株浓度较低,导致反应时间较长且存活率较低;当菌悬液初始吸光度较高时,抗生素对菌的抑制效果不明显,反应终点时检测液变为黄色,达不到检测目的。因此,选择初始A600nm为0.8的指示菌进行包埋。
2.3 样品提取效果验证
从表6可知,该提取方法对不同肌肉(瘦肉)样品中抗生素残留提取率为79.8%~88.1%,相对标准偏差为3.5%~5.2%。进一步对各提取液的检测效果进行验证发现,经加热沉淀蛋白后,鸭、鸡、猪肉样品的提取液呈现无色,离心后较为澄清,而牛、羊肉样品的上清液呈微红色,但只要其中抗生素残留超过微生物法检出限,不会对检测结果造成影响。

表6 不同样品提取效率及显色效果Table 6 Efficiency of extraction and color development of different samples
2.4 试剂盒检出限测定结果
按1.3.5节方法进行检测,检出限效果见图1,以颜色未发生变化的标准液质量浓度为该抗生素的最小检测质量浓度。

图1 检出限效果图Fig. 1 No color change occurred at the detection limit

表7 单标抗生素检出限量Table 7 Detection limits for single antibiotics
从表7可知,本试剂盒各类抗生素的检出限均小于我国农业部规定的动物性食品中兽药最高残留限量[25],其中对β-内酰胺类和四环素类抗生素较为敏感,检出限分别为20~40、40~60 μg/kg,这与谢莉等[26]研究的用嗜热脂肪芽孢杆菌检测牛奶中抗生素残留结果相似。相较于色谱法,该试剂盒检出限更接近最大残留限量,因此本试剂盒初筛呈阳性的样品更有可能是不合格样品,之后将这些阳性样品用色谱法进行复测,可以节约时间和成本。并且有时企业并不需要太精准的数值,只需检测购入的原料肉中抗生素残留是否合格,对灵敏度无过高要求,以免成本提高造成浪费。

表8 配伍抗生素检出限Table 8 Detection limits for antibiotic combinations
从表8可知,该试剂盒对常配伍使用的抗生素也能进行检测,且检出限均较单标低,说明四环素类和氨基糖苷类抗生素、β-内酰胺类和氨基糖苷类抗生素联合使用对指示菌抑制效果增强,具有协同作用,这与李娟[27]对氨基糖苷类抗生素配伍禁忌研究结果一致。
2.5 试剂盒稳定性测定结果
将试剂盒于4 ℃保存,每间隔一定时间用庆大霉素、四环素进行反应时间和检出限验证,结果见表9。随着保存时间延长,反应时间和检出限均受到影响,这是由于菌体自身处于一个衰减的过程,随保存时间延长菌体数量和活性都会随之降低造成的,而15 d内试剂盒的反应时间和检出限均可保持稳定状态,因此,该试剂盒的最佳使用期限为15 d。
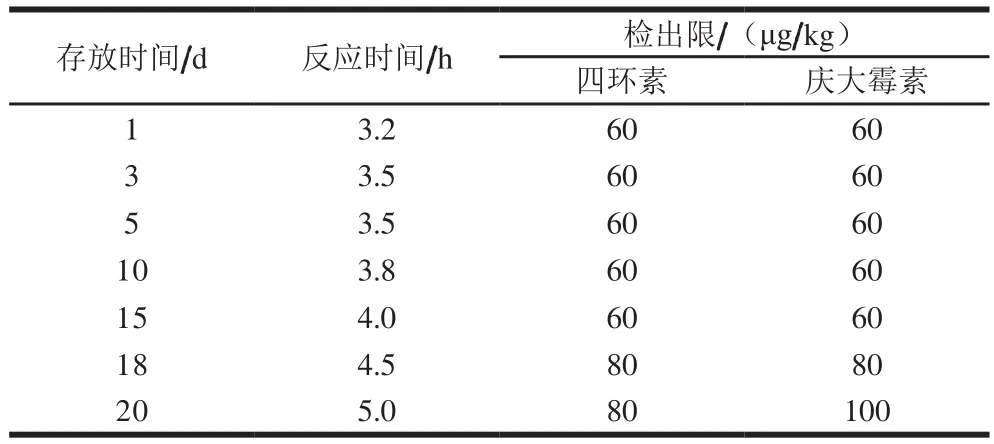
表9 试剂盒稳定性Table 9 Stability of the kit
2.6 试剂盒评价结果
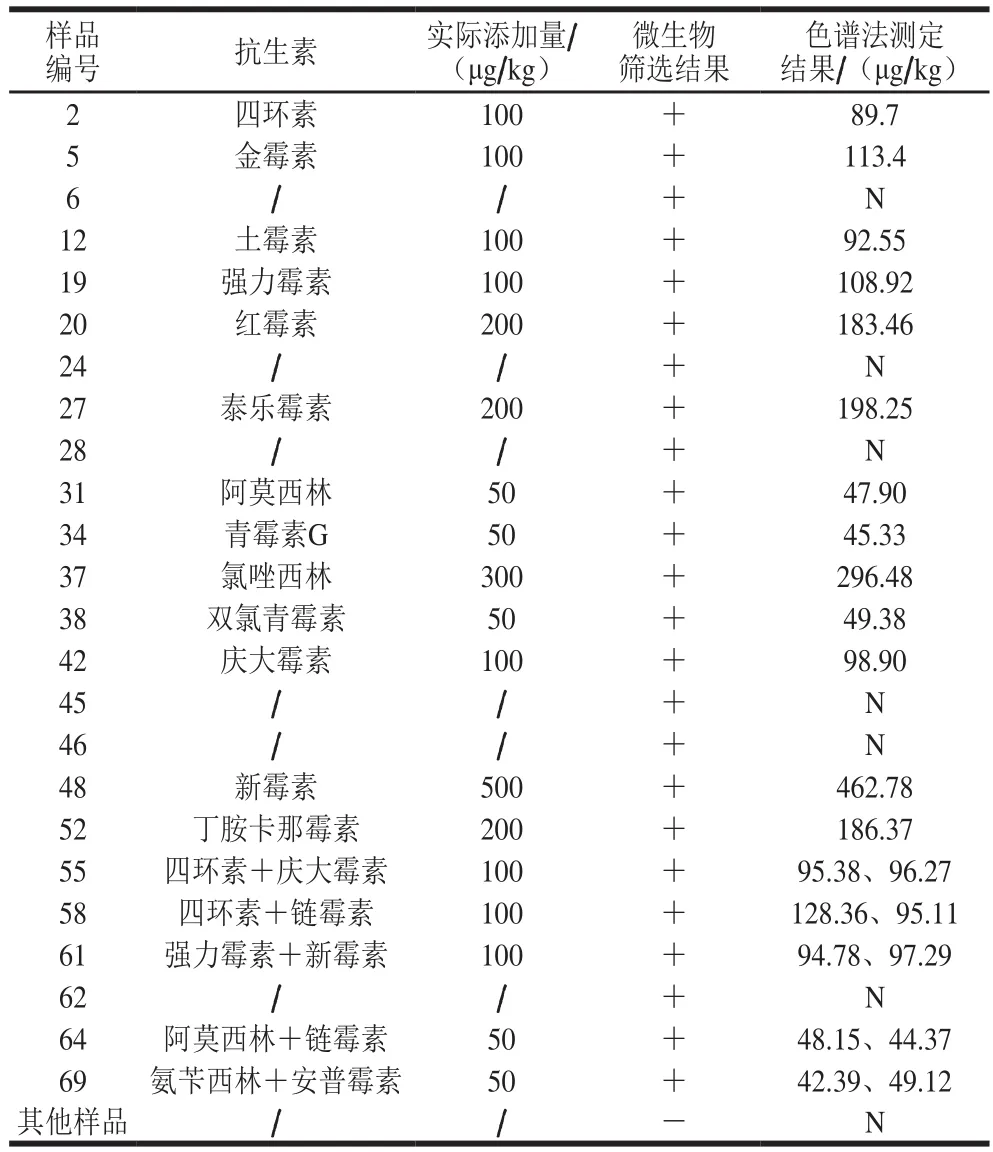
表10 微生物法与色谱法样品检测结果Table 10 Results obtained on samples using the kit and chromatography
将70 个样品进行试剂盒检验,之后用色谱法进行验证,结果见表10。试剂盒检测共有24 个样品呈阳性,经色谱法验证,其中18 个阳性样品含有以上添加的抗生素残留,其余6 个为假阳性样品,据研究[28-29]嗜热脂肪芽孢杆菌除对抗生素敏感外,对磺胺类、糖肽类等药物也有较高的敏感性,因此6 个假阳性样品存在含有其他抗生素的可能。而试剂盒检测呈阴性的46 个样品,经色谱法验证,没有测出本实验规定的药物残留,说明该试剂盒结果可靠,虽存在一定的假阳性结果,但只要抗生素残留量超过其方法检出限,无假阴性结果存在。
3 结 论
本研究以样品中抗生素残留影响菌种生长产酸,从而使检测液中指示剂颜色发生变化为原理,选用具有广谱敏感性的嗜热脂肪芽孢杆菌作为指示菌,并将其微胶囊包埋固定于96 微孔板中,克服了因菌种活化传代耗时较长及液体菌种无法运输等问题,研制了检测动物源性食品中抗生素残留的高通量初筛试剂盒。为了提高试剂盒的灵敏度和稳定性,本实验分析对比不同包埋方法,并对菌种包埋浓度、包埋剂添加量及交联剂pH值进行了优化。该试剂盒对禽畜肉中常见的β-内酰氨类、四环素、氨基糖苷类、大环内酯类抗生素药物无论是单独使用还是配伍使用都具有较好的检测灵敏度,在15 d的保存期内,具有较好的检测稳定性。该试剂盒操作简便、快捷,包括前处理在内4~5 h即可完成检测,结果肉眼可辨别,无需借助大型仪器。采用可独立拆分的微孔板,可根据样品数随意调节,做到用同一前处理方法、同一检测体系对不同样品、不同抗生素的高通量检测。用色谱法对试剂盒筛检出的46 个阴性样品进行验证,均无抗生素药物残留,说明该试剂盒结果可靠,无假阴性存在。因此可以采用该试剂盒进行筛检,再以色谱法对呈阳性的样品进行复测,以便减少成本和提高效率,这将在食品企业及一般检测实验室具有良好的推广前景。
