荧光素酶生物发光报告体系的优化及在肝癌荷瘤裸鼠模型中的应用*
2019-07-26许坚吉刘晓霓陈德喜
王 爽,许坚吉,刘晓霓,陈德喜
作者单位:100069北京市 首都医科大学附属北京地坛医院检验科(王爽);首都医科大学附属北京佑安医院北京市肝病研究所(许坚吉,刘晓霓,陈德喜)
荧光素酶(luciferase)报告系统是生物发光最常见的系统之一,是luciferase以荧光素(luciferin)、三磷酸腺苷(ATP)和O2为底物,在Mg2+存在时发生酶促反应产生光子的过程,其公式如下:luciferase+ATP+luciferin+O2→AMP+PPi+Oxyluciferin+CO2+light。生物发光分子成像(bioluminescene molecular imaging,BLI)技术利用生物发光原理,能够重复性地实时监测实验动物肿瘤的生长情况。与荧光方法相比,BLI表现出很小的背景信号以及较高的信噪比,具有更高的敏感度及特异度[1-3]。将体外能稳定表达luciferase的细胞株植入动物体内,当采用腹腔或静脉注射等外源方法给予luciferin时,可在几分钟内产生发光现象,利用光学系统即可检测出光强度,能够间接地反映出细胞数量的变化以及细胞的定位情况。同时,luciferase的表达和生物发光系统本身不会对肿瘤生长产生影响[4]。BLI技术能够无创伤地直接快速测量各种模型动物肿瘤细胞的生长和转移,并可对治疗后肿瘤细胞的变化进行实时观测和评估[5-7]。本研究选择带有luciferase基因的肝癌HepG2细胞,摸索出适合细胞的体外最适底物浓度以及在此浓度下的最适ATP缓冲液浓度,并将此优化配比系统应用于荷瘤裸鼠进行验证实验,以提高这一报告系统在检测小动物体内肿瘤的灵敏度。
1 对象与方法
1.1 细胞、动物、仪器与试剂 带有luciferase报告基因的肝癌HepG2-Luc细胞来自军事医学科学院九所,培养条件为含10%FBS的DMEM培养基(含200 ng/ml嘌呤霉素),在5%CO2、37℃恒温细胞培养箱中培养;雄性Balb/C裸鼠,6周龄,体质量18~20 g,购自北京维通利华实验技术有限公司。多功能酶标仪(美国PerkinElmer),多模式活体成像系统In-vivo Fx Pro(美国柯达Carestream医疗集团);荧光素(D-luciferin)购自美国GOLDBIO公司;ATP-2Na干粉购自美国Amerasco公司;戊巴比妥钠为自德国进口分装;GlyGly和MgSO4购自国药集团化学试剂有限公司。
1.2 HepG2-Luc细胞luciferin最佳反应浓度的优化 培养HepG2-Luc细胞至对数生长期,胰酶消化并计数细胞,以每孔1×104个细胞铺于黑色平底96孔培养板内。将luciferin溶液1:2倍比稀释为12个浓度,使luciferin的使用浓度从20 mg/ml到0.01 mg/ml,每个浓度设定一个复孔。避光并于酶标仪内检测96孔板相应位置的发光每秒钟发光计数(CPS)。同时,使用活体成像仪在生物发光模式下拍摄。
1.3 ATP最佳反应浓度的优化 配置ATP缓冲反应液(50 mM GlyGly,30 mM MgSO4,pH 7.5),调整ATP溶液浓度为5 mM,取0.2 μm滤膜过滤除菌,现用现配。以每孔1×104个细胞铺于黑色平底96孔板内,使luciferin处于检测的最佳发光浓度条件下。将ATP浓度从200 μM,按照1:2倍比稀释至11个浓度,分别加至含有luciferin最佳浓度的各孔中,最后一孔不加ATP溶液,设为阴性对照,每个浓度设定一个复孔。避光并于酶标仪内检测各孔的CPS值,同时使用活体成像仪进行生物发光模式拍摄。
1.4 裸鼠肿瘤皮下注射 首先培养足够数量的HepG2-Luc细胞,胰酶消化后用PBS洗2遍。计数细胞并调整细胞数,重悬于冷的PBS缓冲液中。将细胞置于冰盒内并携带至动物房。随机选取体质量接近的两只裸鼠,用1 ml注射器吸取适量的细胞悬液,并注射于裸鼠的右侧腋下,右前肢腋下接种细胞数为2×105个,右后肢接种细胞数为2×106个,每个接种部位的注射量为100 μl。
1.5 活体成像仪检测 称量荷瘤裸鼠体质量,根据对应剂量向裸鼠腹腔内注射1%戊巴比妥钠麻醉动物。待无意识后,向两只裸鼠腹腔内注射由生理盐水配制的无菌luciferin溶液(15 mg/ml)200 μl。随机选取一只裸鼠作为实验鼠,腹腔内注射优化后的ATP缓冲溶液200 μl,同时向对照鼠注射200 μL无菌生理盐水,5 min后将动物摆放于观察盒内,在小动物活体成像仪上进行生物发光模式的观察和拍摄。依次拍摄生物发光模式图片和X光模式图片,保存并进行图片叠加。输出叠加的图片,获取生物发光图像的相关信息,对发光区域进行总发光强度(sum intensity)的分析。
2 结果
2.1 Luciferin最佳浓度的筛选情况 向各孔HepG2-Luc细胞(1×104)中加入不同浓度的luciferin溶液,在多功能酶标仪上进行发光模式检测。根据平均值,绘制各浓度下的发光强度曲线,结果可见随着底物浓度的增加,发光强度也在逐渐增强,最大发光强度和饱和luciferin水平处在1.25 mg/ml浓度时(图1A),浓度大于1.25 mg/ml时会出现发光强度下降趋势。活体成像仪的检测结果与酶标仪检测结果一致(图1B)。
2.2 ATP缓冲液最佳浓度的筛选情况 在各孔HepG2-Luc细胞(1×104)铺板后,将 luciferin反应浓度调整为1.25 mg/ml(即处于不限制水平),以此为条件检测最佳ATP缓冲液的使用浓度。ATP在0~200 μM范围内,在luciferin浓度一致的情况下,随着ATP缓冲液浓度的逐渐提高,发光强度是逐渐增高的,最高的发光强度是ATP在12.5 μM条件下(图 2A)。同时发现,过量的 ATP(>50 μM)会明显抑制发光强度,说明过量的ATP缓冲液会抑制荧光素酶体系反应,或是过量的ATP对细胞产生毒性作用,使发光水平急剧下降。活体成像仪的检测结果也与酶标仪检测结果是一致的(图2B)。
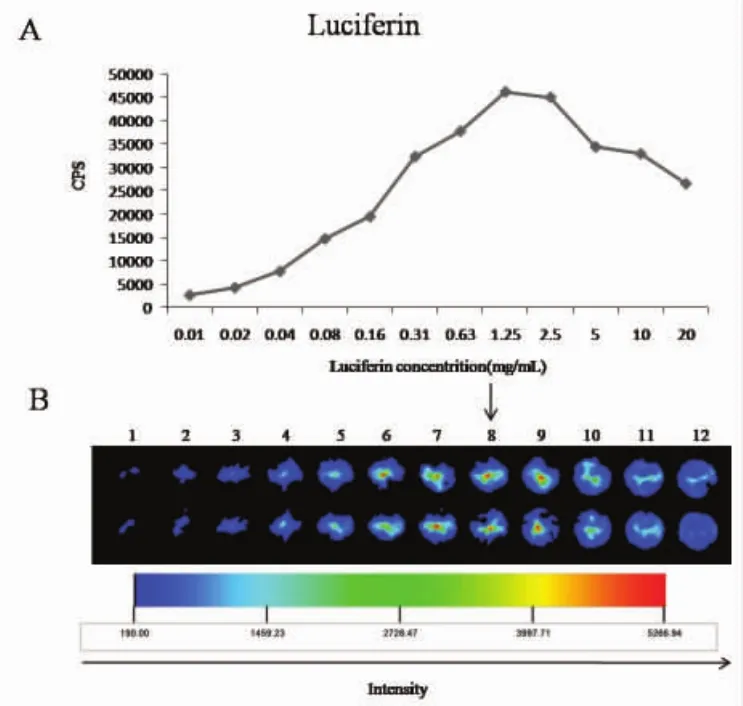
图1 Luciferin最佳浓度的筛选
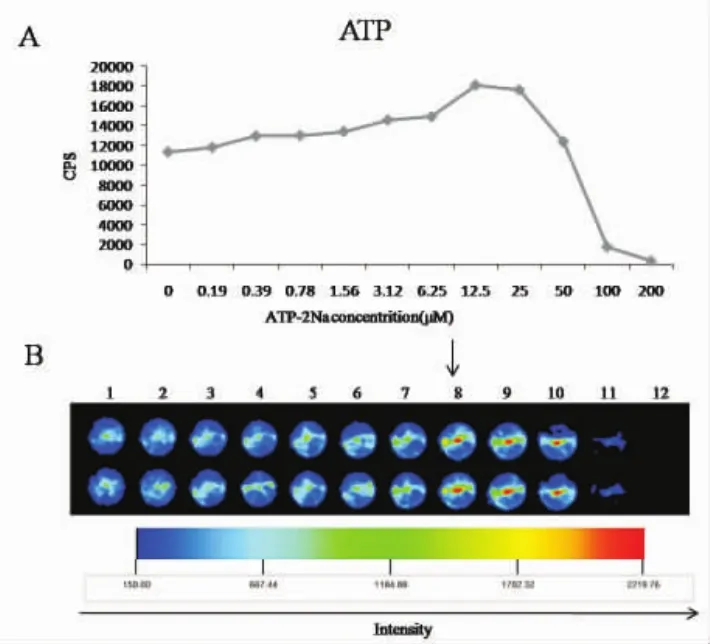
图2 ATP缓冲液最佳浓度的筛选
2.3 荧光素酶优化报告系统对裸鼠皮下接种肿瘤细胞活体成像灵敏度的影响 向裸鼠皮下接种肿瘤细胞后,再腹腔注射荧光素酶底物(浓度为15 mg/ml)200 μl。根据细胞实验的优化配比,计算出裸鼠注射的ATP缓冲液适宜浓度为150 μM,注射量为200 μl。随机选择一只裸鼠注射ATP缓冲反应液,10 min后开始行活体成像仪检测。从生物发光与X光模式叠加图像可见,裸鼠皮下接种的细胞在与底物反应后能够检测到发光信号,成像图显示两只裸鼠均能够直接检测到右后肢接种的肿瘤细胞的存在(图3A)。光强度分析数据显示,同时注射ATP溶液的裸鼠右后肢肿瘤细胞的发光强度值为1483024,相比对照鼠的发光强度484645,表现出明显增强(图3B)。另一方面,观察裸鼠右前肢接种2×105个肿瘤细胞的位置,在注射ATP缓冲反应溶液的实验鼠可以检测到弱信号的存在,而对照裸鼠则检测不到信号,说明外源给予150 μM的ATP缓冲液后能够明显提高裸鼠皮下接种肿瘤细胞的发光强度和检测灵敏度。
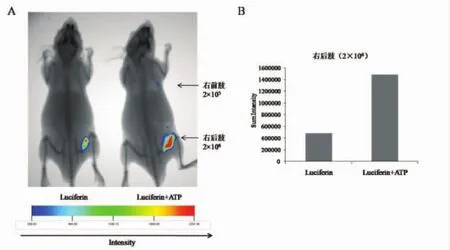
图3 荧光素酶优化报告系统对裸鼠皮下接种HepG2-Luc细胞活体成像的影响
2.4 荧光素酶优化报告系统对裸鼠皮下移植瘤生物发光成像的影响 取现有HepG2-Luc细胞皮下荷瘤裸鼠,进行荧光素优化报告系统的验证分析。由于荧光素酶报告系统的发光过程遵循一种闪光动力学[8],发光速度非常快,在注射荧光素后的不同时间检测到的发光强度会有差异,为了减少拍摄前后本身的信号差异,将其中一只荷瘤裸鼠作为对照鼠(未经条件优化),对实验裸鼠进行条件优化与否的处理,并同时与对照裸鼠一起进行生物发光模式拍摄。拍摄分2次进行。第1次,对照与实验荷瘤鼠均只注射 luciferin(15 mg/mL,200 μl),10 min 后进行拍摄(图4A)。随后给予实验荷瘤鼠优化条件—注射 ATP 缓冲反应液(150 μM,200 μl),10 min后与对照荷瘤鼠同时进行第2次拍摄。将实验鼠和对照鼠肿瘤部位的两次发光信号强度进行比较,观察到不经过优化的对照鼠第2次拍摄的发光强度比第1次略有下降,说明随着时间的延长,生物发光信号有衰减趋势;同时,观察实验鼠的发光强度,采用优化条件后,实验鼠肿瘤部位的发光强度要显著高于未优化时(图4B);将对照鼠作为参照,实验鼠与同时拍照的对照鼠进行信号强度前后比较发现,未优化时的实验鼠与对照鼠的信号强度比值为0.11,优化后的比值为0.67(图4C),说明采用荧光素优化报告系统能够显著提高荷瘤裸鼠的生物发光信号强度,同时能延长活体成像的发光时间,提高了成像检测的效率。
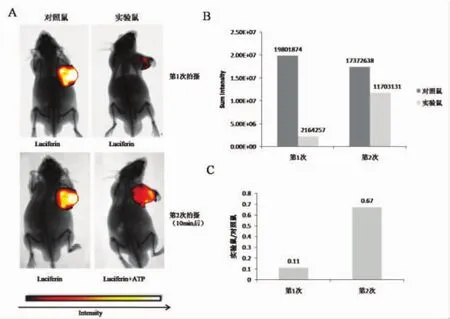
图4 荧光素酶优化报告系统对裸鼠皮下移植瘤生物发光成像的影响
3 讨论
早期肿瘤的检测对于肿瘤发生学研究和有效的肿瘤治疗是至关重要的。传统方法主要是通过机械或电子卡尺等物理测量来评估裸鼠接种人类肿瘤后的生长情况。然而,这种方法仅适用于在动物皮下生长的可扪及的肿瘤,而对于较深的肿瘤肿块或组织原位瘤,则不适合直接测量。经典的原位模型对于评价药物的功效是不切实际的,因为它们需要在每一时间点处死大量动物。同样,肿瘤转移的早期发现和肿瘤负荷的定量需要详尽的和冗长的组织学分析[1,5]。
有很多荧光素酶生物发光成像检测方面的优化方法[6-10],还有针对各种疾病模型的方法学研究改进[11-17]。我们在实际研究中发现,目前的活体成像检测过程是仅向目标动物体内注射底物溶液,依靠体内自身的ATP,即可产生生物发光现象,再对光信号通过仪器检测,但当荧光素酶标记细胞构建的不是很理想、荧光素酶的表达比较弱或需要深度探测时,其信号就比较弱。经过优化的荧光素报告系统可以放大检测信号,缩短前期弱信号的首次出现时间。我们采用内源性荧光素酶,分别筛选luciferin和ATP缓冲液的最佳浓度,建立了优化的luciferin和ATP缓冲液的最佳配比方法。实验发现,无论是在细胞水平还是动物在体内,加入适当配比的外源性ATP缓冲液能够显著增强生物发光现象,提高活细胞的检测灵敏度。
