LPS诱导的HepG2细胞NOTCH与LPS-TLR4-NF-κB炎症信号通路的“会话”研究*
2019-07-26王洪岩徐有青
张 莹,王洪岩,迟 程,徐有青
作者单位:100050北京市 首都医科大学附属北京天坛医院消化内科
在哺乳细胞,Notch信号通路有4种类型的跨膜受体,分别是 Notch1-4及其 5个配体,即Delta-like 1、3、4(Dll1、Dll3、Dll4),Jagged1(Jag1)和Jagged2(Jag2)[1-4]。在多种炎性疾病的发病过程中,都存在NOTCH信号通路被异常激活[5-7],但其在ALD的发病机制中的作用仍不清楚。本研究体外培养HepG2细胞,加入LPS模拟酒精刺激,检测HepG2细胞Notch信号通路和LPS-TLR4-NF-ΚB信号通路的“会话”表现,结果发现肝内Jag1-Notch1信号通路被LPS激活,LPS结合TLR4可以通过与Notch信号通路相互作用,增加了NF-ΚB及其炎症因子的表达。
1 材料与方法
1.1 主要材料、试剂与细胞 DMEM 高糖培养基、胎牛血清、青霉素和链霉素等细胞培养液均购自美国Gibico 公司;LPS、DAPT、聚偏氟乙烯(PVDF)膜、蛋白提取试剂等购自Sigma公司;BCA蛋白浓度测定检测试剂盒购自上海碧云天生物技术公司;Western blot超敏发光试剂盒购自美国Pierce公司;RNA提取试剂、逆转录试剂以及QPCR试剂均购自TAKARA公司;抗Notch跨膜受体NICD抗体、抗NF-KB和抗β-actin抗体均购自美国Cell Signaling公司;HepG2细胞株购自北京协和医学院基础学院细胞库。
1.2 细胞培养和刺激 取20~30代HepG2细胞,用含有10g/L非必需氨基酸、10g/L谷氨酰胺、1g/L丙酮酸钠的DMEM培养液,加入体积分数10%胎牛血清、青霉素-链霉素,置于37℃、5%CO2培养箱中常规培养,取对数生长期的细胞用于实验。加入LPS模拟酒精刺激,处理时间为48 h:①对照组(培养基);② LPS组(培养基+LPS 2 μg/ml)。DAPT处理HepG2细胞时,分成4组,处理时间为24 h:①对照组(培养基);② LPS组(培养基+LPS 2 μg/ml);③DAPT组(培养基+DAPT 10 nM);④DAPT+LPS组(培养基+LPS 2 μg/ml+DAPT 10 nM)。
1.3 HepG2细胞NOTCH受体和配体mRNA检测 采用实时荧光定量PCR法,将HepG2细胞分为两组,其中一组加入 LPS(2 μg/ml)模拟酒精刺激48 h,分别收集对照组和实验组细胞,采用TRIzol Reagent RNA提取试剂盒分别提取各细胞总RNA。经反转录后通过PCR方法分别检测NOTCH不同的受体和配体在刺激前后mRNA水平的变化。设计Notch 1、Notch 2、Notch 3、Notch 4,Jag 1、Jag 2,Dll 1、Dll 3和Dll 4引物和内参引物(表1)。首先检验各组有无特异性扩增产物,然后在实时荧光定量PCR仪上进行PCR扩增。扩增条件为:95℃ 3 min,94℃ 30 s,55℃退火 30 s,72℃ 30 s,35 个循环。以ΔCt(目的基因)-ΔCt(内参基因)计算实验组和对照组的ΔCt,按照ΔΔCt=ΔCt(实验组)-ΔCt(对照组)计算mRNA相对水平的差值,即2-ΔΔCt。

表1 Q-PCR引物序列
1.4 HepG2细胞NICD和NF-κB蛋白的检测 采用Western blot法,细胞经 LPS、DAPT或者 LPS+DAPT培养过夜,24 h后收集细胞,提取总蛋白并进行其浓度测定,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜至聚偏氟乙烯(PVDF)。脱脂奶粉封闭1 h后,加入一抗,4℃过夜,TBST洗膜30 min,加入二抗,室温孵育1 h,TBST洗膜10 min×4次,X胶片曝光,记录条带。
1.5 统计学方法 应用SPSS 19.0软件行统计学分析,计量资料以(±s)表示,采用 t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 HepG2细胞Jag 1-Notch 1信号通路因被LPS激活而水平增加 结果显示,经过LPS刺激48 h之后,NOTCH 1 水平显著高于对照组(P<0.001);同时,LPS也显著提高了NOTCH通路的配体Jag 1水平(P<0.001)。尽管NOTCH的另一个配体DLL 4水平也增加了,但是增加的程度远远不及Jag 1(P<0.01,图 1,表 2),表明 DLL 4 是部分被 LPS 激活。这些结果显示LPS主要通过激活Jag 1,导致Notch 1信号通路的激活。
2.2 LPS增加Notch信号通路和NF-κB激活 经Western blot检测Notch-NICD表达发现,LPS能够激活NICD表达,表明LPS在增加炎症反应的同时上调了Notch信号通路蛋白表达。同时,我们检测了LPS对TLR4-NF-κB验证信号通路的影响,结果LPS显著增强了NF-κB的表达。因此,LPS在激活TLR4-NF-κB炎症信号的同时也激活了Notch信号通路的表达(图2)。
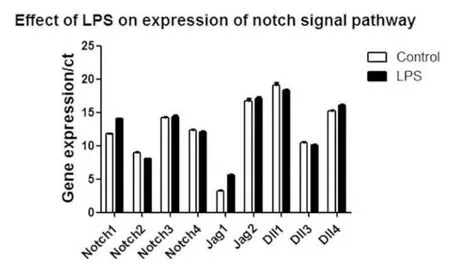
图1 各组细胞NOTCH家族受体及其相对应配体mRNA水平比较
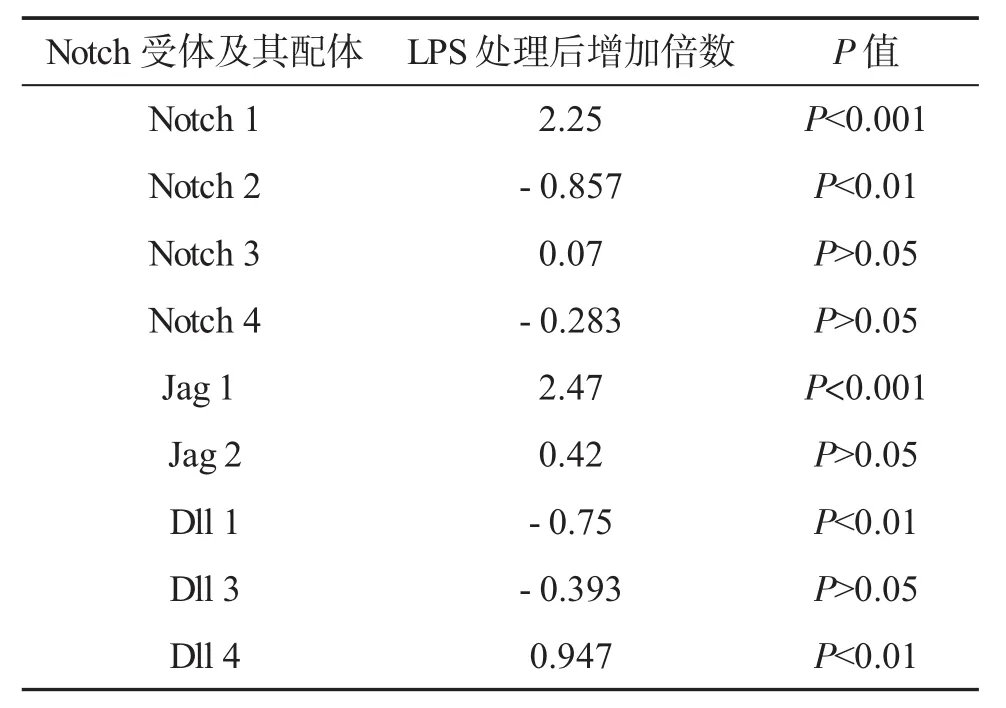
表2 各组HepG2细胞Jag 1-Notch 1信号通路mRNA水平变化
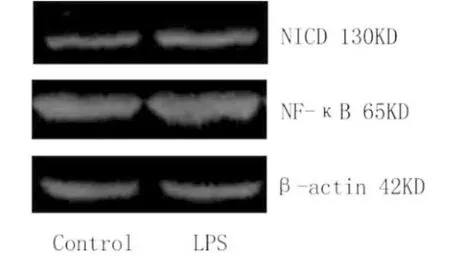
图2 细胞NICD和NF-κB蛋白表达情况 经LPS刺激后,Notch和NF-κB蛋白表达增强
2.3 抑制Notch信号通路减少了LPS引起的炎症信号表达 DAPT是一种γ-分泌酶抑制剂,能间接抑制Notch的活性。我们分别给予HepG2细胞LPS和DAPT处理或同时给予LPS联合DAPT处理,细胞孵育24 h后观察Notch信号通路下游分子NICD和LPS-TLR4炎症通路NF-κB信号表达情况,结果LPS处理后NF-κB和NICD表达增加,加入DAPT后NICD和NF-κB蛋白表达较前显著减少,从而说明抑制Notch通路可以显著改善LPS-TLR4引起的炎症反应。我们还发现,仅给DAPT处理,与对照组比,对于Notch的配体NICD和NF-κB无明显影响,进一步说明Notch信号通路是因为LPS被激活,而抑制NOtCH信号通路可以明显减少LPS引起的炎症信号表达增强(图3)。
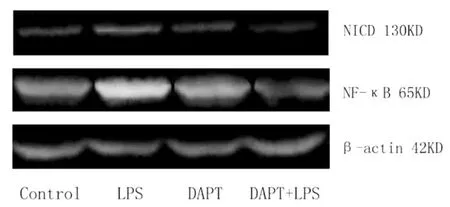
图3 各组细胞NICD和NF-κB蛋白表达情况 在有LPS刺激下,因Notch信号通路被抑制显著降低了NF-κB的活性
3 讨论
近年来,随着对肠道菌群和益生菌等研究的深入,肠源性内毒素血症在酒精性肝炎发生进展过程中的作用逐渐受到重视[8-11]。越来越多的研究证实肠源性LPS血症在ALD发病过程中有重要作用,ALD严重程度与血清内毒素水平呈正相关[12-16],应用抗生素清除肠道细菌能减少内毒素血症的来源,缓解因酒精引起的内毒素血症和酒精性肝损伤[17,18]。慢性酒精中毒导致血浆LPS水平增加,目前对其机制研究主要集中在三个方面:1,肠道革兰氏阴性细菌数量增加,从而释放更多的LPS入血;2,肠道粘膜对LPS通透性增加;3,肝脏库弗细胞对内毒素清除能力降低[19]。当LPS作用细胞表面时,Toll样受体(Toll like receptors,TLRs),比如 TLR2 和 TLR4 立即感应到LPS的存在,从而激活下游信号分子,比如IRAK1/4、TRAF6和NF-κB[2],这些炎症信号通路的激活加剧了肝脏的损伤。在ALD大鼠模型,注射LPS能导致大鼠脂肪肝病变的加重,甚至引起大鼠肝组织的炎性坏死。相应地,如果抑制肠道内阴性杆菌的生长以控制血浆LPS水平,则可减轻肝组织的损伤[20]。
肝内炎症级联反应在ALD发病过程中有重要作用。我们前期研究发现ALD小鼠模型肝内Notch1信号通路成分呈现高表达,并激活NF-κB,扩大炎症级联反应,从而加剧肝损伤。但是,在体外用酒精处理HepG2细胞时,却并未发现Notch1-NF-κB的激活,说明在小鼠模型中是其他的因素激活了Notch1-NF-κB,从而引起炎症级联反应。在本研究中,我们发现LPS促进TLR4和Jag1/Notch1的活化,从而激活NF-κB,引起炎症级联反应(图4)。综上所述,TLR4-NF-κB和 Notch1-NF-κB 这两条信号通路通过LPS而相互促进炎症反应的发生,并且更重要的是抑制Notch信号可以明显减少LPS引起的炎症信号反应。本研究为进一步阐明ALD发病机制和治疗肝损伤奠定了科学基础。
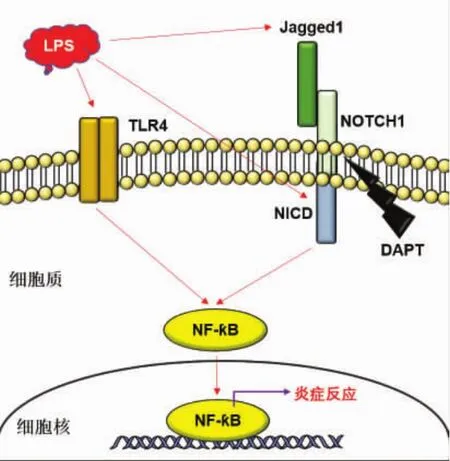
图4 HepG2细胞Notch与LPS-TLR4-NF-κB信号通路“会话”模式图
