影响聚乙二醇干扰素α-2b治疗慢性乙型肝炎患者疗效的多因素分析*
2019-07-26白一春邓霁红梅小平
白一春,邓霁红,梅小平
作者单位:638500四川省广安市人民医院感染病科(白一春,邓霁红);川北医学院附属医院感染病科(梅小平)
随着聚乙二醇化干扰素α-2b的出现,抗病毒治疗已取得长足的进步,但仍有部分患者无应答或疗效不持久[1-3]。有研究发现[4-6],CHB患者血清干扰素-γ诱导蛋白-10(IFN-γ inducible protein 10,IP-10)、α/β 干扰素受体(interferon-α/βreceptor,IFNAR)和辅助性T细胞17(T helper cell 17,Th17)水平常常发生改变,对发病起到重要的作用。本研究应用α-干扰素治疗了105例CHB患者,观察了患者血清IP-10、IFNAR和Th-17水平的变化及其对疗效的判断价值,现将结果报道如下。
1 资料与方法
1.1 一般资料 2015年6月~2017年12月我科收治的CHB患者105例,男56例,女49例;年龄32~57岁,平均年龄为(40.1±8.2)岁。符合《慢性乙型肝炎防治指南(2015更新版)》[7]的诊断标准。排除标准:①伴有甲型或丙型肝炎病毒或HIV合并感染者;②伴有酒精性或药物性肝损伤者;③伴有自身免疫性肝病、肝硬化或肝脏肿瘤者;④有精神病史者;⑤合并妊娠或哺乳期妇女;⑥接受过抗病毒治疗者;⑦伴有症状的心脏病或未能控制的癫痫者;⑧对治疗药物过敏者。患者给出知情同意书,本研究获得本院医学伦理委员会审核批准。
1.2 治疗方法 所有患者均采用聚乙二醇干扰素α-2b(上海罗氏制药有限公司,国药准字J20070055)180 μg皮下注射,1 次 /w,治疗 48 w。
1.3 指标检测 所有患者入组时均空腹采集肘静脉血。使用全自动血细胞分析仪检测血常规(日本西门子公司 ,型号ADVIA2120);使用全自动生化分析仪检测肝功能指标(日本OLYMPUS,型号AU2700);使用全自动血凝仪检测凝血酶原时间(法国STAGO公司,型号STA-R);采用电化学发光法检测血清HBsAg和HBeAg滴度(美国雅培i2000SR免疫分析仪);采用RT-PCR法检测血清HBV DNA水平(中国深圳匹基有限公司);采用双抗体夹心法检测血清IP-10(江苏江莱生物科技有限公司);采用RT-PCR法测定外周血单个核细胞IFNAR-α、IFNAR-β、IL-17A、IL-17F (检测 IFNAR-α和IFNAR-β的RT-PCR试剂盒购自武汉华美生物工程有限公司,检测IL-17A和IL-17F的RT-PCR试剂盒购自美国R&D SyStems),结果用平均荧光强度(mean fluorescene intendity,MFI)表示。
1.4 疗效标准 参照《慢性乙型肝炎防治指南(2015更新版)》[7],完全应答:血清转氨酶水平降至正常范围,血清HBV DNA水平阴转,血清HBeAg阳性患者发生HBeAg血清学转换。
1.5 统计学方法 应用SPSS 19.0软件处理数据,计量资料以(±s)表示,采用独立样本的t检验。将单因素分析有差异的项目纳入Logistic回归分析模型,进行多因素分析,P<0.05为差异有统计学意义。
2 结果
2.1 疗效情况 在治疗结束时,在105例CHB患者中完全应答56例(53.3%),未完全应答49例。
2.2 影响应答的单因素分析 应答与未应答患者血小板、白蛋白、总胆红素、凝血酶原时间、IFNAR-α和IFNAR-β差异无统计学意义(P>0.05);应答组患者白细胞、HBV DNA、HBsAg、IP-10、IL-17A 和IL-17F水平显著低于,而血清丙氨酸氨基转移酶水平显著高于未应答组(P<0.001,表1)。
2.3 影响抗病毒疗效的多因素Logistic回归分析 多因素Logistic回归分析显示,血清HBV DNA、HB-sAg、IP-10、IL-17A和IL-17F是CHB患者接受α-干扰素治疗后应答的影响因素(P<0.05,表2)。
表1 完全应答与未完全应答患者有关资料(±s)比较
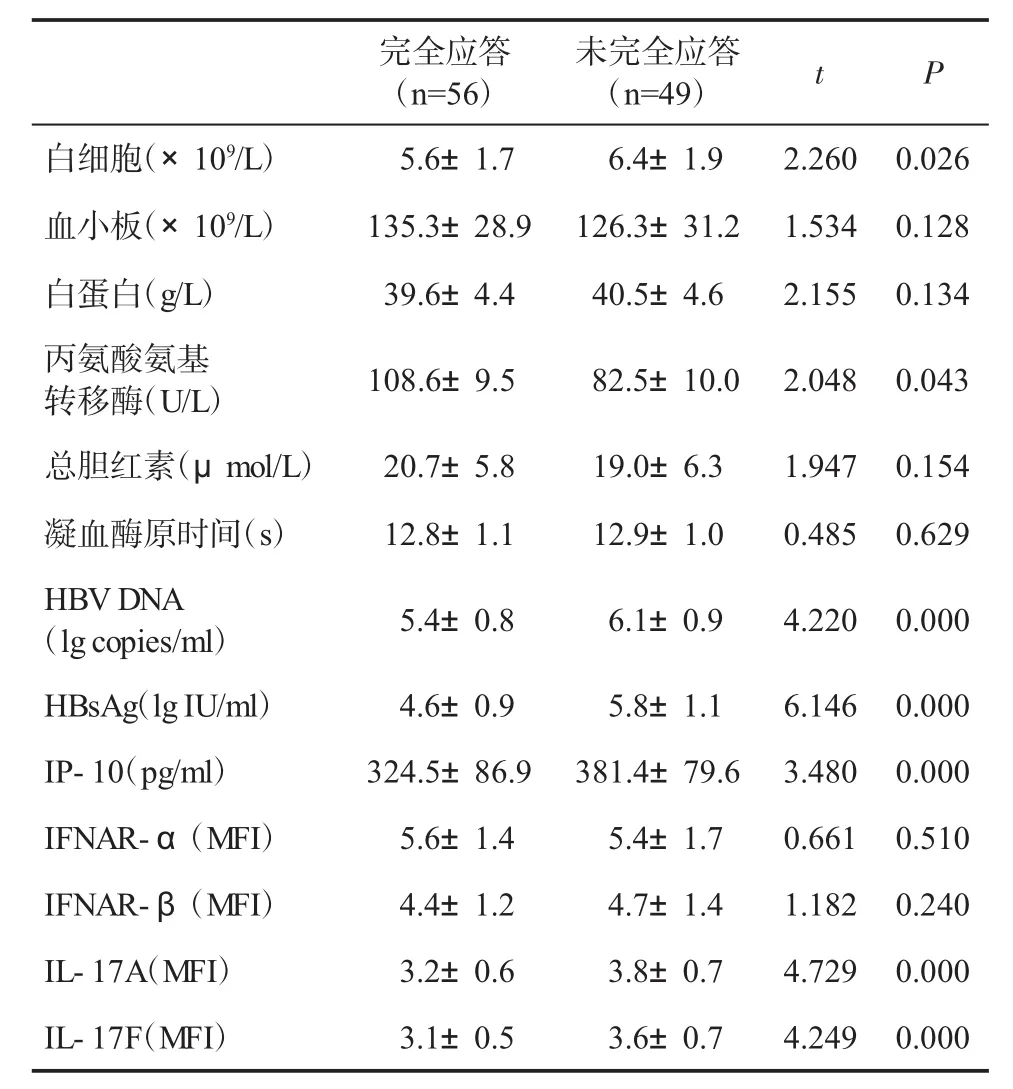
表1 完全应答与未完全应答患者有关资料(±s)比较
完全应答(n=56)未完全应答(n=49) t P白细胞(×109/L) 5.6±1.7 6.4±1.9 2.260 0.026血小板(×109/L) 135.3±28.9 126.3±31.2 1.534 0.128白蛋白(g/L) 39.6±4.4 40.5±4.6 2.155 0.134丙氨酸氨基转移酶(U/L) 108.6±9.5 82.5±10.0 2.048 0.043总胆红素(μmol/L) 20.7±5.8 19.0±6.3 1.947 0.154凝血酶原时间(s) 12.8±1.1 12.9±1.0 0.485 0.629 HBVDNA(lgcopies/ml) 5.4±0.8 6.1±0.9 4.220 0.000 HBsAg(lgIU/ml) 4.6±0.9 5.8±1.1 6.146 0.000 IP-10(pg/ml) 324.5±86.9 381.4±79.6 3.480 0.000 IFNAR-α(MFI) 5.6±1.4 5.4±1.7 0.661 0.510 IFNAR-β(MFI) 4.4±1.2 4.7±1.4 1.182 0.240 IL-17A(MFI) 3.2±0.6 3.8±0.7 4.729 0.000 IL-17F(MFI) 3.1±0.5 3.6±0.7 4.249 0.000
3 讨论
有研究发现[8,9],部分CHB患者经过聚乙二醇化干扰素α-2b治疗后并不产生应答或不能获得完全应答,但原因尚不明确。
本研究纳入105例CHB患者,均采用聚乙二醇化干扰素α-2b治疗48周,结果显示,完全应答率为53.3%,与以往报道的结果相似。为进一步分析影响聚乙二醇化干扰素α-2b治疗CHB患者应答的因素,本研究采用单因素分析发现获得完全应答与未获得完全应答患者血清白蛋白、丙氨酸氨基转移酶、HBV DNA、HBsAg、IP-10、IL-17A 和 IL-17F水平均存在显著性差异。进一步行多因素Logistic回归分析发现,血清 HBV DNA载量、HBsAg、IP-10、IL-17A和IL-17F为影响CHB患者在聚乙二醇化干扰素α-2b治疗后应答的独立因素。
血清丙氨酸氨基转移酶是肝胆疾病最常用的观察指标,丙氨酸氨基转移酶升高是宿主抗HBV免疫应答反应的结果,反映的是肝细胞的损伤[10]。已有证据表明[11],血清丙氨酸氨基转移酶是CHB患者在接受抗病毒治疗后HBeAg血清学转换的影响因素。在本研究中,完全应答组与未完全应答组患者血清丙氨酸氨基转移酶水平差异存在显著性统计学意义,血清丙氨酸氨基转移酶水平高者对聚乙二醇化干扰素α-2b抗病毒治疗能产生良好的应答,推测血清丙氨酸氨基转移酶水平高反映的是显著的肝组织学损伤,机体对抗病毒治疗作出了强烈的反应,导致病毒易于被清除[12]。血清白蛋白反映的是宿主肝功能的储备情况,系评估肝功能损伤的重要指标[13],而在应用聚乙二醇化干扰素α-2b治疗的CHB患者不存在肝功能的严重受损,所以对应答反应无明显的影响。血清HBV DNA和HBsAg水平均是反映CHB患者病情的直接指标,且可能与肝脏炎症损伤程度直接相关[14]。
有证据表明[14],各种不同类型的肝炎患者血清IP-10水平均有不同程度的上调。研究表明,IP-10可刺激CHB患者肝窦内皮细胞,趋化表达IP-10受体的单核细胞、淋巴细胞等向肝脏组织定向迁移,并辅助免疫细胞的活化,最终加重炎症和肝功能损伤[15]。本研究对应答与未获得应答患者外周血单个核细胞IP-10表达进行了检测,结果发现应答组患者IP-10表达较未应答组明显降低,且经Logistic回归分析证实其是影响聚乙二醇化干扰素α-2b治疗CHB患者应答的因素之一。研究发现[16],外周血单个核细胞IP-10表达与CHB患者肝组织纤维化分期有良好的相关性。国外研究证实[17],IP-10及其特异性受体通过Ras/ERK和P13K等信号通路调控相关细胞因子的合成和释放。Th17可分泌IL-17A和IL-17F等多种细胞因子,上述细胞因子可协同诱发炎症反应,加重肝纤维化而影响聚乙二醇化干扰素α-2b治疗CHB患者的应答。目前认为[18],CHB患者因病毒感染而诱导Th17分化,从而促进IL-17A和IL-17F分泌增加,可在一定程度上反映机体的免疫功能状态,故Th17也成为影响CHB患者应答反应的因素。
Th17还可提高巨噬细胞、T淋巴细胞等免疫活力,增强机体的免疫功能。聚乙二醇化干扰素α-2b可通过对机体的免疫调节实现对Th17和IP-10表达的抑制,从而减少IL-17A和IL-17F分泌,改善患者的应答反应[19],但由于缺乏体内试验的依据,故详细的作用机制尚不明确。α-干扰素具有多种功能活性,有Ⅰ型和Ⅱ型2种,需与相应的信号受体结合才能发挥其生物学效应。近年来,有研究发现[20],干扰素受体是导致干扰素治疗效果出现差异的主要原因,其中α和β是两种典型的Ⅰ型干扰素。在本研究中,完全应答与未获得完全应答患者基线IFNAR-α和IFNAR-β水平并无明显差异,也非影响聚乙二醇化干扰素α-2b治疗CHB患者应答的因素,推测与干扰素进入体内后会先与Ⅱ型受体结合,再与Ⅰ型受体结合有关,IFNAR-α 和IFNAR-β对应答反应的影响还需排除Ⅱ型受体的影响,故IFNAR-α和IFNAR-β不是影响聚乙二醇化干扰素α-2b治疗CHB患者应答反应的因素。
