灵活机动“掌握”微粒空间构型
2019-07-19胡协强沈建敏
胡协强 沈建敏

摘要:能判断微粒的空间构型是高中学生必须具备的基本能力,而让该能力在解题中灵活发挥,除需要扎实的基础知识和对重点难点知识适当的理解,还需要讲究一定的技巧方法。
关键词:杂化轨道;价层电子对;等电子体
文章编号:1008-0546(2019)06-0015-02 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2019.06.004
化学是研究物质的组成、结构、性质及变化规律的自然科学,掌握微粒空问结构是了解物质的极性、磁性、旋光性、溶解性、化学反应活泼性等性质的重要途径。在高中化学选修《物质结构与性质》一书中主要介绍了三种解释微粒空间结构的理论知识。分别是杂化轨道理论、价层电子对互斥理论及等电子体原理。
在中学阶段,由于学生不能深入了解这三种理论,理性认识不足,且学生只熟悉一些常见微粒的结构、组成,当遇到较复杂的微粒,往往就不能作出正确的判断。通过与学生交流,發现学生主要是对这三种理论不能灵活应用,无法根据实际微粒的组成特点选用恰当的方法,更不能将这些理论整合使用。
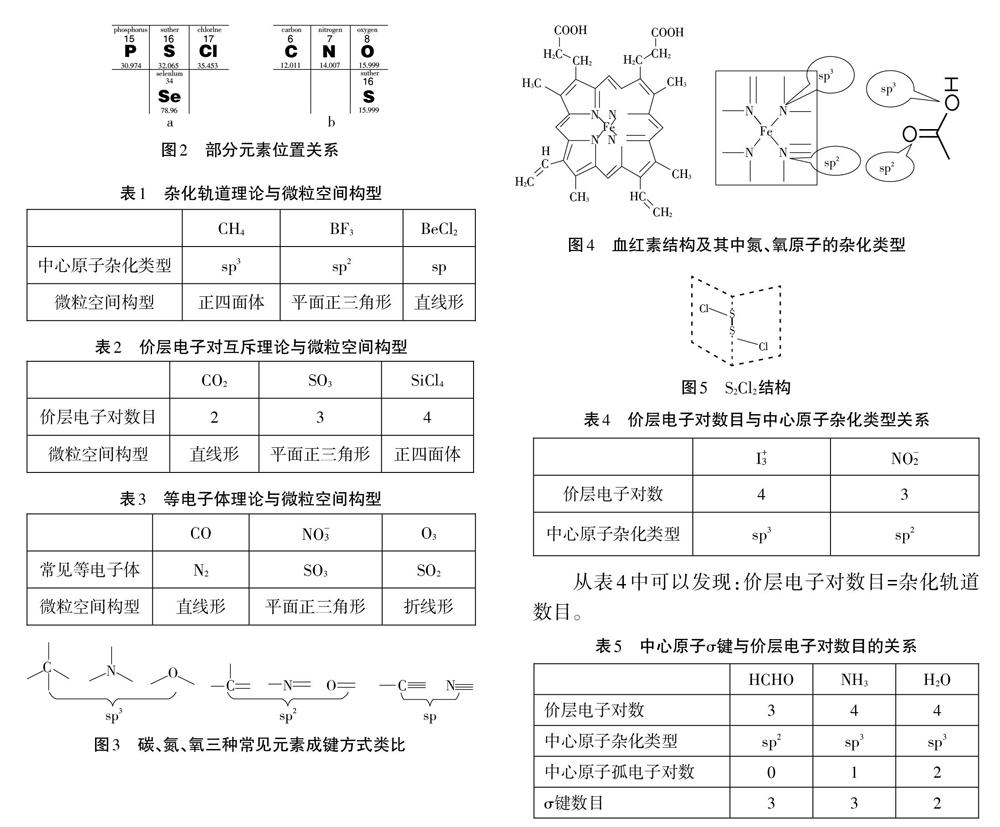
根据多年的教学经验,笔者将这三种理论的关系整合如下:中学化学中一般只涉及到sp、sp2、sp3三种杂化类型,其它较为复杂的杂化不需要掌握和了解。在书本中除碳、硼、铍三种原子具体介绍了如何进行杂化,其它原子的杂化类型一般都是通过另外两个理论来推测的,而不是通过中心原子的杂化类型来推测微粒的空间构型。例如硫酸根离子,学生现有知识很难描述原子的成键形式或中心硫原子的杂化类型,而是通过价层电子对互斥理论(n=4)或等电子体理论(与CCI4互为等电子体)推测硫酸根离子为正四面体,从而确定硫原子是以sp3进行杂化的。
学生在用等电子体推测微粒空间结构可以常用的方法有以下三种,同周期元素左右替换、同主族元素上下替换,电子一电荷互换法。但笔者认为有前两种方法基本可以在中学化学中解决等电子体问题。例如SO42-,按照周期表中元素的位置(图2a),与之互为等电子体的是PO43-、CIO4-和SeO42-等微粒。与N3互为等电子体的可以是CO2、N2O、SCN-等常见微粒。这四种元素的位置关系如图2b所示。
综上所述,笔者认为学生若要较好地掌握这部分知识并能应用于解题,应巩固基础知识同时加强重点难点知识突破,在遇到相应题时,灵活机动,将三种理论有机结合,从而解出微粒空间构型这部分题目。
一、熟悉常见微粒,能用相应理论解释其空间构型(如表1、2、3)
二、抓住重点难点,巧法解题
针对比较复杂的微粒中原子杂化类型的判断,以碳原子的成键方式类比推知N、O等常见原子的杂化类型。
例如,在血红素分子中氮原子和氧原子的杂化类型(图4)。通过以上类比的方法也可推测其它同主族元素原子的杂化类型。例如S2CI2,其结构如图5所示,我们发现分子中硫原子的成键形式和水分子中氧原子(sp3杂化)的成键形式类似,因此硫原子以sp3进行杂化的。
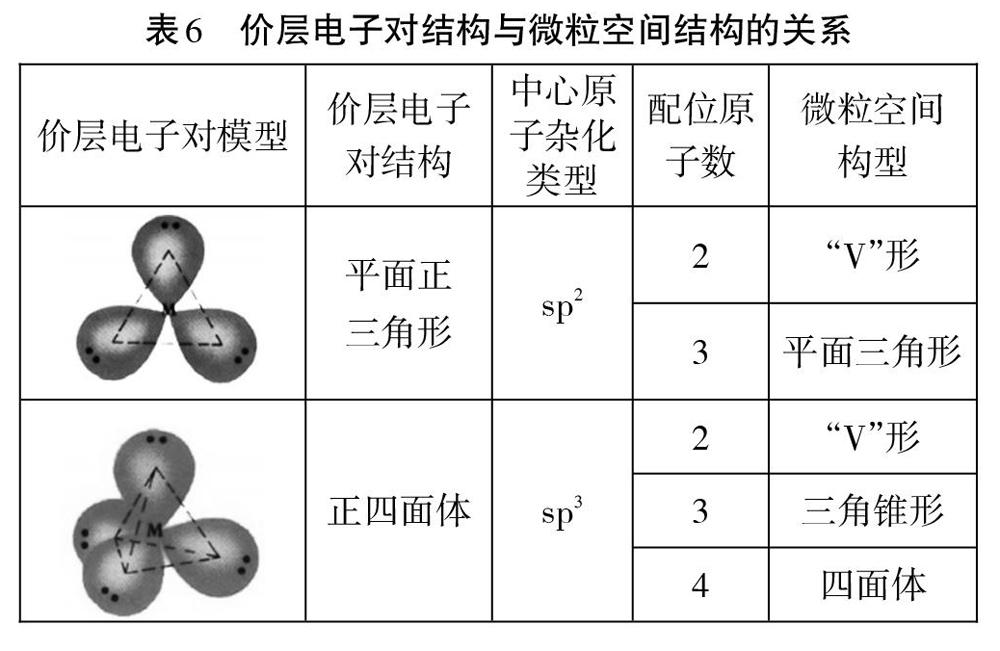
结构相对简单的微粒,能用价层电子对互斥理论推测中心原子杂化类型(如下表4)。也可以通过归纳总结σ键与价层电子对数目的关系来推测中心原子杂化类型,不深入理解(如下表5)。我们还常结合价层电子对结构和配位原子数来推测微粒空间构型(如下表6)。
从表4中可以发现:价层电子对数目=杂化轨道数目。
从表5中可以发现:价层电子对数目=中心原子孤电子对数+σ键数目。
从表6可以看出,不能根据价层电子对直接推测微粒空间结构,必须考虑配位原子数目。也就是要有以下思考过程:价层电子对数→价层电子对结构→配位原子数微粒空间构型。
综上所述,对于微粒的空间构型和原子杂化形式的判断,学生必须要将三种理论有机整合,不能将三种理论完全割裂,同时要根据不同的对象,随机应变,灵活应用合适的技巧。