鳞柄小奥德蘑多糖对体外培养的巨噬细胞抑制结直肠腺癌细胞生长的影响
2019-07-18张绍楠刘紫征闫训友
张绍楠,刘紫征,赵 敏,乔 洁,3,闫训友,3,王 晶,3*
(1.廊坊师范学院 生命科学学院,河北 廊坊 065000;2.河北医科大学第四医院,河北 石家庄 050011;3. 河北省食药用菌资源高值利用技术创新中心,河北 廊坊 065000 )
【研究意义】鳞柄小奥德蘑(Oudemansiellafurfuracea),归属蘑菇目(Agaricales)膨瑚菌科(physalacriaceae)狭义小奥德蘑属(Oudemansiella)[1],其口味鲜美,富含多种营养成分[2],具有较高的营养和经济价值,主要种植于北京、河北和山东等地区。目前对该菌的研究主要集中在栽培和生物活性的提取等方面[2-3],未见鳞柄小奥德蘑多糖生物学活性的研究报道。【前人研究进展】真菌多糖是食药用真菌活性物质之一。近年来的研究发现,真菌多糖可通过激活巨噬细胞调节机体免疫能力和抗肿瘤[4-8]。如香菇多糖(国药准字Z20080579)、灵芝多糖(国药准字Z36021232)、银耳多糖(国药准字Z22023305)和茯苓多糖(国药准字B20050015)[9]可作为免疫调节剂,与抗肿瘤化疗药物联用,增强疗效;阿魏侧耳胞外多糖可通过提高小鼠巨噬细胞吞噬活性和血清中肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)含量等增强机体免疫能力,降低荷瘤小鼠实体瘤的重量[10-11],因此,真菌多糖是极具开发价值的功能性物质,它逐渐成为新药、功能保健品、绿色食品添加剂[12]和临床应用中极具潜力的发展方向。【本研究切入点】本文利用巨噬细胞和结直肠腺癌细胞的体外培养体系,以四甲基偶氮唑蓝法(methylthiazoletrazolium,MTT)测定存活的结直肠腺癌细胞数量为指标,研究鳞柄小奥德蘑多糖对巨噬细胞抑制结直肠腺癌细胞生长的影响。【拟解决的关键问题】通过测定巨噬细胞中诱导型一氧化氮合成酶(inducible nitric oxide synthase, iNOS)和NO的合成与分泌量、TNF-α和白细胞介素-1(interleukin 1, IL-1)分泌量,初步探究相关细胞和分子机制,为鳞柄小奥德蘑多糖的应用提供理论支持。
1 材料与方法
1.1 供试材料
试验材料:鳞柄小奥德蘑,购自廊坊市,采用ITS序列分析鉴定[13]后备用;结直肠腺癌细胞Caco-2和巨噬细胞NR8383购自中国科学院细胞库,保存于本实验室内液氮罐中。
1.2 试剂与仪器设备
试验试剂:F12K培养基和脂多糖(lipopolysaccharides,LPS)美国Sigma公司;DMEM/F12和胎牛血清(fetal bovine serum, FBS)美国Gibco公司;NO荧光探针(4-Amino-5-Methylamino-2',7'-Difluorofluorescein Diacetate,DAF-FM DA)、NO检测试剂盒和双辛丁酸法(bicinchoninic acid,BCA)蛋白浓度测定试剂盒上海碧云天生物技术有限公司; TNF-α、IL-1β和iNOS ELISA检测试剂盒青岛海德诚生物工程有限公司;四甲基偶氮唑蓝和MD44透析袋北京索莱宝科技有限公司;实验所需其它试剂均为国产分析纯。
试验仪器:MCO-20AIC二氧化碳培养箱和MLS-3750高压蒸汽灭菌锅日本SANYO公司;iMark酶标仪美国Bio-Rad公司;Milli-Q超纯水机 美国Millipore公司;BX50系统显微镜(配有CCD图像传感器(DP71)及Image-pro plus 图像分析软件)和CKX41SF倒置显微镜日本Olympus公司;ZHJH-C超净工作台上海智城分析仪器制造有限公司。
1.3 实验方法
1.3.1 多糖提取 采用热水浸提法[13]。将鳞柄小奥德蘑子实体自然干燥,用组织粉碎机粉碎为干粉,乙醇除脂[14],低温干燥后,热水浸提,旋转蒸发仪浓缩,Sevag法除蛋白,透析袋透析(截留分子量3.5 kD),冷冻干燥后得鳞柄小奥德蘑多糖(polysaccharides fromOudemansiellafurfuracea,OFPS)[13],将其溶解于F12K培养液(含15 % FBS),0.22 μm微孔滤膜过滤除菌后,置于4 ℃冷藏备用。
1.3.2 细胞复苏与培养 细胞复苏参考倪黎纲等[15]方法,并改进。从液氮中取出细胞冻存管,置于40 ℃水浴融化后,将细胞悬液转至离心管中,离心后弃上层液体,用含20 % FBS的细胞培养液悬浮细胞,接种至底面积为25 cm2的细胞培养瓶中,37 ℃恒温培养。
1.3.3 细胞培养与传代 巨噬细胞采用培养瓶悬浮法培养,离心法传代。收集细胞悬液,1500 r/min离心10 min,弃上层液体,加入重悬细胞,分别接种于2个培养瓶中,补足培养液至5 mL。
结直肠腺癌细胞采用培养瓶贴壁培养,胰蛋白酶消化法传代。待培养瓶中细胞汇合率达80 %~90 %,用D-Hanks漂洗1次,胰蛋白酶-EDTA消化,加入含10 % FBS的DMEM/F-12培养液,吹打分散,分别接种于两个培养瓶中,补足培养液至5 mL/瓶,37 ℃恒温培养。
1.3.4 细胞接种 参考王晶等[11]方法。离心收集巨噬细胞或者结直肠腺癌细胞,调整细胞密度为2×105个/mL,接种至细胞培养板,置37 ℃,含5 % CO2的恒温培养箱培养。巨噬细胞与结直肠腺癌细胞共培养体系的建立:按上述方法收集接种结直肠腺癌细胞至96孔细胞培养板中,细胞接种密度为2×108个/L,37 ℃,含5 % CO2的恒温培养箱培养24 h后,弃上层培养液和未贴壁细胞,加入200 μl巨噬细胞悬液,细胞密度为2×109个/L[16],细胞培养液为含10 % FBS的DMEM/F-12,培养条件为37 ℃,5 % CO2,恒温。
1.3.5 多糖处理 在上述细胞培养体系中添加鳞柄小奥德蘑多糖处理,设空白对照组、阳性对照组和多糖处理组。空白对照组添加完全培养液,阳性对照组添加终浓度为20 mg/L的LPS,多糖处理组分别添加终浓度为25、50、100和200 mg/L的鳞柄小奥德蘑多糖,每组设10个重复。
1.3.6 细胞存活率检测 采用MTT法[17]。多糖处理后,添加5 g/L的MTT母液处理4 h。巨噬细胞:将细胞培养板中的细胞悬液收集至离心管中,1500 r/min离心10 min,弃上层液体,缓冲溶液D-Hanks漂洗1次,再次离心,每个离心管中加入150 μl二甲基亚砜(dimethyl sulfoxide,DMSO),震荡混匀后转置于96孔细胞培养板中,酶标仪检测OD490。单独培养或共培养的结直肠腺癌细胞:吸弃96孔细胞培养板中上层液体或巨噬细胞悬液,D-Hanks漂洗2遍,每孔加入150 μl DMSO,震荡混匀,酶标仪检测A90。
1.3.7 巨噬细胞NO含量测定 细胞内NO检测采用荧光探针法[11]。按上述方法接种巨噬细胞并用鳞柄小奥德蘑多糖处理24 h,离心后收集培养上清,备用;细胞沉淀中加入稀释后DAF-FM DA荧光探针(探针∶稀释液=1∶300),37 ℃避光孵育30 min,D-Hanks洗涤细胞3次,去除未进入细胞内的DAF-FM DA,后用D-Hanks重悬细胞,并转至载玻片,加盖盖玻片后用荧光显微镜观察拍照,Image-ProPlus软件测定光密度值。
细胞外NO分泌量检测采用Griess法[11]。将试剂盒中Griess Reagent I和II,室温放置30 min回温,在96孔细胞培养板中依次加入50 μl标准品或各组巨噬细胞培养上清、50 μl Griess Reagent I和50 μl Griess Reagent II。NaNO2标准品稀释后终浓度分别为0、0.1、0.2、0.4、0.6、1.0 μmol/L。每组设3个重复。酶标仪测定A540nm,并根据NaNO2浓度标准曲线计算各培养上清中NO浓度。
1.3.8 iNOS测定 按上述方法接种巨噬细胞至6孔细胞培养板中,接种量为5 mL。多糖处理24 h后,离心,细胞沉淀用PBS重悬,超声波细胞破碎仪破碎[11],离心,收集上清,按照试剂盒说明,通过酶联免疫吸附实验测定巨噬细胞中iNOS含量[11]。
酶联免疫吸附实验采用双抗体一步夹心法[11]。按照试剂盒说明,在室温平衡后酶标板的板条中依次加入50 μl不同浓度的标准品或者10 μl待测样品(补加40 μl样品稀释液)、100 μl辣根过氧化物酶标记的检测抗体(空白孔除外),37 ℃温育30 min。弃液体,甩干,多次洗涤甩干后,每孔加入底物A、B各50 μl,避光孵育,终止液终止反应。酶标仪检测A450 nm,根据标准品浓度标准曲线计算样品中iNOS浓度。
1.3.9 TNF-α、IL-1β分泌量的测定 采用双抗体一步夹心法[11]。取上述离心后的巨噬细胞培养上清,按照试剂盒的说明操作 (方法同1.2.8),根据浓度标准曲线计算TNF-α和IL-1β浓度。
1.4 统计学处理
2 结果与分析
2.1 巨噬细胞和结直肠腺癌细胞的培养
复苏后的巨噬细胞和结直肠腺癌细胞在实验培养体系中均可正常的生长和增殖。其中,巨噬细胞(图 1A)在含10 % FBS的F12K培养基中悬浮或半悬浮生长,呈圆形,细胞透光性较好,细胞生长较缓慢,10~15 d传代1次。人结直肠腺癌细胞(图1B)在含10 % FBS的DMEM/F12培养基中则贴壁生长,呈上皮细胞样,细胞连接紧密,生长迅速,5~7 d可传代1次。两细胞共同培养时(图 1C),巨噬细胞悬浮于上层培养液中,细胞透光性较好,细胞较结直肠癌腺细胞分裂相小,且部分细胞有轻微聚集现象;结直肠腺癌细胞贴附于培养瓶底部,细胞质中有较多空泡,细胞状态较差。

A, 巨噬细胞NR8383 (100×); B, 结直肠腺癌细胞Caco-2 (100×);C, 共培养的巨噬细胞和结直肠腺癌细胞(200×),“→” 示巨噬细胞, “#” 示结直肠腺癌细胞内空泡A, NR8383 (100×); B, Caco-2 (100×);C, Co-cultured NR8383 and Caco-2 (200×),‘→’: NR8383,‘#’: Cytoplasmic vacuoles in Caco-2图1 体外培养的巨噬细胞和结直肠腺癌细胞Fig.1 Cultured alveolar macrophage and colorectal adenocarcinoma in vitro
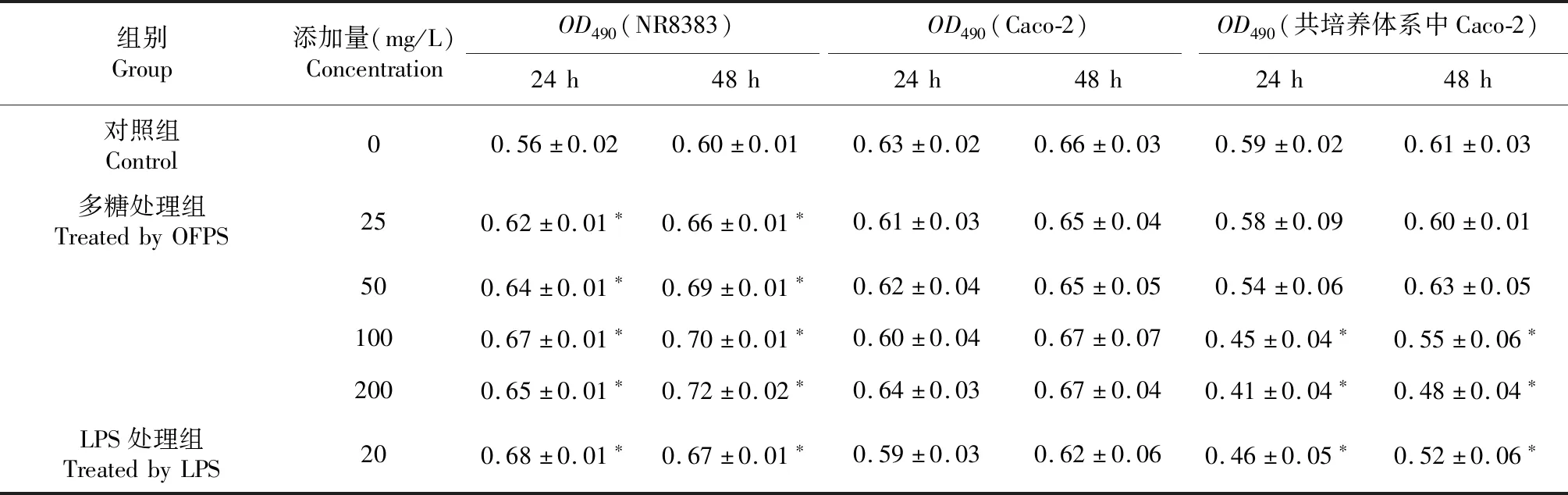
表1 鳞柄小奥德蘑多糖对体外培养的巨噬细胞和结直肠腺癌细胞存活的影响Table 1 Effect of OFPS on the survival of colorectal adenocarcinomas and alveolar macrophages in vitro
注:“*”与空白对照组相比,显著差异(P<0.05),下同。
2.2 2鳞柄小奥德蘑多糖对巨噬细胞和结直肠腺癌细胞存活的影响
由表1可知,25~200 mg/L的鳞柄小奥德蘑多糖处理24和 48 h,巨噬细胞的数量显著高于对照组(P< 0.05),而结直肠腺癌细胞的数量与对照组无显著性差异,说明鳞柄小奥德蘑多糖可促进巨噬细胞的增殖,但对结直肠腺癌细胞的生长无显著性影响。
根据上述实验结果,结合体外培养的结直肠腺癌细胞贴壁生长和巨噬细胞悬浮生长的特点,研究者建立了2种细胞的共培养体系,对该体系实施轻微震荡和磷酸盐缓冲溶液漂洗处理,即可去除其中悬浮生长的巨噬细胞,之后采用MTT法测定的共培养体系的细胞存活率应为结直肠腺癌细胞的存活率。由表1可知,与独立培养的结直肠腺癌细胞相比,接种巨噬细胞24和48 h后,共培养体系中结直肠腺癌细胞的存活率显著降低(P< 0.05)。与共培养对照组相比,100~200 mg/L的鳞柄小奥德蘑多糖处理24和48 h,共培养体系中结直肠腺癌细胞的存活率显著降低(P< 0.05),25~50 mg/L鳞柄小奥德蘑多糖处理24和 48 h对培养体系中结直肠腺癌细胞的存活率无显著性影响。由于鳞柄小奥德蘑多糖处理24和48 h均未引起体外培养巨噬细胞或结直肠腺癌细胞存活率的下降,故推测,共培养体系中巨噬细胞对结直肠腺癌细胞具有一定的杀伤作用;鳞柄小奥德蘑多糖处理后,共培养体系中结直肠腺癌细胞存活率显著下降,可能是由于巨噬细胞对其杀伤作用被增强所致。
2.3 鳞柄小奥德蘑多糖对巨噬细胞NO合成和分泌的影响
巨噬细胞几乎分布于全身各组织[18],主要由血液中的单核细胞穿出血管到达结缔组织后分化而来。在LPS和白细胞介素4/13(interleukin 4/13, IL-4/13)刺激下,巨噬细胞可分别极化为经典活化巨噬细胞(classically activated macrophage,M1型)[19]和替代性活化巨噬细胞(alternatively activated macrophage,M2型)[20-21]。其中,M1型巨噬细胞分泌IL-1和TNF-α等信号分子[22],表达iNOS并以精氨酸为底物产生NO和活性氮[23],从而抑制病原菌的增殖[22]、诱导细胞凋亡[24]、杀死癌细胞[ 18]和调节机体的免疫能力[25];M2型巨噬细胞则表达精氨酸酶-1产生鸟氨酸和尿素[24],并分泌血管内皮细胞生长因子、血小板源生长因子、肿瘤坏死因子β(tumor necrosis factor-β, TNF-β)和IL-10(interleukin 10, IL-10)等细胞因子,具有促进细胞增殖、抗炎和组织修复功能[18]。由此可见,NO是M1型巨噬细胞发生攻击反应时的独特分子[18]。
DAF-FM DA最新一代NO荧光探针是可穿过质膜,并被细胞质中的非特异性酯酶切割乙酸基,形成DAF-FM。DAF-FM不能穿过质膜,有很弱的荧光,但与NO反应后形成苯并三氮唑,后者能产生强烈的荧光[26]。跨质膜扩散到细胞外的NO极不稳定,容易被氧化生成NO3-和NO2-,NO2-可采用Griess Reagent方法检测,在一定程度上代表细胞产生的NO的相对量[12]。
由图2~3可知, 25 mg/L鳞柄小奥德蘑多糖处理组巨噬细胞中NO探针的荧光较弱,平均光密度较低,与对照组无显著性差异;而50~200 mg/L鳞柄小奥德蘑多糖处理的巨噬细胞内NO探针的荧光强度和平均光密度显著增强(P< 0.05),且具有浓度依赖性。由表2可知,50~200 mg/L鳞柄小奥德蘑多糖处理巨噬细胞24 h后,细胞内iNOS浓度和细胞培养上清中NO浓度显著增加(P< 0.05),与细胞内NO探针的平均光密度结果一致,说明50~200 mg/L的鳞柄小奥德蘑多糖促进了巨噬细胞中iNOS表达和NO合成,进而抑制共培养体系中结直肠腺癌细胞的生长。
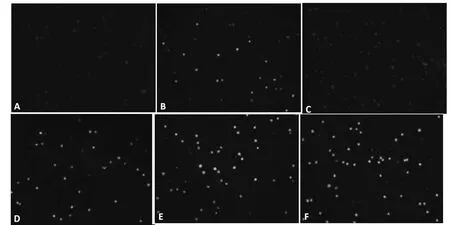
A.空白对照组;B.20 mg/L LPS处理组; C~F.25,50,100,200 mg/L鳞柄小奥德蘑多糖处理组A.Control;B.Treated with 20 mg/L LPS; C-F.Treated with 25,50,100,200 mg/L OFPS图2 NO荧光探针标记的巨噬细胞(200×)Fig.2 Alveolar macrophages labeled by DAF-FM DA
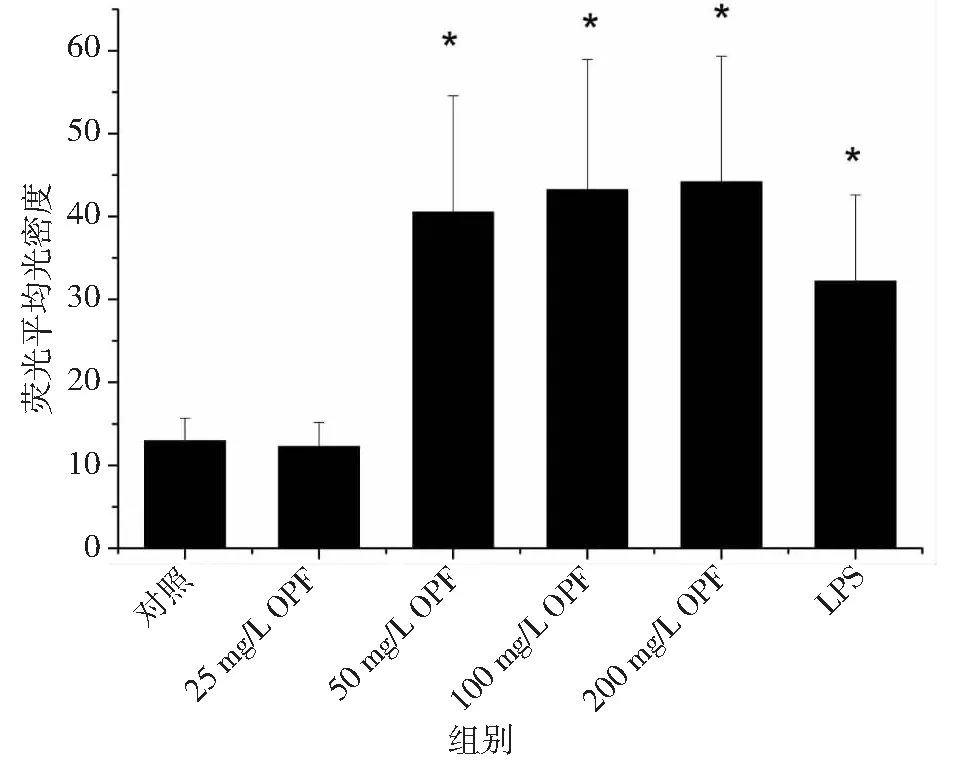
“* ”,表示与对照组相比,差异显著(P < 0.05)图3 巨噬细胞中NO探针荧光的平均光密度值Fig.3 Mean optical density of fluorescence for NO probe in alveolar macrophages
2.4 鳞柄小奥德蘑多糖对巨噬细胞TNF-α和IL-1β分泌量的影响
NR8383细胞系来源于肺灌洗时的正常大鼠巨噬细胞[27],具有吞噬酵母多糖,表达iNOS和分泌IL-1和TNF-α等信号分子能力[28 ]。采用双抗体夹心法进行酶联免疫吸附实验的结果显示,25~200 mg/L的鳞柄小奥德蘑多糖处理24 h,可显著提高巨噬细胞TNF-α的分泌量(P<0.05,表2);25~200 mg/L的鳞柄小奥德蘑多糖对巨噬细胞IL-1β的分泌量无显著性影响(表2)。
3 讨 论
为研究鳞柄小奥德蘑多糖对巨噬细胞抑制癌细胞生长的影响,本实验选择巨噬细胞NR8383细胞和消化道癌细胞——结直肠腺癌细胞作为实验细胞,其中NR8383细胞具有吞噬功能,并可分泌多种细胞因子。研究者在2种细胞的体外独立培养体系和共培养体系中添加不同浓度的鳞柄小奥德蘑多糖,采用MTT法测定了独立培养和共培养体系中结直肠癌细胞的存活率。研究发现,鳞柄小奥德蘑多糖对独立培养的结直肠癌细胞生长无显著性影响,但可引起共培养体系中结直肠癌细胞存活率的显著下降。
研究表明,NO是M1型巨噬细胞发生攻击反应时合成和分泌的信号分子[18],TNF-α是巨噬细胞分泌的一种多效细胞因子,具有杀伤肿瘤细胞、调节机体免疫和提高中性粒细胞吞噬活性等功效[10]。IL-1β是巨噬细胞产生的一类调控免疫系统的细胞因子,主要介导炎症反应[10]。本实验采用荧光探针标记和酶联免疫实验等方法测定的共培养体系中巨噬细胞NO和合成与分泌量以及培养上清中TNF-α和IL-1β含量结果表明,一定添加浓度的鳞柄小奥德蘑多糖处理显著提高了巨噬细胞TNF-α的分泌量,但对IL-1β含量无显著性影响。由此推测,一定添加浓度的鳞柄小奥德蘑多糖可能通过增加巨噬细胞对NO和TNF-α的分泌量,进而增强巨噬细胞的杀伤癌细胞的能力,降低了共培养体系中结直肠腺癌细胞的数量。
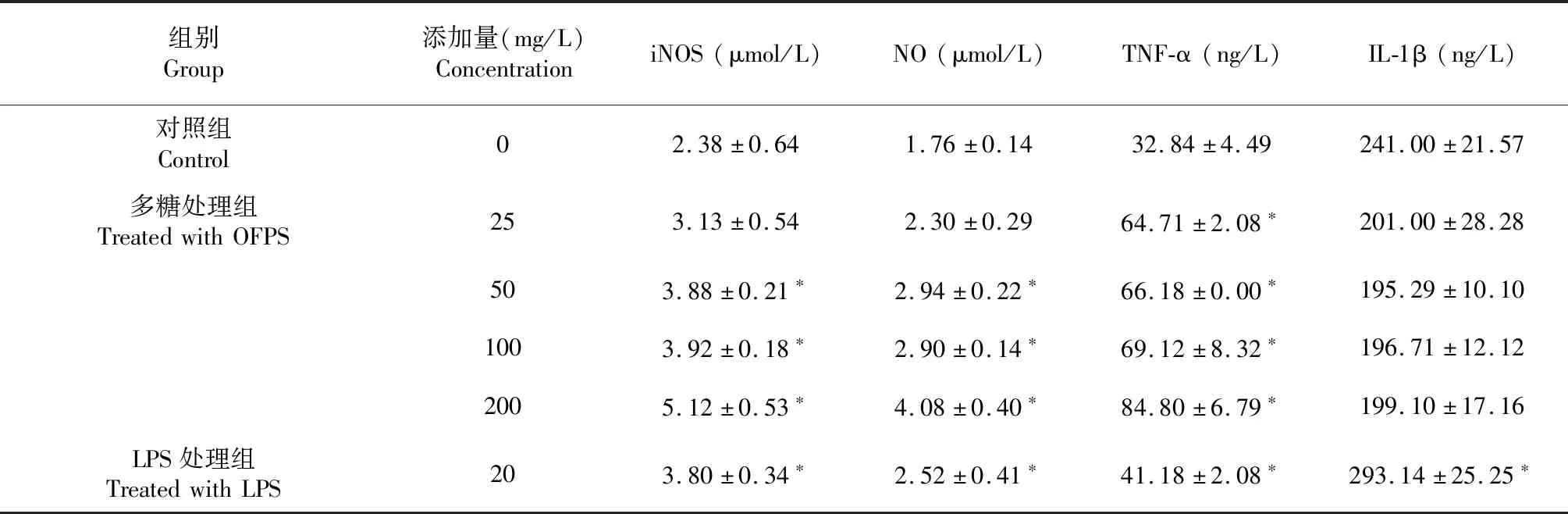
表2 鳞柄小奥德蘑多糖对巨噬细胞NO、iNOS和细胞因子分泌量的影响Table 2 Effects of OFPS on NO, iNOS and cytokines’ secretion of cultured alveolar macrophages in vitro
4 结 论
利用巨噬细胞和结直肠腺癌细胞的不同生长特性,建立了两种细胞的共培养体系,并利用此体系,研究鳞柄小奥德蘑多糖对共培养体系中巨噬细胞抑制结直肠腺癌细胞生长的影响。根据存活细胞数量、荧光探针标记和酶联免疫吸附试验等测定结果可知,添加一定浓度的鳞柄小奥德蘑多糖可显著降低共培养体系中结直肠腺癌细胞的数量,而这种作用可能是鳞柄小奥德蘑多糖通过提高细胞对iNOS、NO和TNF-α等合成或分泌量,进而抑制结直肠腺癌细胞生长和增强巨噬细胞杀伤能力。
