羽衣甘蓝的BoRACK1基因抗病性分析
2019-07-18郭君洁朱凤云李大红李鸿雁
郭君洁,李 伟,朱凤云,李大红,李鸿雁
(黄淮学院生物与食品工程学院,河南 驻马店 463000)
【研究意义】RACK1(蛋白激酶C1受体)基因是含有7个β-螺旋桨结构的多功能支架蛋白,是色氨酸、天冬氨酸重复(WD重复)蛋白家族的一员。 植物中RACK1同源基因作为细胞生长素诱导基因,第一次在烟草BY-2悬浮细胞被鉴定出来[1]。随后,RACK1的同源氨基酸序列在所有检测过的真核生物中都被发现[2]。RACK1在多个信号转导通路和不同信号分子调节过程中,RACK1的作用是控制cAMP信号转导、信使RNA翻译调控、细胞骨架重构和蛋白质的降解。许多报告显示,RACK1与生物胁迫相关[3-5]。因此,开展羽衣甘蓝BoRACK1基因抗病性研究,有助于探讨羽衣甘蓝BoRACK1基因参与生物胁迫的分子机理,为改良植物抗病性提供新的选择。【前人研究进展】2008年Nakashima等[6]报道在水稻幼苗中的OsRACK1A过表达促进活性氧(ROS)的产生。转基因水稻植株和细胞培养的分析表明,RACK1A可以促进ROS的生产和提高抗稻瘟病感染的能力。Wang等[7]采用PCR技术克隆玉米RACK1基因(ZmRACK1)。玉米中的ZmRACK1过表达导致由玉米叶片上的大斑病菌引起的症状减少。Komatsu等[4]研究发现,尽管活化蛋白激酶C1 (RACK1)在大豆细胞核中积累,但在受涝逆境中,蛋白激酶C1 (RACK1)降低了其mRNA的水平。许多报道表明,RACK1与哺乳动物的免疫系统和疾病有关[8-10]。迄今,虽然RACK1基因在拟南芥和水稻等模式植物中有一些研究,但有关BoRACK1基因抗病性未见报道。本研究从羽衣甘蓝中的编码蛋白质序列(xp_013610846)分离出1个RACK1基因,与拟南芥中RACK1序列同源性高达87.1 %,而水稻OsRACK1同源性高达87.2 %。【本研究切入点】本文主要研究羽衣甘蓝RACK1基因过表达对抗病性的响应及相关机理进行研究本研究克隆BoRACK1基因, 采用PCR和Southern blot对其进行检测分析,并对RACK1基因过表达对抗病性的研究。 【拟解决的关键问题】以期研究RACK1在羽衣甘蓝中的抗病功能, 为完善该基因在生物胁迫中的功能奠定基础。
1 材料与方法
1.1 植物材料与真菌菌株
羽衣甘蓝(Brassicaoleraceavar. acephala f.tricolor)由驻马店市南海公园提供。霜霉菌菌株由本实验保存。
1.2 BoRACK1基因的克隆
利用试剂盒提取总RNA。DNaseⅠ处理方法,对处理过的总RNA(2 μg)进行变性处理并反转录,使用第一链cDNA合成试剂盒进行总RNA反转录(Thermo Scientific)。正向引物P1和一个反向引物P2(表1)是基于对羽衣甘蓝的mRNA序列中核苷酸序列(GenBank登录号:Loc106317602)而设计的。扩增条件:95 ℃ 5 min的预变性,95 ℃ 1 min 30个循环,53 ℃ 1 min,72 ℃ 1 min,72 ℃ 10 min。 PCR产物由1 %琼脂糖凝胶电泳后回收。纯化的片段克隆到pMD18-T载体(TaKaRa,中国大连),通过测序确定cDNA插入片段(捷瑞,中国上海)。
1.3 质粒的构建和羽衣甘蓝转化
为了获得羽衣甘蓝中的BoRACK1基因过表达植物,用BamH I和BclI双酶切后与表达载体相连,组成一个过表达BoRACK1基因的质粒,植物表达载体中有花椰菜花叶病毒35S启动子(CaMV35S)和NOS终止子(图1A)。酶切法验证BoRACK1基因。以同样的方式构建了RNA干扰(RNAi)载体(引物序列:正向P3和反向P4),质粒标记为P-RNAi(图1B)。首先把RACK1过表达和RACK1RNAi质粒导入根癌农杆菌LBA4404中,然后采用农杆菌介导转化方法[11]导入到羽衣甘蓝中。T0代种子种在含有50 mg/L潮霉素MS(Murashige和Skoog,1962)培养基中进行发芽,对小苗进行PCR和southern blot检测,引物见表1,方法依照文献[12]进行。
1.4 实时PCR检测
利用RNA试剂盒提取总RNA。 DNaseⅠ处理后逆转录成cDNA。利用qRT-PCR技术(7500 ABI)与iTaqTMUniversal SYBR R Green Supermix (Bio-Rad)测量每个基因的转录水平。在对数生长期内,基因表达使用管家基因Boactin(AF044573)作为内参进行定量测定。每个实验进行3个生物复制。qRT-PCR的引物序列如表1所示。

图1 植物表达载体构建模式Fig.1 Pattern of plant expression vector construction
1.5 病原体的胁迫实验
室温控制在25~28 ℃,采用自然日光,相对湿度为30 %~60 %,把T2转基因羽衣甘蓝的种子种植在陶盆蛭石中,生长直到8~10片叶。
在28 ℃的黑暗环境下把霜霉病菌培养物放在18 g/L葡萄糖的OA(Oatmeal agar)培养基上生长10 d,然后转移到20 ℃,12 h光照/12 h暗的环境下生长3 d。用无菌蒸馏水进行水培产生分生孢子悬浮液,用显微镜载玻片刮去表面驱除孢子然后用纱布过滤。浓度最后达到0.1 %时加入吐温20。把分生孢子悬浮液均匀接种在叶片表面上,每个叶片接种2个点。在23 ℃的潮湿的条件下(90 %的相对湿度)、12 h/d光照的生长,温室中进行孵化。接种后2周拍摄疾病区域照片。坏死和褪绿的损害总尺寸用CAD软件测量病变区的大小。每株植物测定3个叶片,6个生物重复。H2O2测定使用BBoxiProbeTM过氧化氢检测试剂盒,具体方法参考BBoxi公司说明书。
2 结果与分析
2.1 转基因植株的获得与检测
RACK1基因与载体CaMV35S-pBIACAM1301重组,获得CaMV35S-pBIACAM1301-RACK1基因表达载体。酶切鉴定确认后导入农杆菌LBA4404菌株中,利用农杆菌介导法转入羽衣甘蓝中。经过 2~3 周分化培养,当有抗性芽再生时,在苗长至0.5~1.0 cm 时转入生根培养基中生根,共获得再生转基因植株27个株系。
用载体HPT基因的特异引物对转基因羽衣甘蓝进行PCR检测,共有8株扩增出预期大小(660 bp)的片段,野生型(wildtype,WT)没有扩增出该片段(图2A),初步证明RACK1基因基因已成功地转入羽衣甘蓝。对8个阳性T0 代转基因羽衣甘蓝,提取DNA,经NcoI和EcorI酶解后,利用HPT基因的特异引物进行southern blot分析,结果发现在转基因羽衣甘蓝基因中都有一个单拷贝(图2B),证明RACK1基因转入羽衣甘蓝中。对8个阳性转基因羽衣甘蓝总RNA进行反转录后进行定量PCR检测。结果发现RACK1基因在转基因羽衣甘蓝中都有一定量的表达(数据未显示)。其中,O13, O19 和 O24 的表达量较高,其他的表达量相对较低(图2C);而在RNAi的BoRACK1表达仍然能被检测(图2C),结果表明, O13,O19 和 O24这些转基因植物显示在植物控制的幼苗期,RACK1表达较高,但 RNAi 载体却没有抑制表达。因此,笔者研究了表达BoRACK1转基因植物BoRACK1基因是否也参与了抗病性。
2.2 羽衣甘蓝的BoRACK1过表达抗病性分析
过表达BoRACK1的T2纯合株系用于接种霜霉病。该疾病症状在植物叶子上发展很快,如图3A所示。侵染14 d后测定叶面感染面积。观察退绿、坏死病变的大小和病变的扩张速度来评价羽衣甘蓝的抗逆能力。实验用(O13,O19和O24)3个株系进行6个独立的实验。3 d后,在O13,O19和O24 3个过表达株系上病变开始出现并孵化,而野生型植株的病变也相应开始从接种部位向四周扩大。与野生型(对照)相比,转基因植株表现出的病害症状显著减少。褪绿和坏死病变的大小与野生型有显着差异(图3A)。统计分析表明,在所有3个转基因株系的病斑面积与对照相比极显著减少(P<0.01,图3B),由此可以看出,BoRACK1过表达增强羽衣甘蓝抗叶枯病的病原菌。

A:PCR;B.Southern blotting; C.qRT-PCR图2 转基因植株分子检测Fig.2 Molecular assaying methods for transgenic plants

A.各基因型接种2周后感染菌斑面积;B.各基因型菌斑面积平均值。**表示与野生型相比有极显著差异(P<0.01),下同图3 不同基因型羽衣甘蓝对霜霉菌抗性的影响Fig.3 Effect of BoRACK1 overexpression on disease-resistance of B. oleracea
2.3 羽衣甘蓝的BoRACK1过表达对H2O2的影响
当一个病原体的攻击植物时,植物的先天免疫性显示其固有抗病性如产生活性氧物种(ROS)和改变细胞壁的组成的植保素及诱导病程相关基因的表达 。已经证明ROS是细胞信号转导和细胞循环的信使,并且在植物防御病原菌感染中起关键作用。测试羽衣甘蓝转基因植物对感染的反应。BoRACK1过表达的植物叶片比非转基因羽衣甘蓝植物接种1 d后,显着提高的过氧化氢的生产能力(图4)。结果表明,BoRACK1基因与羽衣甘蓝的ROS生产相关。
2.4 BoRACK1调控PR基因的表达
相关致病蛋白(PR)是由致病性感染和相关非生物胁迫诱导的一组异质性蛋白。在各种刺激包括病原体攻击和脱水胁迫条件下观察到PR基因的诱导。在转基因水稻和玉米的过表达RACK1基因中已观察到PR基因的表达显著增加。 这些数据表明,转基因植物在基因表达上可能会改变它们对生物胁迫的反应。PR-1蛋白参与了水杨酸(SA)的主动防御反应,这个反应具有抗真菌活性能力,并在分子水平抗御一定数量的植物病原真菌。PRB-1蛋白和PR1具有类似的功能[13]。为了确定转基因植物的抗病性机理,分别从野生型和转基因株O13,O19和O24叶片(接种后3 d)提取总RNA。实时荧光定量PCR分析表明, O13,O19和O24株系的PR-1和PRB-1表达量比野生型高2.5~4倍(图5A,B)。这些结果表明,BoRACK1过表达激活致病相关基因在转基因羽衣甘蓝的转录,从而提高羽衣甘蓝植株的抗感染能力。

图4 不同基因型接种霜霉病后对H2O2的影响Fig.4 Effect of leaves after infection with P. brassicae on H2O2
3 讨 论
RACK1是作为支架蛋白发挥多种作用,它是WD-40重复蛋白家族的成员之一[14]。BoRACK1是从羽衣甘蓝中分离出来的一种蛋白质,其编码有7个WD重复序列,包括典型的GH和WD二肽[15]。氨基酸序列比较表明,BoRACK1与水稻RACK1、拟南芥RACK1相似[15]。作为一种多功能支架蛋白,RACK1与不同的信号转导途径相关[16],它能与膜受体和转录因子结合[17]。此外,作为核糖体结合蛋白,RACK1对蛋白质翻译有也影响[17]。这些过程不是独立的;它们形成了一个三维网络来调节生物体中的一些中心生命过程。
本文利用农杆菌侵染羽衣甘蓝愈伤组织获得RACK1过表达的转基因株系,观察发现RACK1过表达的转基因羽衣甘蓝与野生型羽衣甘蓝无明显的差异。PCR与southern blot检测分析表明,RACK1基因已经插入到羽衣甘蓝植物基因组中。同时对RACK1过表达转基因羽衣甘蓝进行抗病实验,接种霜霉病菌验证并计算羽衣甘蓝叶片菌落数的发病情况与菌斑大小,结果发现转基因与对照植株有较明显的差异,从而确定RACK1转基因羽衣甘蓝对霜霉病具有很好的抵抗作用,其抗病明显优于野生型羽衣甘蓝,说明过表达RACK1能提高羽衣甘蓝的抗病性(图3)。
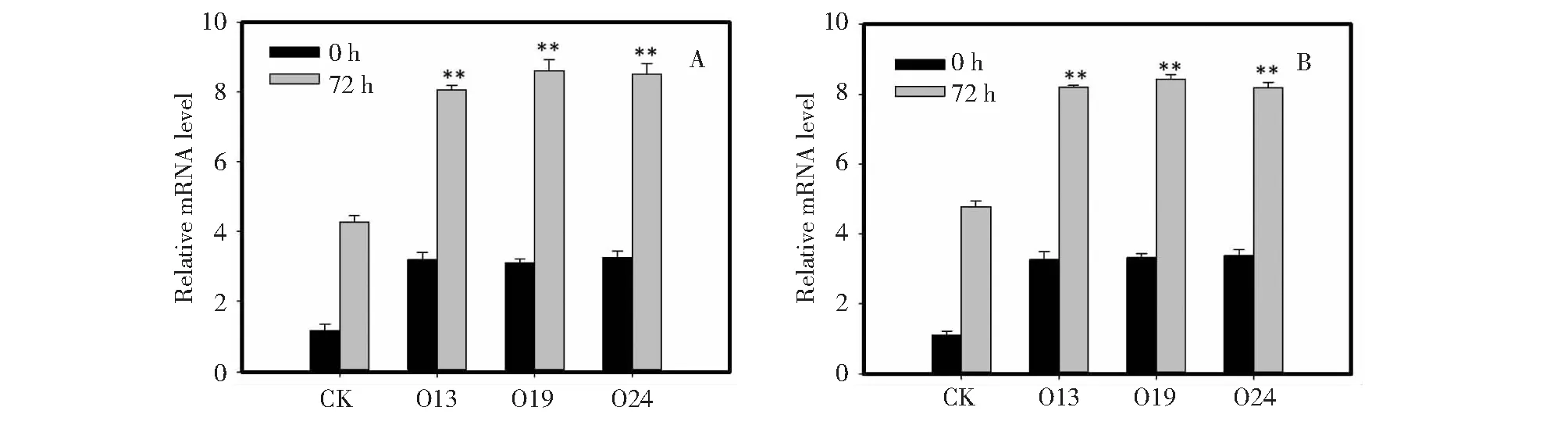
图5 各基因型PRs表达量的变化Fig.5 Transcript levels of PRs in different genotypes
在这项研究中,发现BoRACK1调节ROS的产生。ROS主要由O2-和H2O2组成,是调节各种逆境耐受的重要信号转导分子[18]。将ROS调节到适当水平是至关重要的,因为它们过度积累会造成损害。本研究发现,在生物胁迫后过表达BoRACK1增强ROS积累(图4)。 表明BoRACK1有助于植物抗病性可能是通过调节细胞内ROS水平和参与ROS信号而实现的。ROS信号是植物对生物胁迫适应反应的一个组成部分,在胁迫下保护细胞免受ROS升高的伤害。
一些研究表明,RACK1基因的过量表达提高了转基因植物对环境胁迫响应的能力[5-6]。植物先天免疫研究发现NB-LRR类型R类蛋白易位到细胞核并使其产生免疫功能[19-21]。因此,存在于质膜外围初始免疫复合物的某些成分移向细胞核是有可能的。在这方面,RACK1可能是一个应激蛋白,它在动物细胞中的各种细胞内(包括质膜、细胞核和内质网)起作用,能与细胞表面受体、蛋白激酶、转录因子和转录相关蛋白交互作用[22]。为了进一步研究RACK1基因过表达的转基因植株抗病性的机理,本研究在病原菌胁迫下,对相关病程基因的表达量进行测试,PR-1和PRB-1表达量比野生型高2.5~4倍(图5A,B)。本结果说明BoRACK1过表达激活致病相关基因在转基因羽衣甘蓝的转录,能提高羽衣甘蓝植株的抗感染能力。
4 结 论
在植物免疫反应中RACK1过表达对霜霉菌有明显的抗性,它可能是通过提高过氧化氢的产生及提高相关抗性基因的表达实现的。有关RACK1在抗病性的机理也将是未来研究的主题。
