从肿瘤微环境正常化探讨活血化瘀法及除痰散结法在肿瘤治疗中的机制
2019-07-12唐振豪兰聪颖林丽珠
唐振豪, 兰聪颖, 林丽珠
(1.广州中医药大学,广东广州 510405;2.广州中医药大学第一附属医院,广东广州 510405)
恶性肿瘤(以下简称肿瘤)属基因疾病或细胞疾病,是一种由多种细胞类型和成分组成的组织、器官疾病。在显微镜下,肿瘤可分为肿瘤实质和肿瘤间质,前者是肿瘤的主体,由肿瘤细胞构成,后者则由间质细胞(包括血管内皮细胞、周细胞、成纤维细胞、成肌纤维细胞、各种免疫细胞等)、细胞外基质以及贯穿其中的血管构成。两者的关系可以比作:前者是“种子”,后者是“土壤”[1],即肿瘤微环境(tumor microenvironment);“种子”可以通过分泌多种细胞因子塑造周围微环境,以使其成为适合自身需求的“土壤”,而“土壤”反过来通过诱导血管生成、促进免疫逃逸及孕育肿瘤干细胞等进一步促进“种子”的发生、发展、侵袭、转移和复发[2]。本研究通过复习相关文献,总结出肿瘤微环境的四大特性及其对肿瘤发生发展的影响,以及乏氧特性与肿瘤血管的相互作用,进而分析肿瘤微环境正常化成为一种常规的肿瘤治疗策略的重要性及其可能的机制。同时,尝试从肿瘤微环境正常化的角度,运用“取象比类”的认识方式,来探讨中医药活血化瘀法及除痰散结法在肿瘤治疗中的机制。
1 肿瘤微环境的特性及其对肿瘤发生发展的影响
1.1 乏氧 乏氧(hypoxia)指的是一种特定区域内氧气浓度有所下降的状态,介于常氧(normoxia)与缺氧(anoxia)之间。1955年,Thomlinson和Gray等在人类肺癌内发现,瘤体内部距离血管180 μm以外的区域中存在着大量的坏死细胞,从而推测这是由于缺氧所致[3]。1997年,Helmlinger G等[4]通过直接测定瘤体内部血管周围的氧气浓度梯度,发现距离血管越远(至少>70 μm)的区域,其氧气浓度越低。由此推断瘤体内部距离血管大约70~180 μm之间的区域处于乏氧,而这种形式的乏氧被称为“慢性乏氧”或“弥散限制性乏氧”。另外,众多研究表明瘤体内部某些区域的血液灌注呈周期性,使得这些区域出现间歇性乏氧[5-7],而这种形式的乏氧则被称为“急性乏氧”或“灌流限制性乏氧”。
乏氧一方面通过稳定乏氧诱导因子-1α(hypoxia-induced factors-1α,HIF-1α)的存在,从而持续地诱导肿瘤血管生成,这不仅为肿瘤的发生发展提供充足的养分,还为肿瘤细胞的远处转移提供必要的血运道路;另一方面,乏氧维持肿瘤干细胞的自我更新及增殖活性,加剧肿瘤细胞基因组的不稳定性,造成肿瘤细胞对放疗及化疗的抵抗,并抑制免疫细胞的抗肿瘤作用[8-9]。
1.2 高乳酸浓度及低pH值 1924年,Warburg发现即使在常氧下,肿瘤细胞也偏好糖酵解为自身供能[10],更不论在乏氧或缺氧状态下。由于1分子葡萄糖通过糖酵解产生的三磷酸腺苷(ATP)对比于通过有氧呼吸产生的低18倍,而肿瘤细胞通过糖酵解合成的ATP可占到总量的50%[11],因此肿瘤细胞必须快速地、大量地吸收并消耗葡萄糖方能确保充足的ATP来源,同时将随之产生的乳酸运输至细胞外,使得肿瘤微环境因高乳酸浓度而酸化,而细胞内则保持中性或偏碱性[12]。这一现象被后人命名为Warburg效应,但其出现的原理一直不得而知。最近的研究综述表明,Warburg效应之所以存在,正是因为以往一直被冠以“副产物”的高浓度乳酸(且强调的是乳酸根离子,而非H+),其对于肿瘤的发生发展是必不可少的[13]。肿瘤细胞上调了糖酵解相关通路[14-15],从而使得氧气浓度(无论常氧、乏氧抑或缺氧)对肿瘤细胞的糖代谢不再重要。此外,乏氧微环境下的肿瘤细胞通过稳定HIF-1α的存在,可以持续地上调碳酸酐酶Ⅸ(carbonic anhydraseⅨ,CAⅨ)的表达[16],从而催化二氧化碳和水合成碳酸。乳酸与碳酸均可水解出H+,共同降低肿瘤微环境的pH值。
肿瘤微环境中高浓度的乳酸不仅直接成为肿瘤细胞自给自足的营养物质,还作为一种信号分子(称为“lactormone”)在肿瘤组织中的细胞之间进行信号转导,从而诱导肿瘤血管生成,增强肿瘤细胞的迁移能力,促进肿瘤细胞的免疫逃逸[13]。同时,它与碳酸所致的肿瘤微环境低pH值可共同增强肿瘤细胞的侵袭能力,并降低肿瘤细胞对化疗的敏感性[17-18]。
1.3 高组织间隙液压 正常微环境的组织间隙液压(interstitial fluid pressure,IFP)一般在 0 mmHg[19],而肿瘤微环境的IFP则显著升高,如宫颈癌的IFP在10~30 mmHg、皮肤黑色素瘤的IFP在39~45 mmHg,并且呈现出往瘤体内部缓慢升高、往瘤体边缘快速下降的趋势[20]。研究表明,肿瘤脉管系统可以通过3种机制来造成肿瘤微环境的高IFP:(1)尽管瘤体边缘存在着有利于肿瘤细胞淋巴转移的功能性淋巴管,但是瘤体内部淋巴标志染色阳性的淋巴管结构被证实是缺乏功能的[21-22],从而导致瘤体内部渗漏出来的血浆无法被重吸收而潴留于组织间隙中。(2)异常的肿瘤血管因管壁间隙大和缺乏基底膜而通透性升高[23],导致血浆容易渗出到组织间隙中。(3)异常的肿瘤血管因形态膨大及缺乏平滑肌的支持而降低对外周动脉血流的阻力[23],加之缺乏正常血管应有的层次,其微动脉、微静脉和毛细血管很难相互区分,从而使得整个瘤体的血管内静水压升高[24],导致血浆过多地漏出到组织间隙中。
肿瘤微环境的IFP虽然越往瘤体内部其值越高,但升高趋势缓慢,因此在内部几乎呈一致性升高,造成内部相邻区域之间的IFP梯度较小,从而减慢肿瘤组织间隙液体的对流速度,最终降低药物在肿瘤组织间隙中的运输效率[25]。另外,IFP在瘤体内部显著升高,而在瘤体边缘则急剧下降[20],导致这两区域之间的IFP梯度较大,从而使得组织间隙液体从瘤体内部渗出至瘤体边缘,同时携带着抗肿瘤药物,这不利于肿瘤治疗,且可造成瘤体周围正常组织的损伤。
1.4 高固体压力 单靠肿瘤细胞之间的相互作用不足以形成肿瘤,它们还需从瘤体周围正常组织甚至血液循环中招募并刺激间质细胞的增殖与分化,而后者局部浸润后通过多种信号转导反过来促进前者的存活和增殖[2]。例如,肿瘤细胞分泌的血小板衍生生长因子(platelet-derived growth factor,PDGF)和 转 化 生 长 因 子 β(transforming growth factor-β,TGF-β)可以招募成纤维细胞并刺激其增殖、分化及活化[26-27],后者则通过分泌血管内皮生长因子(vascular endothelial growth factor,VEGF)和间质衍生因子 1(stroma-derived factor-1,SDF-1)诱导血管生成[28],从而为前者的多种生物学行为提供养分支持,两者相互作用、相互促进而造成恶性循环。正是由于这种恶性循环,持续受刺激的成纤维细胞除了分泌生长因子,还会大量地合成胶原蛋白、纤维连接蛋白、蛋白聚糖和糖胺聚糖等,并分泌至细胞外,造成细胞外基质的广泛沉积[29-30],从而与镶嵌其中的细胞一同构成肿瘤并以硬块的形式存在。日益增多的肿瘤细胞以及间质细胞与日益沉积的细胞外基质一同造成肿瘤微环境中固体压力的日益升高[31]。
高固体压力一方面会挤压瘤体内部血管,降低血液流速,造成局部区域灌注减少,进而加剧乏氧;另一方面也会压迫瘤体内部淋巴管,加重其重吸收功能的缺失,导致组织间隙液体的进一步潴留,从而促进IFP的升高[32]。另外,高固体压力的形成反过来会压缩具有显著黏性和弹性的细胞外基质,使其成为一个致密、曲折的网络,并且越靠近瘤体中心,其密度越大[33-34],越容易妨碍药物在肿瘤组织间隙中的运输。最后,高固体压力与高IFP共同构成肿瘤微环境中的高应力,通过挤压肿瘤细胞和间质细胞,改变它们的表观遗传,增强肿瘤细胞的侵袭表型,也影响间质细胞的功能[35-37]。
2 乏氧特性与肿瘤血管的相互作用
倘若没有独立的血供,单纯靠从周围正常组织弥散过来的氧气和其他养分,肿瘤的体积将很难超过1 mm3;因肿瘤体积一旦达到1 mm3后,瘤体内部就会出现弥散限制性乏氧和养分缺乏,妨碍了肿瘤的进一步增大[38]。然而,正是因为乏氧的存在,通过稳定HIF-1α的存在来刺激肿瘤细胞和成纤维细胞持续地旁分泌VEGF、PDGF和SDF-1等,打破了促血管和抗血管生成因子之间的平衡,从而打开了“血管生成开关”(angiogenic switch),肿瘤因而拥有了独自的血管供养,体积得以越长越大,但同时肿瘤微环境的乏氧特性也因而越发明显[39]。这主要与肿瘤血管在结构上和功能上均与正常血管有着很大的差异有关[23]。具体而言,因为肿瘤血管形态扩张,部分呈囊腔状,行走弯曲,分布不均,分支过多且不规则,分支之间连接紊乱,加之高固体压力的挤压效应,故导致瘤体内部出现机械性血运受阻,血流缓慢甚至闭塞,以及血液灌注表现为时空异质性。又因为肿瘤血管管壁的内皮细胞形态畸形且相互连接间隙过大、基底膜厚薄不一及周细胞分布松散甚至缺如,故可致肿瘤血管自身的通透性升高。正是肿瘤血管的高通透性,使得肿瘤微环境的高IFP特性与肿瘤血管内的高静水压之间可以形成透壁传输作用,从而直接导致瘤体内部的血流停滞(这不同于机械性血运受阻)[40]。
简而言之,乏氧诱导异常促进了肿瘤血管的生成,反过来,异常的肿瘤血管造成机械性血运受阻,血流缓慢甚至闭塞,血液灌注的时空异质性以及血流停滞,加剧了弥散限制性和灌注限制性乏氧。二者相互影响、相互作用,形成恶性循环。
3 肿瘤微环境正常化的现代治疗策略及其机制
根据前述可知,肿瘤微环境的四大特性不仅从多个环节促进了肿瘤的发生发展,而且降低了多种肿瘤治疗方法的疗效。因此,肿瘤微环境正常化应成为一种常规的肿瘤治疗策略。肿瘤微环境正常化不仅可以阻断肿瘤发生发展过程中的多个核心环节,而且可以通过促进药物的运输及减弱对放疗及化疗的抗性从而提高现有肿瘤治疗方法的疗效。肿瘤微环境四大特性的形成主要由于肿瘤血管的异常、细胞外基质的广泛沉积以及肿瘤细胞与间质细胞的日益增多,因而肿瘤微环境正常化的实现可以通过肿瘤血管正常化、减少细胞外基质以及瘤体内部细胞数量。肿瘤微环境正常化的现代治疗策略及机制见图1。
3.1 肿瘤血管正常化 1971年,Folkman J提出了封闭肿瘤的血管生成过程可阻止肿瘤生长及转移的假设[41],随之研发出来的抗肿瘤血管生成药物的治疗目的是通过抑制肿瘤的血管新生以及摧毁已存在的肿瘤血管,导致肿瘤处于无血管供养的状态,最终实现“饿死”肿瘤细胞。直至2004年,美国食品药品监督管理局(FDA)才正式批准第1个抗肿瘤血管生成药物,即能特异性中和VEGF的贝伐珠单抗,可应用于转移性结直肠癌患者,但必须联合以5-氟尿嘧啶为基础的化疗方案才能为患者带来生存获益[42]。由此也引出了一个悖论:以减少肿瘤血管数量为初衷的抗肿瘤血管生成药物在单独应用时疗效不甚明显[43],但联合化疗时则能增强它们原有的疗效[42,44]。对此,Jain R K提出了“肿瘤血管正常化”的假设,即适当地应用抗肿瘤血管生成药物,重新在促血管和抗血管生成因子之间建立平衡,从而“修剪掉”未成熟的新生血管并保留结构较为成熟的血管,实现在特定的时间窗内改善肿瘤血管的运输功能[39,45-46],最终提高抗肿瘤药物在瘤体内部的浓度。同时,肿瘤血管正常化还能提高氧气浓度、降低乳酸和碳酸浓度以及IFP。
值得注意的是,肿瘤血管的异常不仅是因为血管自身结构(包括形态、分支、分布、管壁)的异常,还因为受到高固体压力的挤压。由于那些得以保留下来的且结构较成熟的肿瘤血管仍会受到高固体压力的挤压[32],故真正意义上的肿瘤血管正常化离不开降低固体压力[47]。
3.2 减少细胞外基质以及瘤体内部细胞数量 1项回顾性临床研究发现,相对于吉西他滨单药化疗,联合使用吉西他滨和肾素—血管紧张素系统拮抗剂,可使晚期胰腺导管腺癌患者的总生存期延长大约6个月[48]。随后的动物实验证实,TGF-β是促进成纤维细胞合成胶原蛋白的关键因子之一,而氯沙坦不仅可以抑制TGF-β的活性从而减少胶原蛋白的合成,还可促进胶原蛋白的降解,最终有利于纳米分子药物进入瘤体内部[49]。又因为细胞外基质的广泛沉积以及肿瘤细胞与间质细胞的日益增多形成了肿瘤微环境的高固体压力,故要降低固体压力,除了应用诸如氯沙坦的药物以减少细胞外基质外,还可以通过现有的肿瘤治疗方法来减少瘤体内部细胞数量。固体压力的下降不仅提高了药物在肿瘤组织间隙的运输效率,而且可减轻对肿瘤血管的挤压效应,从而有利于肿瘤血管正常化。
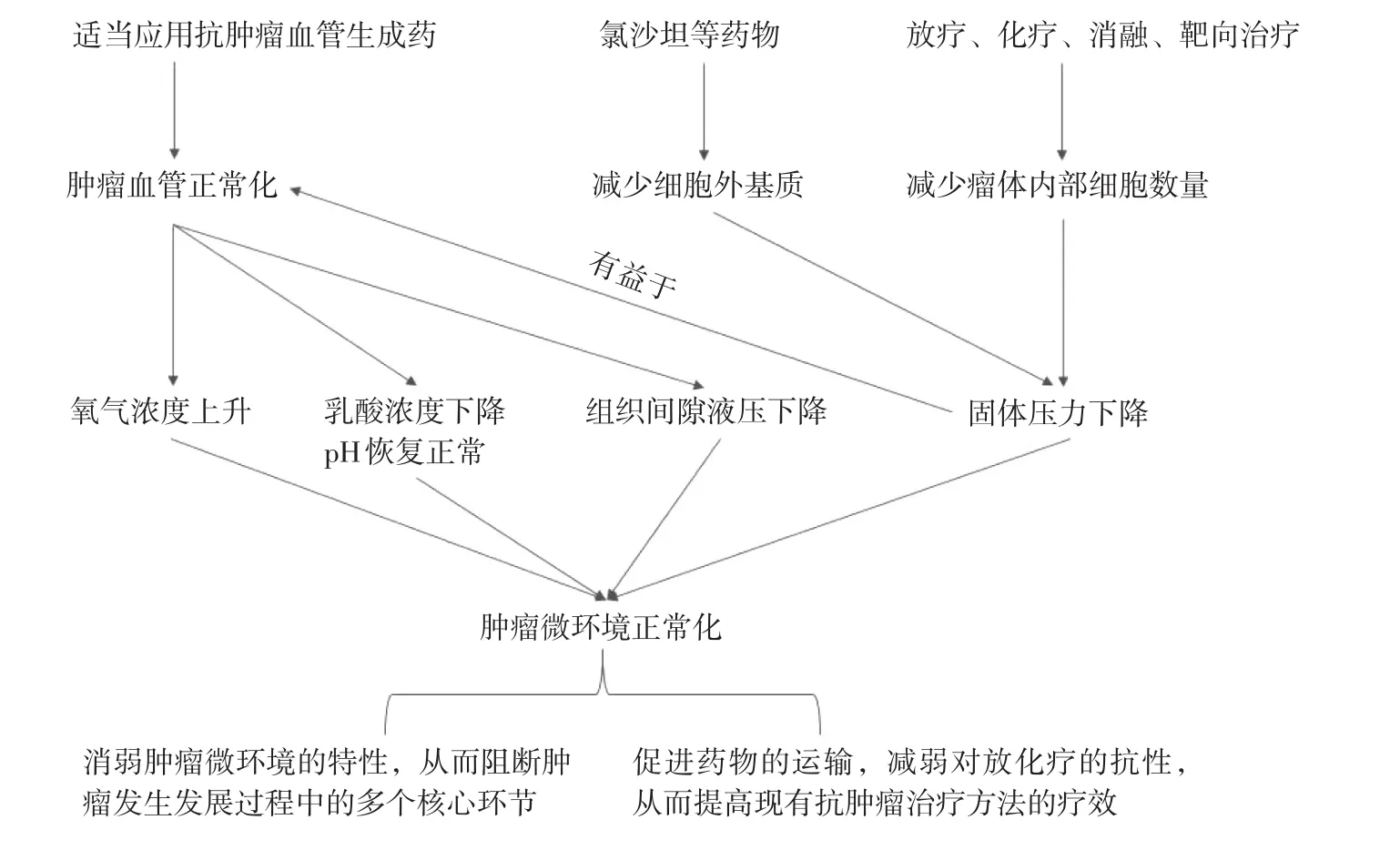
图1 肿瘤微环境正常化的现代治疗策略及机制Figure 1 Modern therapeutic strategy and mechanism for the normalization of tumor microenvironment
4 从肿瘤微环境正常化探讨中医药治疗肿瘤的疗法
作为疗效确切且相对低价的疗法,中医药在我国肿瘤治疗中占有重要的地位。众多药理实验及临床研究表明,无论是单一的中药提取物,还是辨证论治指导下的中药复方,均具有间接增效减毒或直接控制肿瘤的作用。因此,中西医结合治疗肿瘤已被我国临床实践普遍采用。尽管某些中药单体确实具有令人信服的抗击肿瘤细胞作用,但是中医药治疗肿瘤的基本治法的机制仍未得到明确阐释。
中医认为,肿瘤的基本病机是本虚标实,其形成的主要病机为“毒聚、瘀滞、痰凝”,即肿瘤是在人体脏腑失调、精气亏虚的状态下,由于热毒内蕴、气滞血瘀及痰湿凝聚而形成,因此其基本治法不离扶正培本、清热解毒、活血化瘀及除痰散结。研究提示中医药在肿瘤治疗中的关键靶点可能在肿瘤微环境[50-52]。本研究以活血化瘀法及除痰散结法为例,通过“取象比类”的认识方式,首先将肿瘤常见的血瘀证和痰证与肿瘤微环境建立联系,探讨活血化瘀法及除痰散结法在肿瘤治疗中的肿瘤微环境正常化的机制。
4.1 活血化瘀法在肿瘤治疗中的机制 《圣济总录》提出:“瘤之为义,留滞而不去也,气血流行不失其常,则形体和平,无或余赘,及郁结壅塞,则乘虚投隙,瘤所以生”;《血证论》曰:“瘀血在经络脏腑之间,则结为癥瘕,瘕者或聚或散,气为血滞,则聚而成形”。由此可知肿瘤具有血瘀证的属性。而瘀血的产生主要是由于血液不循常道,或停滞不行,或离经叛道所致[53]。通过“取象比类”,可认为瘀血产生的3种形式分别可比喻为前文提及的3种情形,即血液在结构异常的肿瘤血管中循行、血液因透壁传输作用而在肿瘤血管中淤滞、血液因肿瘤血管的高通透性而渗漏至肿瘤组织间隙。现代药理实验证明,活血化瘀方药具有多种积极的直接抗肿瘤细胞作用,并被证实具有保护血管内皮细胞、减少肿瘤血管异常生成以及诱导肿瘤良性血管生成等作用[54-57]。基于肿瘤微环境正常化策略,活血化瘀法应用于肿瘤的治疗是由于肿瘤具有血瘀证属性,活血化瘀方药的药理作用可阐明活血化瘀法在肿瘤治疗中的促使肿瘤血管正常化作用的机制。活血化瘀法在肿瘤治疗中的机制的阐释如图2所示。
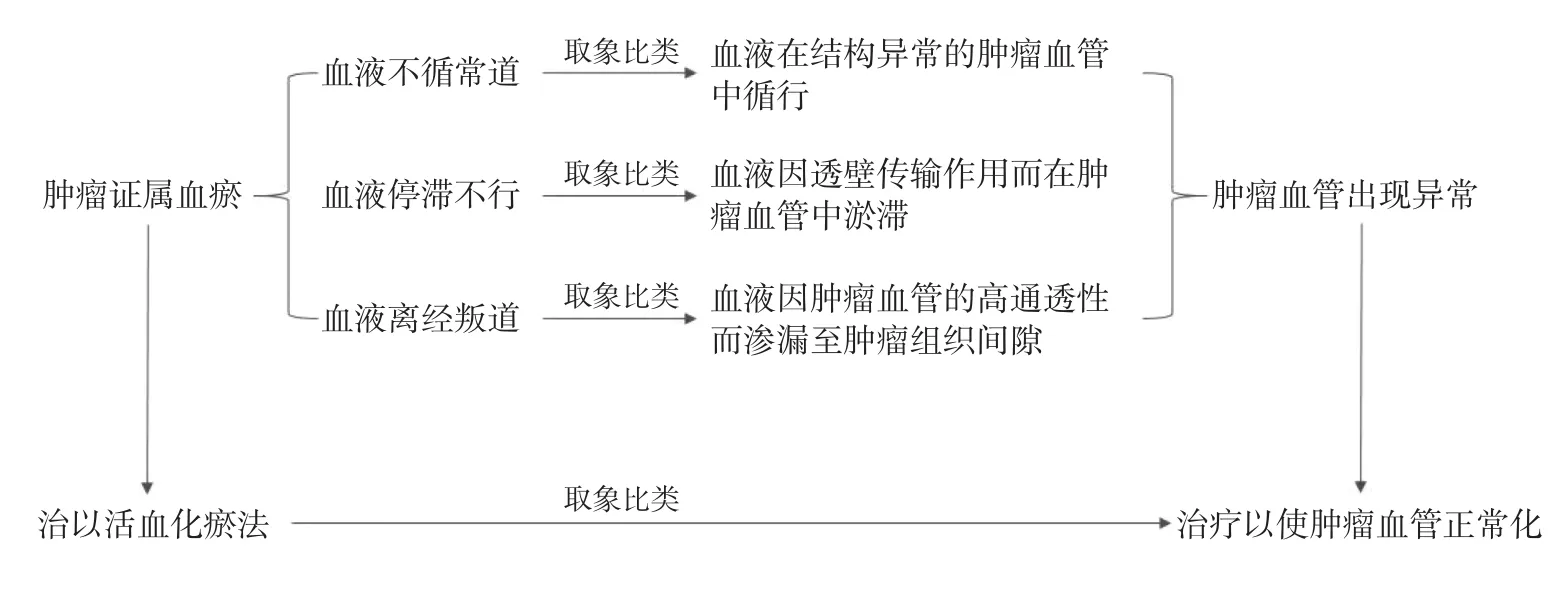
图2 活血化瘀法在肿瘤治疗中的机制Figure 2 The modern mechanism of blood-activating and stasis-removing therapy for the treatment of tumor
4.2 除痰散结法在肿瘤治疗中的机制 肿瘤在局部呈现为有形可征、坚硬不移的肿块,且在疾病进程中不可避免地出现全身广泛转移,这非常符合中医学的痰的黏滞却又流动的特性[58],故中医认为肿瘤具有痰证的属性。正如《疡科心得集》提出:“癌瘤者,非阴阳正气所结肿,乃五脏瘀血,浊气痰滞而成”;《丹溪心法》曰:“凡人身上中下有块者,多是痰”、“痰之为物,随气升降,无处不到”。因而除痰散结法也是肿瘤的基本治法之一[59]。目前不仅有理论研究论证了痰证与肿瘤细胞和肿瘤间质之间的物质代谢失调具有相关性,而且有学者认为对痰证的研究集中于细胞外基质有望解释其本质[60-61],临床研究也证实了黏附蛋白在肿瘤患者中表达升高,而治以除痰散结法后则有所降低[62]。同时,基础研究也证明了除痰散结方药不仅可下调肿瘤组织中多种异质性黏附蛋白的表达[63],抑制肿瘤间质中成纤维细胞的活性,从而抑制细胞外基质的合成[64],还能够降低病灶中促纤维化因子的释放[65]等。基于“取象比类”,可认为肿瘤的痰证属性所具有的黏滞与流动特性,可分别比喻为肿瘤间质中细胞外基质具有显著的黏性和弹性以及参与形成高固体压力而促进肿瘤细胞的侵袭表型。由此得出,除痰散结法可以应用于肿瘤的治疗是由于肿瘤的痰证属性,除痰散结法在肿瘤治疗中的机制可解释为减少细胞外基质。除痰散结法在肿瘤治疗中的机制的阐释如图3所示。
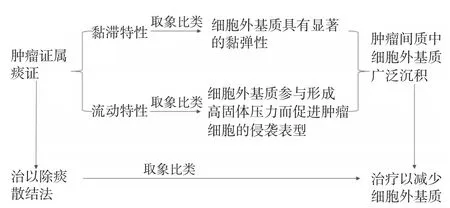
图3 除痰散结法在肿瘤治疗中的机制Figure 3 The modern mechanism of phlegm-removing and mass-dissipating therapy for the treatment of tumor
综上,肿瘤微环境之所以能够作为肿瘤细胞赖以存活、生长及增殖的环境,其四大特性“功不可没”,而其特性的形成主要与异常的肿瘤血管与广泛沉积的细胞外基质有关。因此,有必要将促进肿瘤微环境正常化作为一种常规的肿瘤治疗策略,以指导肿瘤血管正常化与减少细胞外基质等具体治疗方法的施行。如此方可有效地阻断肿瘤微环境与肿瘤细胞之间的相互作用,且能与现有的肿瘤治疗方法产生协同效应。结合中医药治疗疾病所秉承的整体观念,以及其治疗肿瘤的独特疗效,认为其疗效机制的关键靶点可能是肿瘤微环境,而非局限于肿瘤细胞;活血化瘀法及除痰散结法治疗肿瘤的机制可能与促进肿瘤血管正常化及减少细胞外基质有关,从而实现肿瘤微环境正常化。
