新狼毒素A对人肝癌Hep G2细胞糖酵解的影响
2019-07-11丁杨芳任博雪赵微李德芳陈小宇郑秋生
丁杨芳,任博雪,赵微,李德芳,陈小宇,郑秋生,*
(1石河子大学药学院/新疆植物药资源利用教育部重点实验室,新疆 石河子832002 2滨州医学院中西医结合学院,山东 青岛56000)
狼毒最早出现在《神农本草经》一书。中医认为狼毒具有有逐水祛痰、破积杀虫的功效,主要治疗水肿腹胀,痰、食、虫积、疥癣等[1]。已有的研究表明狼毒中有效成分如狼毒素,狼毒素B和新狼毒素C等都具有明显的抗肿瘤活性[2-5],除此之外,也有研究发现狼毒中的有效成分新狼毒素A有抑制细胞增殖的作用,且这种作用是通过诱导细胞凋亡来实现的[6]。因此,基于以上文献报道,本研究探讨新狼毒素A对Hep G2细胞的增殖抑制作用,以及对糖酵解的影响。
肝癌是常见的恶性肿瘤之一,据文献报道,与肝癌死亡相关的人数每年约有25万,其中有45%在中国,我国肝癌的发病率居高不下[7-9]。但是至今没有较好的方法治愈肝癌。目前,手术已经成为治疗肝癌最主要的手段,但是手术治疗是有创治疗且在后期会面临高转移性的难题,除此之外,肝癌对传统的化疗药敏感性很差,并且化疗药物往往具有很大的毒副作用,患者生活质量受到很大的影响[10]。因此,更多的学者将注意力聚焦于天然产物,有望从中寻找出治疗肝癌的有效的药物。
本研究以Hep G2细胞为研究对象,探讨新狼毒素A是否能通过影响细胞糖酵解来抑制人肝癌Hep G2细胞的增殖,进一步探讨其潜在的分子机制,从而为新狼毒素A的药理作用提供基础数据,也为肝癌的治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 细胞株
人肝癌Hep G2从中国科学院上海细胞库购买。
1.1.2 药品及主要试剂
纯度≥98%的新狼毒素A购于(批号:CFS01701)武汉ChemFaces公司;磺基罗丹明B(SRB)购于美国Sigma公司;MEM购于(批号:1791942)Gibco公司;胰蛋白酶(批号:8250024)和DMSO(批号:520C0324)购于北京索莱宝公司;胎牛血清(批号:J30329)购于北京全式金公司;台盼蓝(批号:620C058)购于Sigma公司;三磷酸腺苷(ATP)检测试剂盒(批号:20181227),乳酸(LD)检测试剂盒(批号:20181217),已糖激酶(HK)检测试剂盒(批号:20181229),丙酮酸激酶(PK)检测试剂盒(批号:20181219)和乳酸脱氢酶(LDH)检测试剂盒(批号:20181214)均购于南京建成生物公司;葡萄糖氧化酶法测定试剂盒(GOD)(批号:2018D1GE1010)购于北京普利莱基因技术有限公司。
1.1.3 主要仪器
细胞培养箱(美国Thermo公司,Thermo 3131型);酶标仪(美国Thermo公司,Thermo 3001型);艾柯实验室超纯水机(成都艾柯水处理设备有限公司,Exceed-Ad-60);恒温水浴锅(江苏金坛市医疗仪器厂,HH-S型);Eppendorf 离心机(德国Eppendorf,5424R 型);超声波细胞粉碎仪(SONICS公司,VCX130);倒置显微镜(重庆奥特光学仪器有限公司,BDS200-PH)。
1.2 研究方法
1.2.1 细胞培养与细胞增殖抑制实验
人肝癌Hep G2细胞用MEM培养基(用时加10% FBS和1%双抗)培养,24 h换液,3天消化1次,置于5% CO2,37 ℃的培养箱培养。
使用SRB法检测细胞活力,将Hep G2细胞以1×105个/mL加入到96孔板,每孔100 μL培养24 h,吸出原有培养基,加入含新狼毒素A(0,10,20,40,80 μg/mL)的新鲜培养基,培养48 h后加入50 μL的50%的三氯乙酸在室温静置5 min,然后4 ℃放置1 h,弃去上清液,用超纯水将96孔板洗5遍,甩干后在室温干燥过夜,次日每孔加入100 μL的SRB液(0.4%)并在室温放置20 min,然后吸弃SRB液并用1%的醋酸润洗96孔板5次,在室温干燥过夜。加入150 μL的DMSO,在微量振荡仪上震荡10 min,在570 nm波长处测吸光度,并计算细胞的抑制率。
1.2.2 台盼蓝拒染法观察细胞Hep G2细胞形态及增殖率的影响
将Hep G2细胞以1.5×105个/mL加入到24孔板,每孔1 mL,培养24 h,吸出原培养基,加入含新狼毒素A(0,20,40,80 μg/mL)的培养基,培养48 h,弃上清,用1 mL的PBS洗2遍,加入0.04%的台盼蓝500 μL染色3 min,在倒置显微镜下拍照并计数活细胞与死细胞数,计算死细胞数百分比。
死细胞数(%)=死细胞数/(活细胞数+死细胞数)×100%。
1.2.3 Hep G2细胞中ATP含量的测定
将Hep G2细胞以3×105个/ml加入到6孔板,每孔2 ml,培养24 h,吸出原培养基,加入含新狼毒素A(0,20,40,80 μg/ml)的培养基,培养48 h,弃上清,加入300 μL的温度为50 ℃的热双蒸水,在90-100 ℃的热水浴中匀浆破碎,将细胞悬液沸水浴加热10 min,取出后涡旋混匀1 min,按照ATP试剂盒说明书进行检测并计算:
ATP浓度(μmol/gprot)=(OD测定值-OD对照值)/(OD标准值-OD空白值)×标准品浓度(1×103μmol/L)×样品测试前稀释倍数÷待测样本蛋白浓度(g prot/L)。
1.2.4 Hep G2细胞上清液中葡萄糖含量和乳酸含量的测定
将Hep G2细胞以3×105个/mL加入到6孔板,每孔2 mL培养24 h,次日吸出旧培养基,加入含新狼毒素A的培养基(0,20,40,80 μg/mL)培养48 h,吸取上清液按照乳酸测定试剂盒和葡萄糖氧化酶法测定试剂盒的说明检测并计算含量。
1.2.5 Hep G2细胞中己糖激酶(HK),丙酮酸激酶(PK)和乳酸脱氢酶(LDH)的活性测定
收集处理好的Hep G2细胞,离心弃去上清,在底层细胞加入PBS溶液,利用细胞超声破碎仪在冰上破碎细胞(每次5 s,间隔30 s)制成细胞悬液。按照己糖激酶(HK),丙酮酸激酶(PK)和乳酸脱氢酶(LDH)的检测试剂盒进行检测并计算活性。

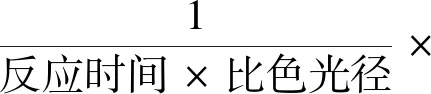
匀浆蛋白浓度(gprot/mL),

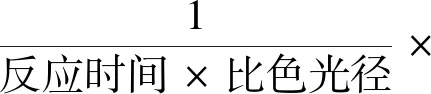
匀浆蛋白浓度(gprot/mL),

标准品浓度(0.2μmol/mL)÷待测样本蛋白浓度(gprot/mL)。
1.2.6 数据处理
采用SPSS 19.0统计软件分析, 使用One-way ANOVA方法分析组间统计学差异。所有实验均重复3遍,结果以平均值±标准差表示,P<0.05表示具有统计学上的显著性差异,P<0.01表示具有统计学上的极显著性差异。
2 结果
2.1 新狼毒素A抑制Hep G2细胞的增殖
如图1所示,在新狼毒素A作用于Hep G2细胞48 h后,细胞生长受到明显抑制,且随着新狼毒素A浓度的增加抑制率逐渐增加,呈现剂量依赖性。48 h的抑制率分别达到了(8.20±2.51)%,(32.66±4.01)%,(42.52±3.51)%和(61.43±2.39)%。
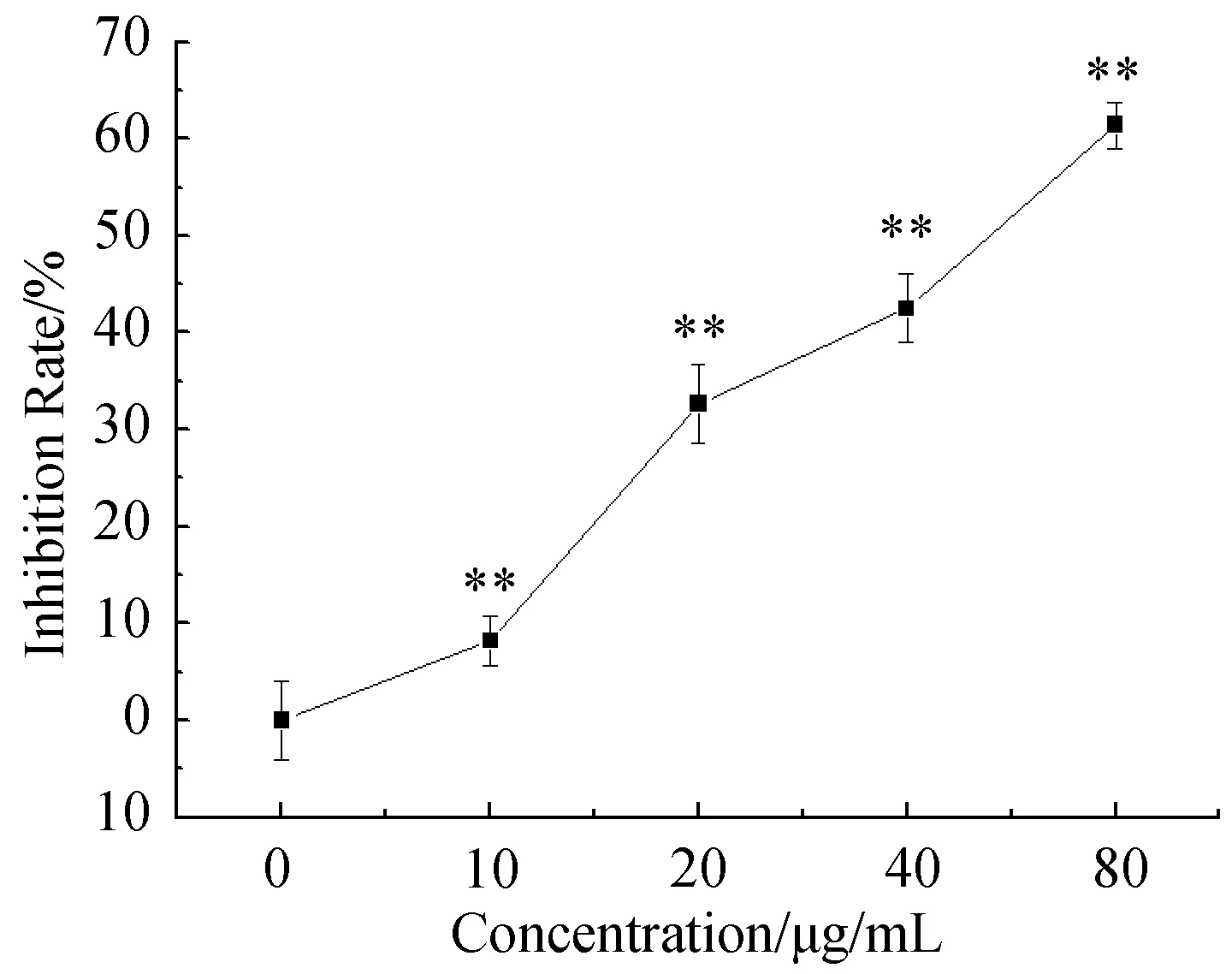
与正常组相比, **P<0.01。Note:**P<0.01图1 新狼毒素A抑制Hep G2细胞的增殖Fig.1 Effect of NCA on proliferation in Hep G2 cells
2.2 新狼毒素A诱导细胞形态的改变并抑制细胞增殖
如图2所示,新狼毒素A刺激HepG2细胞48 h后,正常细胞未被台盼蓝染成蓝色且细胞透亮光泽,而处理组细胞因为膜通透性增大,无法排斥台盼蓝的进入而被染成蓝色,同时细胞的增殖也受到抑制,表明新狼毒素A抑制细胞的增殖。
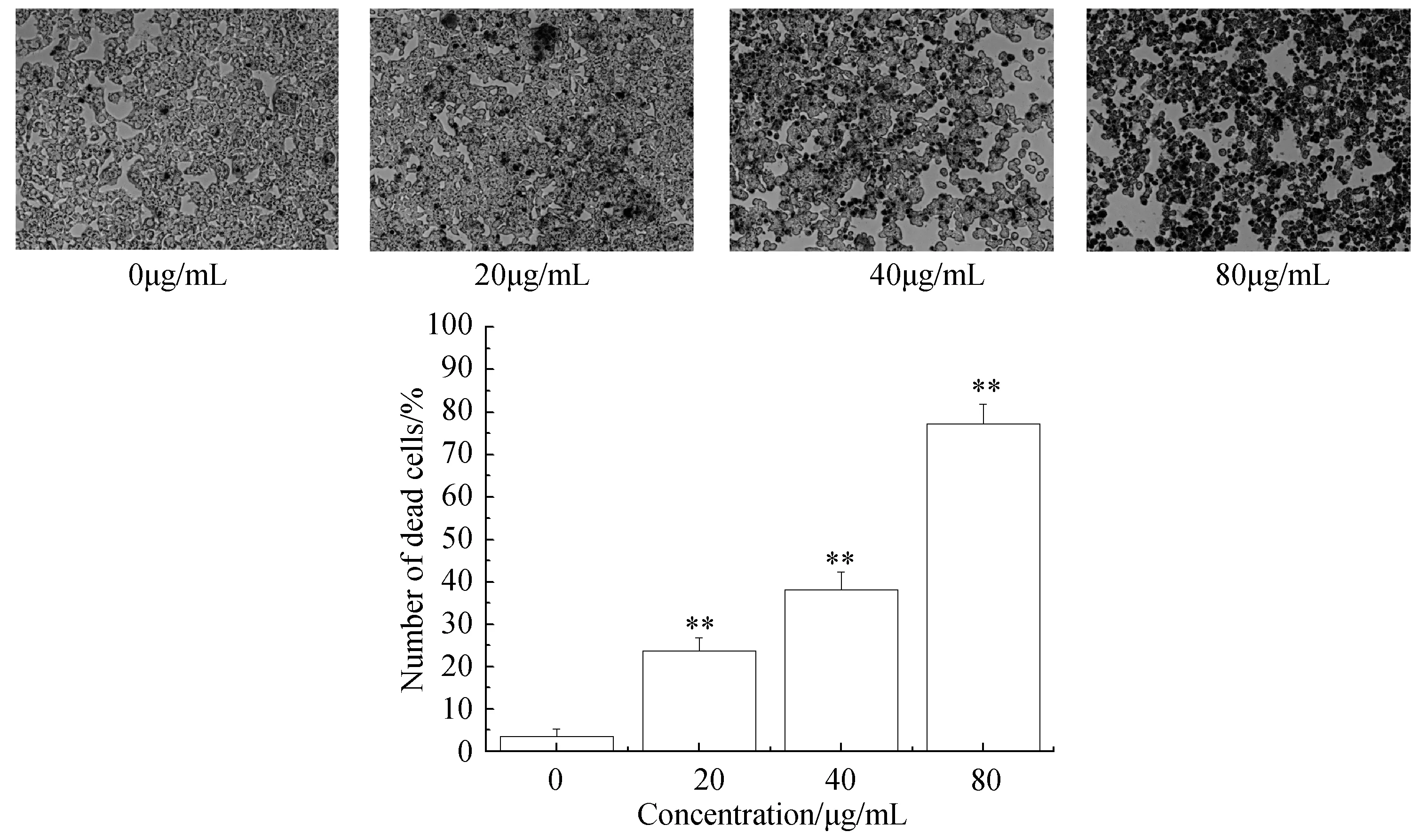
与正常组相比, **P<0.01。Note:**P<0.01图2 新狼毒素A对Hep G2细胞增殖的影响(×100)Fig.2 Effect of NCA on proliferation in Hep G2 cells(×100)
2.3 新狼毒素A抑制Hep G2细胞ATP的生成
如图3所示,新狼毒素A作用于Hep G2细胞48 h后,细胞中的ATP水平受到抑制,且随着新狼毒素A浓度的增大ATP水平逐渐降低,表明新狼毒素A降低了细胞ATP的水平。

与正常组相比, **P<0.01。Note:**P<0.01图3 新狼毒素A对Hep G2细胞ATP水平的影响Fig.3 Effect of Neochamaejasmin A on ATP levels in Hep G2 cells
2.4 新狼毒素A对葡萄糖摄取量的影响
如图4所示,新狼毒素A作用于Hep G2细胞48 h后,细胞培养液中葡萄糖含量随着新狼毒素A浓度的增大逐渐增多,细胞摄取葡萄糖的能力减弱,各组上清液中葡萄糖含量分别为(0.14±0.015),(0.26±0.054),(0.43±0.025)和(0.77±0.036) mmol/L:结果表明新狼毒素能显著抑制细胞对葡萄糖的摄取。
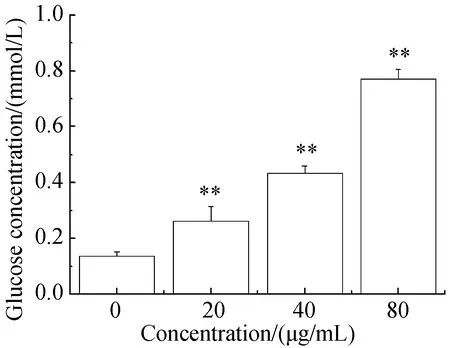
与正常组相比, **P<0.01。Note:**P<0.01图4 新狼毒素A对Hep G2细胞上清液中葡萄糖摄取的影响Fig.4 Effect of Neochamaejasmin A on Glucose Uptake in supernatant of Hep G2 cells
2.5 新狼毒素A对细胞培养液中乳酸含量的影响
如图5所示,新狼毒素A作用于Hep G2细胞48 h后,细胞培养液中的乳酸含量随着新狼毒素A浓度的增大而减小,各组乳酸含量分别为(3.42±0.023),(3.09±0.12),(2.40±0.10)和(1.78±0.13) mmol/L:结果表明新狼毒素A能抑制细胞乳酸的生成。
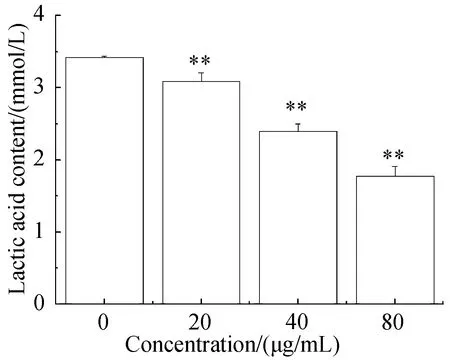
与正常组相比, **P<0.01。Note:**P<0.01图5 新狼毒素A对Hep G2细胞上清液中 乳酸分泌水平的影响Fig.5 Effect of Neochamaejasmin A on the secretion of lactic acid in supernatant of Hep G2 cells
2.6 新狼毒素A对已糖激酶(HK),丙酮酸激酶(PK)和乳酸脱氢酶(LDH)的影响
如图6所示,不同浓度的新狼毒素A作用于细胞48 h后,细胞中丙酮酸激酶和乳酸脱氢酶活性均受到抑制且呈现剂量依赖性。结果表明新狼毒素A可以抑制丙酮酸激酶和乳酸脱氢酶的活性。但是己糖激酶的活性变化不明显。
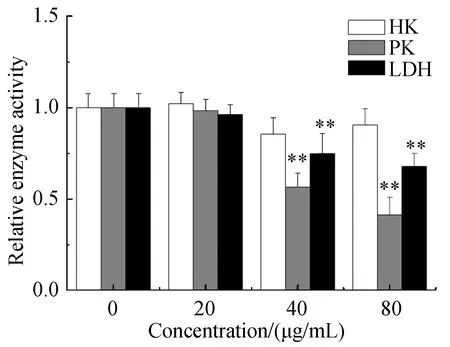
与正常组相比, **P<0.01。Note:**P<0.01 图6 新狼毒素A对Hep G2细胞HK、PK和LDH的影响Fig.6 Effect of Neochamaejasmin A on HK, PK and LDH in Hep G2 Cells
3 讨论
新狼毒素A是从瑞香狼毒中提取出的活性化合物,已有研究证实新狼毒素A能诱导细胞凋亡[6]。本研究显示新狼毒素A可以显著抑制Hep G2细胞的生长,并有明显的细胞毒作用。
Warburg 效应指多数的正常组织细胞主要产能方式为有氧代谢,当所需要的氧不够时,便会通过糖酵解的方式产能维持细胞活力,但肿瘤细胞颠覆了这一常理即提供足够的氧肿瘤细胞也通过糖酵解的方式进行产能[11]。所以大多的学者将目标转移到糖酵解这个焦点上,希望从中找到治疗癌症的有效的药物[12]。肿瘤细胞的正常生长离不开葡萄糖的支持,葡萄糖提供了肿瘤细胞生长的主要能量来源。本研究结果表明当新狼毒素A作用于Hep G2细胞48 h后,细胞上清液中的葡萄糖含量显著增多,表明细胞摄取葡萄糖的能力降低。ATP的供应对于肿瘤细胞的生长增殖至关重要,抑制ATP的水平是糖酵解过程中至关重要的因素。除此之外,乳酸的分泌水平可以间接的反应糖酵解的水平[13]。我们的结果表明细胞ATP和乳酸分泌水平随着新狼毒素A浓度的增大而降低。
与糖酵解有关的酶主要有己糖激酶(HK),丙酮酸激酶(PK)和乳酸脱氢酶(LDH)。HK是糖酵解的限速酶[14],HK在糖酵解的过程中为肿瘤细胞提供所需要的大量物质。PK是糖酵解的关键酶,PK与ATP水平密切联系,PK活性越高,所产生的ATP净含量会越高,促进了肿瘤细胞的生长[15]。LDH可催化底物生成乳酸,酸性的环境利于肿瘤细胞的生长和增殖[16]。我们的结果表明新狼毒素A通过抑制PK和LDH的活力,减少乳酸生成,抑制肿瘤细胞的增殖。本研究结果显示新狼毒素A可抑制Hep G2细胞的糖酵解水平,其机制可能与减少葡萄糖摄取和抑制糖酵解关键酶有关。
