小拟南芥激素相关基因及GH3.6的克隆与表达
2019-07-11黄薇孙琦刘芳金玉环罗先梅黄先忠
黄薇,孙琦,刘芳,金玉环,罗先梅,黄先忠
(石河子大学生命科学学院,特色植物基因组学实验室,新疆 石河子 832003)
植物的内源激素是在植物体内合成的简单化学结构的有机小分子物质,合成后运输至作用部位,参与调控不同的生长发育或胁迫响应[1]。植物激素通过控制相关基因的表达来调控植物生命周期中的很多方面,包括胚胎形成,种子萌发,果实成熟和器官衰老等,同时也有助于提高植物适应逆境的能力,为植物生长发育创造有利条件[2]。生长素(auxin)在植物体内主要以游离形式存在,在植物生长发育整个周期中起到关键作用,包括植物体对环境的应激反应,植物器官形成及胚胎发生[3-6],以浓度依赖性的方式调节细胞伸长和分化[7-9]。在调节植物体内生长素动态平衡中,各种结合酶和降解酶在最主要的生长素吲哚乙酸(IAA)调节机制中也起着重要作用。
GRETCHENHAGEN3(GH3)基因编码植物生长素酰胺合成酶,催化IAA氨基化,使生长素失活,从而维持植物体内生长素含量的动态平衡[10-11],是一类生长素早期响应基因家族。生长素酰胺合成酶基因在植物中广泛存在,与Aux/IAA和小生长素上调RNA (small auxin up RNA.SAUR)共同称为生长素早期应答基因或生长素原初表达基因[12-13]。随着对GH3基因关注逐渐增加,又相继在拟南芥(Arabidopsisthaliana)中鉴定出GH3基因20个,水稻(Oryzasativa)中有12个,苹果(Malusdomestica)中有15个,桃(Prunuspersica)中有8个,番茄(Solanumlycopersicum)中有15个[14-18]。拟南芥中GH3.1、GH3.6和GH3.2都对生长素非常敏感,调控下胚轴和根的生长,在逆境胁迫下,可通过调节体内的激素平衡来调节植物的生长[19-21]。GH3.9能使植物初生根变长,对IAA敏感性增加[22]。拟南芥AtGH3.6参与调控生长发育,过量表达该基因可导致侧根减少,植株矮小和叶片卷曲的生长素缺陷表型,表明GH3.6参与生长素介导的生理过程,为后续GH3.6在非生物胁迫下的生长素调控抗性机制的研究奠定基础[23]。
小拟南芥(Arabidopsispumila)生活在古尔班通古沙漠沙漠南缘,属于十字花科短命植物,是拟南芥近源物种,具有耐盐碱、抗干旱、光合能力强、繁殖率高等特点,是研究植物抗逆的优良材料[24-27]。我们前期克隆了小拟南芥CBF1[28]、VP1[29]、NHX1[30]、ZFP[25]和DBR[31]等基因,研究了基因响应逆境的表达特征及初步的功能;建立小拟南芥高盐胁迫下cDNA文库构建并开展表达序列标签测序分析[26-27]。
近年来转录组测序技术已经成为基因研究的重要方法,在植物抗逆性研究中起到关键作用。通过转录组研究可以获得多方面的信息能够对基因组剪切方式,转录因子分类以及胁迫条件下差异表达基因研究。我们前期利用二代和三代测序技术开展小拟南芥响应高盐胁迫的转录组测序,发现了8075个差异表达基因,分析了响应高盐胁迫的基因表达动力学特征[32]。目前,利用转录组数据来挖掘小拟南芥激素相关基因的研究尚未报道。因此,本研究基于此全长转录组数据库,获得了2156个激素相关基因,进行激素分类统计及不同聚类分析,并克隆了一个GH3.6同源基因。本研究获得的高盐胁迫下明显上调表达的激素相关基因,为今后深入研究小拟南芥激素相关基因的功能,探索短命植物适应环境的分子机理奠定基础。
1 材料与方法
1.1 材料
小拟南芥种子为本实验室保存,其培养及种植方法参考文献[27]。
1.2 方法
1.2.1 unigene的获取
实验室前期构建了小拟南芥叶片组织经250 mM NaCl胁迫0、0.5、3、6、12、24和48 h的转录组数据库,发现了8075个差异表达基因[32]。根据这些基因的功能注释筛选出激素相关基因,利用ArabidopsisHormone Database2.0(http://ahd.cbi.pku.edu.cn/)和NCBI数据库(http://blast.ncbi.nlm.nih.gov/)进行比对分析,将激素相关基因分为生长素、脱落酸、乙烯、水杨酸、茉莉酸、油菜素内酯、细胞分裂素及赤霉素。然后将筛选出的激素相关基因在分层聚类(H-Cluster),K均值聚类(K-means Cluster)和密度聚类(SOM Cluster)中分类并统计基因相对表达水平值log2(ratios)进行表达分析。对于每个基因来说ratios是指该基因在样品2的FPKM(Expected number of Fragments Per Kilobase of transcript sequence per Millions base pairs sequenced.FPKM:每百万碱基对每千碱基转录物序列的预期片段数)值与该基因在样品1的FPKM值的比值。将小拟南芥激素相关基因在持续上调的聚类(H1、K6和SOM1-3)中筛选出来统计基因数量及log10(FPKM+1),使用RStudio(https://www.rstudio.com/)绘制基因表达热图,从中挑选持续上调表达基因ApGH3.6进行基因克隆及表达分析。
1.2.2 材料处理、取样、总RNA提取及cDNA合成
将生长2周后的小拟南芥幼苗转移至含250 mM NaCl的1/2 MS培养基上分别处理0、0.5、3、6、12、24和48 h后收集材料。另外收集小拟南芥成熟植株的根、茎、叶、花以及果荚组织材料。使用Tiangen公司的RNA prep pure Plant Kit试剂盒提取小拟南芥叶片总RNA,利用百泰克公司M-MLV Reverse Transcrptase合成cDNA的第一链。
1.2.3 小拟南芥ApGH3.6的克隆、测序及系统进化树构建
利用小拟南芥全长转录组数据检索出一条unigene编码的蛋白注释为GH3.6同源基因,基因序列包含完整开放阅读框(ORF),将该unigene命名为小拟南芥ApGH3.6。根据ApGH3.6的ORF设计引物ApGH3.6-F和ApGH3.6-R,在引物两端加上酶切位点KpnI和PstI (表1)。以NaCl处理12 h的小拟南芥cDNA作为模板进行RT-PCR扩增,PCR体系参考Ex Taq (TaKaRa)说明书。反应程序为94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,38个循环后,延伸10 min。将PCR产物经1.2% (w/v)琼脂糖凝胶电泳检测,回收目的条带,连接pMD19-T(TaKaRa)载体,转化大肠杆菌DH5α感受态细胞,提质粒酶切鉴定,将鉴定正确的质粒送北京六合华大基因有限公司测序。利用NCBI检索GH3.6同源蛋白,Clustal W对氨基酸序列多重比对,MEGA5.0构建系统进化树[33]。
1.2.4ApGH3.6基因表达分析
采用qRT-PCR技术分析基因组织表达情况。基因特异引物为ApGH3.6-RT-F和ApGH3.6-RT-R,内参引物为GAPDH-F和GAPDH-R[34](表1)。qRT-PCR使用Fast SYBR Mixture试剂盒(康为世纪),美国ABI 7500 Fast实时荧光定量PCR仪(LifeTechnologies,Foster City,CA,USA)进行扩增。反应程序为95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,循环数为40,60 ℃读取荧光值。对每份样品的目的基因和内参基因的Ct值进行检测,每份样品3次重复。实验数据采用2-ΔΔCt法进行相对定量分析[35]。结果基于3次独立实验,每组实验重复3次,采用SPSS17.0软件对实验结果进行单因素方差分析[32],利Duncan法进行多组样本之间的差异显著性分析(P<0.05)。

表1 本研究所用PCR引物序列Tab.1 PCR primers used in this study
注:下划线部分表示酶切位点。
1.2.5 过量表达载体35S∶ApGH3.6的构建
将测序正确的质粒pMD19-T∶ApGH3.6以及载体pCAMBIA2300-CaMV35S-OCS使用KpnI和PstI双酶切,电泳检测后分别基因片段及载体片段。利用T4连接酶4 ℃过夜连接,将连接产物转化DH5α感受态细胞,37 ℃下倒置培养14~16 h。挑取单菌落于液体LB培养基中摇瓶过夜培养,提取质粒经KpnI和PstI双酶切,酶切产物经1.2% (w/v)琼脂糖电泳检测,构建35S∶ApGH3.6载体。将鉴定正确的质粒,用冻融法转化农杆菌GV3101菌株,挑取单克隆进行菌液PCR验证,将鉴定正确的菌液保存于-80 ℃冰箱备用。
2 结果与分析
2.1 高盐胁迫下小拟南芥激素相关基因的差异表达分析
利用不同时间点高盐胁迫下的小拟南芥全长转录组数据库[32]分析,从8075个差异表达基因中筛选出激素相关基因2156个,基因表达热图分析表明,在盐胁迫早期阶段(0.5~6 h),一些基因被快速激活,表现为早期持续高表达,而一些基因在盐胁迫的后期(12~48 h)被快速激活,表现为后期持续上调。另外,有一些基因在盐胁迫处理期间,表达量呈现出随着时间的增加而下降的趋势;有一些基因的表达量随着胁迫时间的增加而持续上升,且在各个时间表达量均比对照高(图1A)。因此,随着胁迫时间不断增加而持续上调表达的基因将作为研究重点。按照激素类型可分为脱落酸(abscisic acid) 736个,生长素(auxin) 485个,油菜素内酯(brassinosteroid) 134个,细胞分裂素(cytokinin) 89个,乙烯(ethylene) 233个,赤霉素(gibberellin) 101个,茉莉酸(jasmonic acid) 204个,水杨酸(salicylic acid) 184个,其中脱落酸和生长素所占比例较大分别为34%和22%,而细胞分裂素所占比例最小为4%,推测生长素和脱落酸在响应盐胁迫中起到重要作用(图1B)。根据H Cluster、K-means Cluster和SOM Cluster 3种聚类方法分析高盐胁迫下小拟南芥激素相关基因,可以看出在H1、K6以及SOM1-3子集中差异基因表达水平处于持续上调趋势(图2A-C),其中H1包含激素相关基因342个,K6中包含292个,SOM1-3中包括210个,从Venn图中分析表明,共同分布在3个子集中持续上调表达基因共136个(图2D)。另外,经3个子集热图表达分析表明,大部分基因的表达量呈现持续上调的趋势,而有一部分基因在12 h、24 h及48 h上调表达(图3A),从中发现ApGH3.6在不同时间点盐胁迫处理下均表达,整体呈现持续上调趋势,并在48 h表达量达到最高,表明该基因明显响应盐胁迫(图3B),可能在小拟南芥对高盐胁迫中起着重要作用。
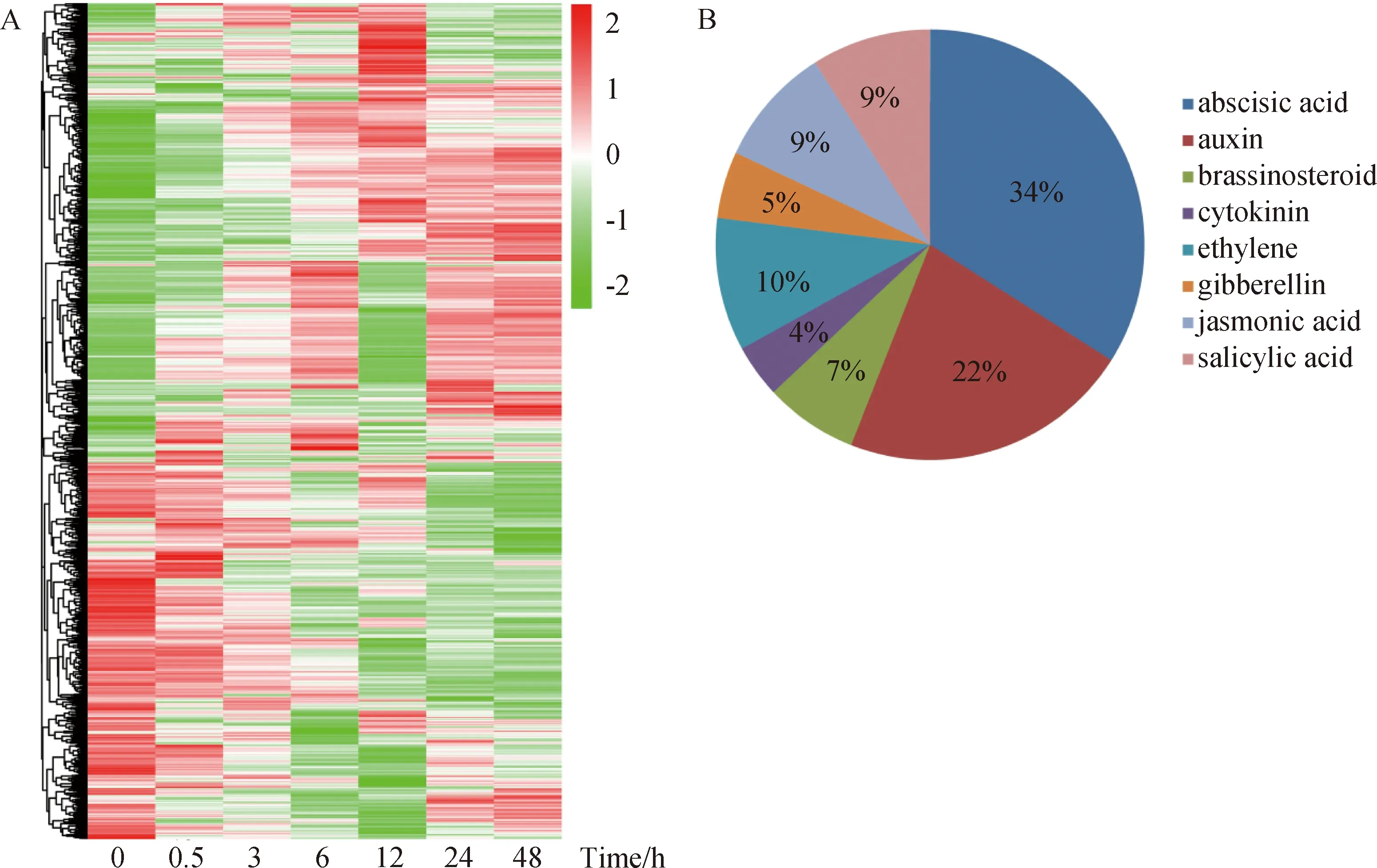
A:2175个激素相关基因log10(FPKM+1)值所绘制的表达热图;B:激素相关基因的分类情况图1 2156个小拟南芥激素相关基因分析Fig.1 2156 Arabidopsis pumila hormone-related genes
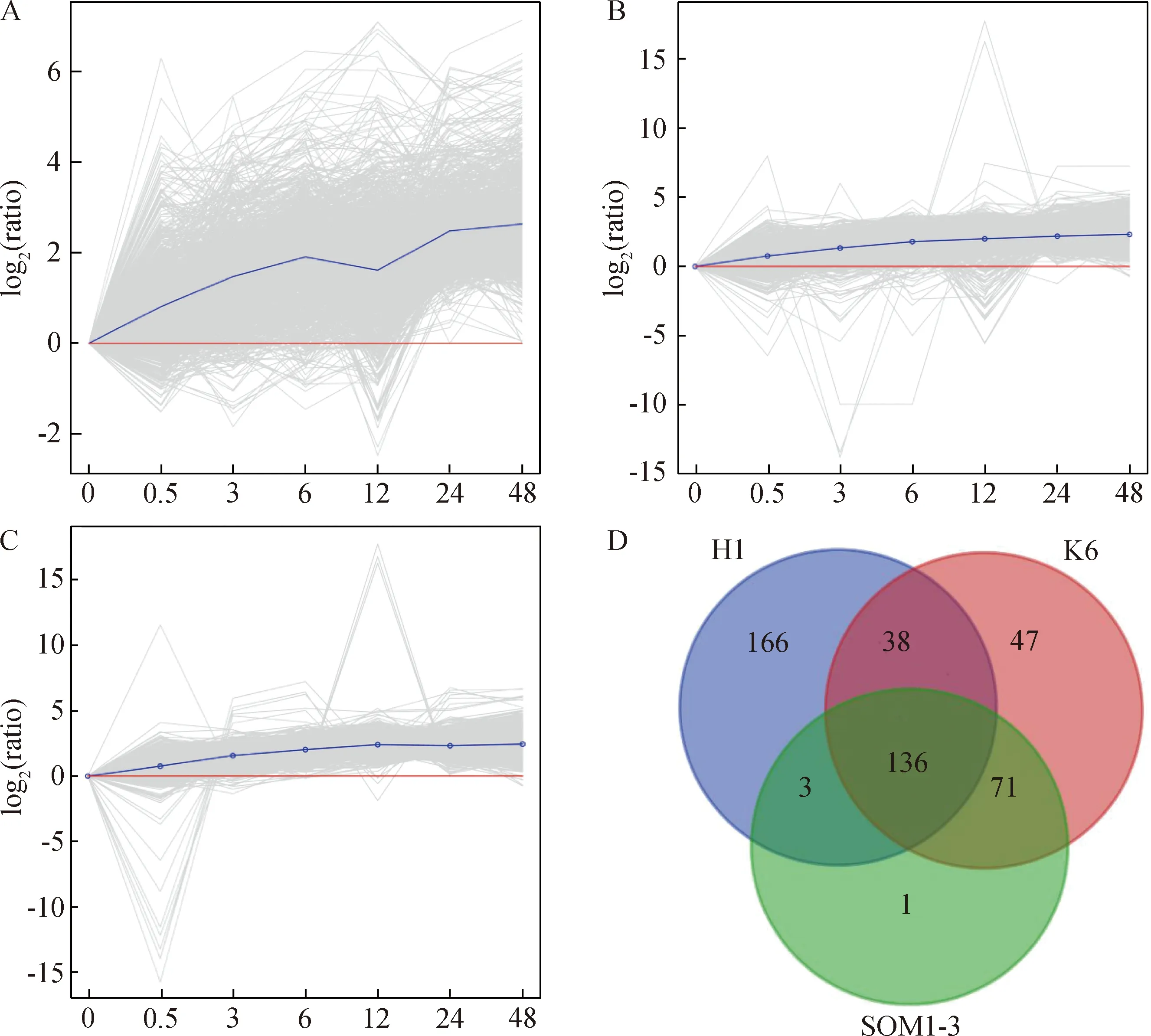
A:H聚类;B:K means聚类;C:SOM聚类;D:3种聚类中激素相关基因数量Venn图图2 小拟南芥2156个激素相关基因聚类及Venn图分析Fig.2 Clustering and venn diagram analysis of 2156 hormone related genes in Arabidopsis pumila
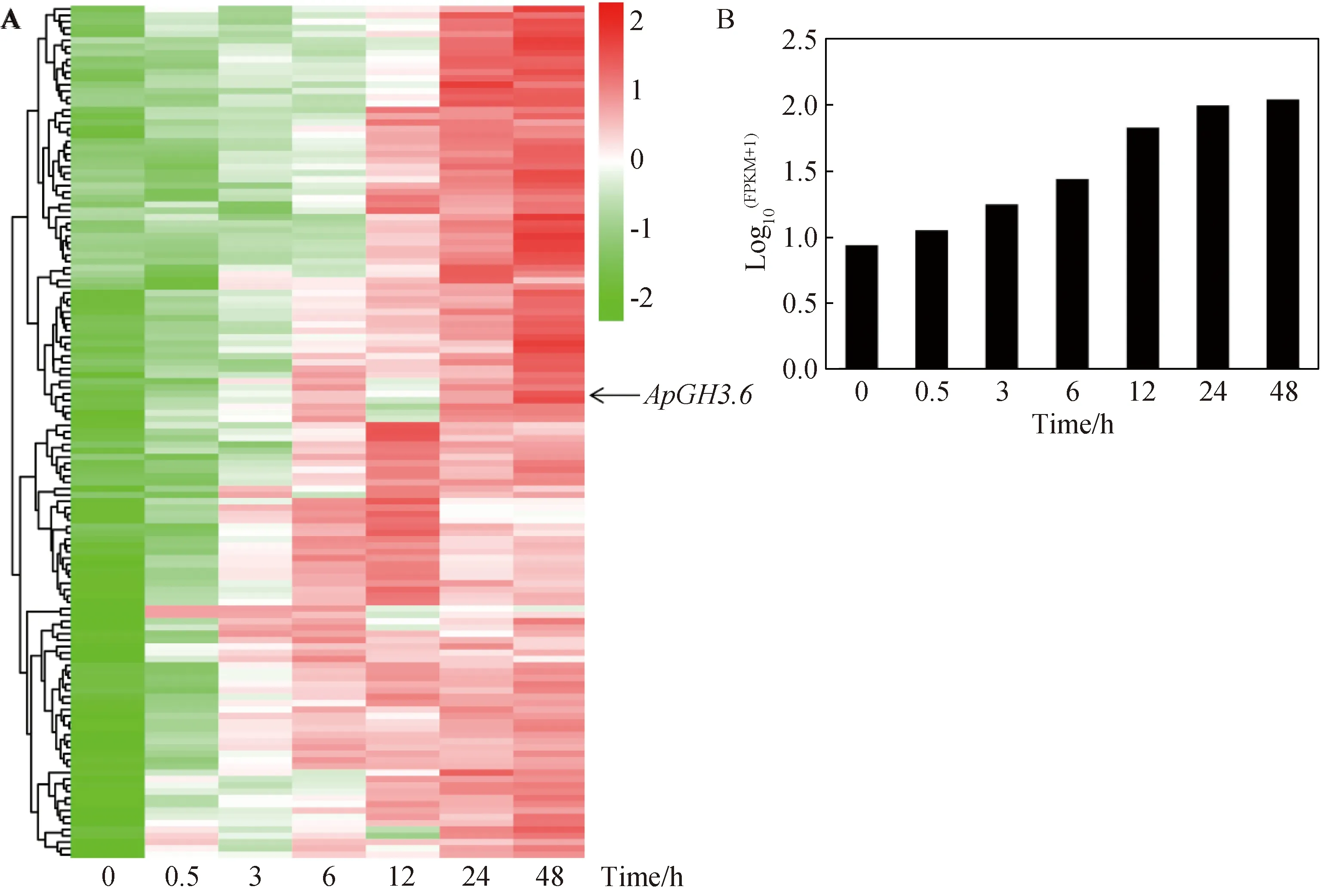
A:136激素相关基因响应250 mM NaCl胁迫的表达热图;B:250 mM NaCl胁迫不同时间点的ApGH3.6表达特征图3 136个上调表达的激素相关基因表达分析Fig.3 Expression analysis of the 136 up-regulated genes related to hormone
2.2 小拟南芥ApGH3.6基因的克隆及系统进化分析
利用RT-PCR技术从小拟南芥转录组中扩增得到了该基因的ORF,测序分析表明ApGH3.6基因的ORF长为1839 bp,推测编码612个氨基酸(图4)。小拟南芥ApGH3.6与荠菜(Capsellarubella)、哥伦比亚锦葵(Herraniaumbratica)、长蒴黄麻(Corchorusolitorius)、胡杨(Populuseuphratica)、毛果杨(Populustrichocarpa)、大桉(Eucalyptusgrandis)、醉蝶花(Tarenayahassleriana)、山嵛菜(Eutremasalsugineum)、欧洲油菜(Brassicanapus)、甘蓝(Brassicaoleracea)、荠蓝(Camelinasativa)、梅花(Prunusmume)和亚洲棉(Gossypiumarboreum)的GH3的同源蛋白的系统进化树分析结果表明,小拟南芥ApGH3.6与甘蓝和欧洲油菜GH3.6的进化关系较近,与山萮菜的进化关系最近,属于同一分支(图5)。
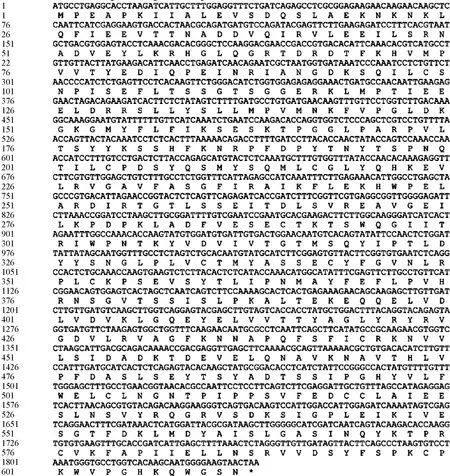
图4 ApGH3.6核苷酸序列及推测氨基酸序列Fig.4 Nucleotide sequence of ApGH3.6 and the deduced amino acid sequence
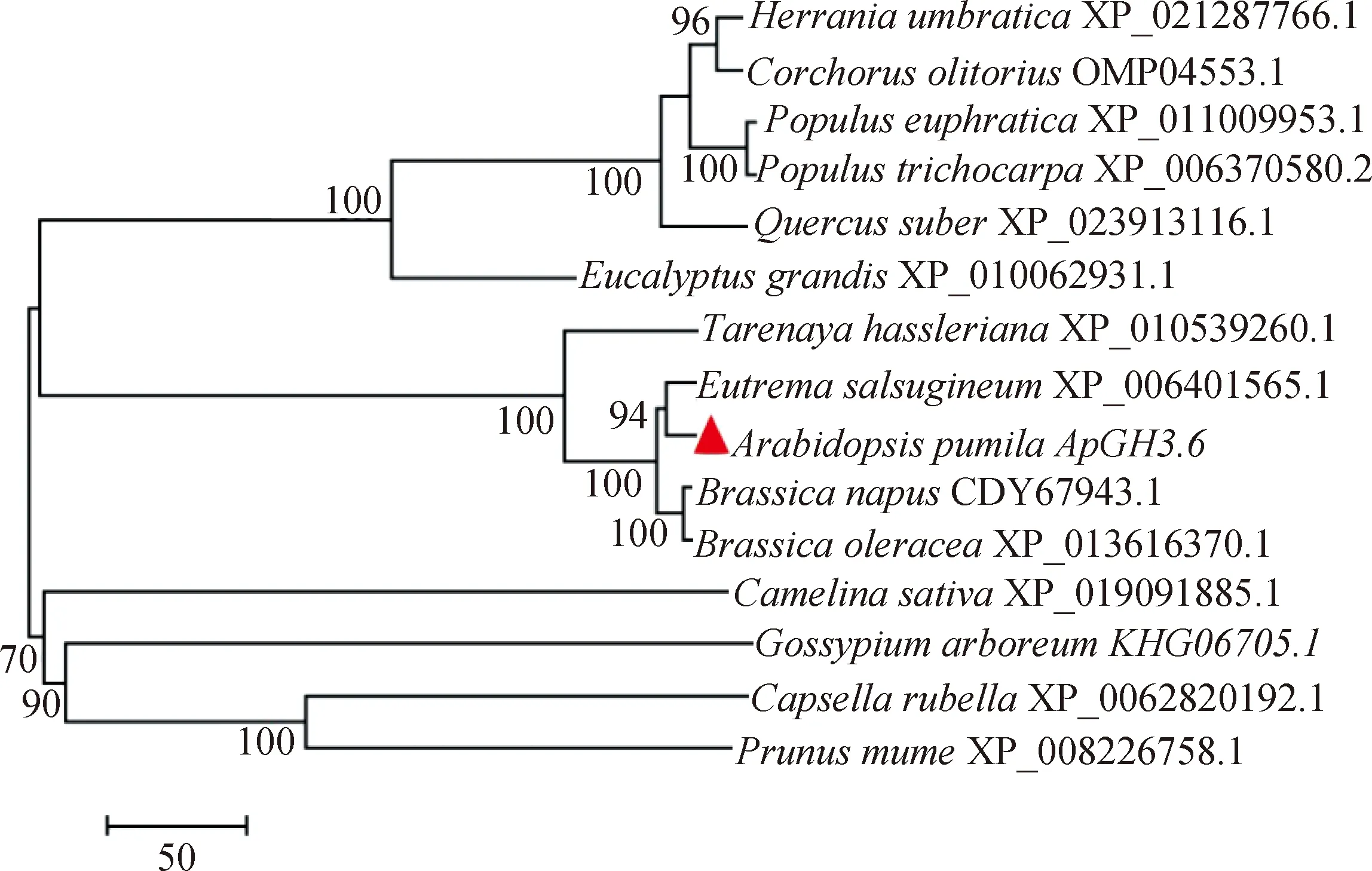
▲代表本研究克隆的ApGH3.6蛋白;图中分支点的数字表示Bootstrap验证中基于 1000次重复该节点可信度的百分比;标尺代表每一位点碱基替换率图5 ApGH3.6与其他植物GH3.6蛋白序列进化分析Fig.5 Phylogenetic tree of ApGH3.6 and other plant species GH3.6 proteins based on amino acid sequences
2.3 小拟南芥ApGH3.6组织表达分析
qRT-PCR分析表明ApGH3.6基因在小拟南芥的根、茎、叶、花和果荚等组织中均有表达,在花中表达量最高,在根、茎、果荚和叶中表达量较低并且无明显差异(图6)。
2.4 植物双元表达载体35S∶ApGH3.6的构建
经KpnI和PstI酶切的pMD19-T∶ApGH3.6质粒及pCAMBIA2300-p35s-OCS载体,并回收目的片段及质粒大片段,用T4连接酶连接后转化大肠杆菌感受态细胞。转化后的质粒用KpnI和PstI进行酶切鉴定,琼脂糖凝胶电泳检测结果显示,酶切后质粒大小与目的基因大小一致,均在接近1800 bp处,表明插入片段连接到目的载体上(图7A)。最终载体35S∶ApGH3.6含有花椰菜病毒CaMV35S启动子,章鱼碱合成酶基因OCS为终止子及植物筛选标记新霉素磷酸转移酶基因NPTⅡ(图7B)。将35S∶ApGH3.6载体热激转化农杆菌感受态细胞,挑取单克隆进行PCR检测,扩增产物与目的基因产物大小一致,结果表明已成功转化农杆菌(图7C)。
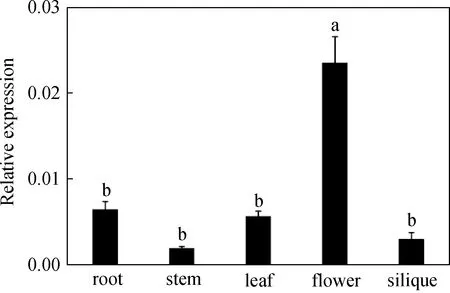
该图为ApGH3.6基因在根、茎、叶、花和果荚中表达; 不同小写字母表示差异显著(P<0.05)图6 小拟南芥ApGH3.6组织表达情况Fig.6 Expression pattern of ApGH3.6 in Arabidopsis pumila different tissues
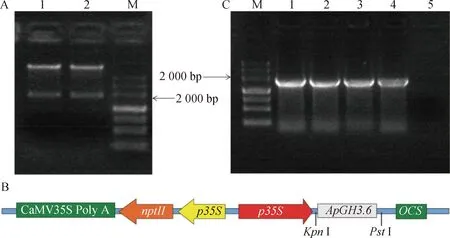
A:1为35S∶ApGH3.6质粒酶切;B:35S∶ApGH3.6载体模式图;C:转化农杆菌GV3101菌落PCR产物,1为阳性对照,5为阴性对照图7 植物过量表达载体35S∶ApGH3.6的构建Fig.7 Construction of plant overexpression vector 35S∶ApGH3.6
3 讨论
随着高通量测序技术的不断完善,测序技术在转录组水平上的应用愈发普遍,运用转录组数据能够完善基因组图谱尚未完成及遗传数据信息缺乏的物种。近年来二代测序(second-generation sequencing.SGS)技术加快转录组研究进程,该技术产生的短读取十分精确,且通量高价格便宜。使用三代测序(third-generation sequencing.TGS)技术长读长的读取方式会大大促进高等生物转录组从头组装[32]。因此,本研究利用短读长和长读长相结合的方式,为探索短命植物小拟南芥激素相关基因对盐胁迫的响应奠定基础。
植物激素生长素主要以游离形式存在于植物,在植物生长发育整个周期中起到关键作用,包括植物体对环境的应激反应,植物器官形成以胚胎发生。生长素在植物组织中以自由态和束缚态2种形式存在,自由态具有活性,当植物体具有较高浓度的自由态时,可以结合其它分子,以非生物活性的形式存储或者进一步降解。植物体内生长素这2种形式间的转化是体内生长素水平的自我调节,对植物生长的调控具有重要意义。基于小拟南芥转录组数据分析,已获得参与小拟南激素相关基因2156个,分析出生长素相关基因共有485个。根据拟南芥和沙漠杨转录组测序分析,拟南芥中生长素相关基因共有58个[37],沙漠杨(Populuspruinosa)中有53个生长素相关基因[38],可以看出高盐胁迫下小拟南芥转录组数据库中生长素相关基因数量众多,且远远超过拟南芥和沙漠杨,表明植物在抵御逆境时,生长素相关基因的作用必不可少。通过对转录组数据聚类分析表明,在H-Cluster、K-means Cluster、SOM Cluster中持续上调表达均分布在H1、K6和SOM1-3三个子集中,共有136个。这些基因在盐胁迫下呈现出明显的差异,对小拟南芥激素相关基因与抗逆机制的研究意义重大。
GH3、Aux/IAA和SAUR是植物中主要的生长素早期响应基因[36]。GH3基因家族参与植物体的生长发育,水稻和拟南芥等植物中的一些GH3基因在生物与非生物胁迫反应中也起到重要作用。GH3基因家族中成员与抗逆密切相关,其中Feng等[39]在玉米中采用RT-PCR技术克隆该基因ZmGH3.6,长度为1935 bp,编码644个氨基酸,等电点为6.56,且均无信号肽和跨膜结构域,为研究GH3基因家族与生物逆境胁迫之间的关系奠定基础。Chen等[40]在柑橘中克隆了CsGH3.6基因,其长度为1887 bp,编码629个氨基酸,与拟南芥相似性达到85%,通过系统发育分析CsGH3.6蛋白与荠菜亲缘关系最近,为解决柑橘抗溃疡病症提供了基础。本研究以小拟南芥ApGH3.6为研究对象,通过生物信息学分析发现与玉米ZmGH3.6和柑橘CsGH3.6基因长度及编码氨基酸数据相似,且都不具有物跨膜结构域,因此推断ApGH3.6属于GH3基因家族。
拟南芥中AtGH3.6的表达受生长素诱导,过表达AtGH3.6导致芽和胚轴细胞的伸长以及侧根的形成明显受到抑制。此外,在光照条件下过表达AtGH3.6的植株下胚轴变短;而在黑暗条件下,下胚轴长度和野生型没有区别,这表明AtGH3.6参与了光信号转导途径,起到了将生长素途径与光信号转导途径联系起来的作用[41]。拟南芥AtGH3.9参与了生长发育调控,过量表达该基因可导致植株矮小,下胚轴变长,雄蕊变短,果荚短小[42]。因此,小拟南芥ApGH3.6是否具有上述生物功能有待进一步研究。为了进一步研究该基因的功能,已经构建过量表达载体35S∶ApGH3.6,并转化农杆菌GV3101,进行拟南芥遗传转化研究,为今后研究基因功能做铺垫。基因表达模式的分析对于功能研究是必不可少的,组织表达分析表明ApGH3.6在小拟南芥各组织中高表达,但在花中表达量最高,表达量几乎达到根、茎和叶和果荚的数倍,说明ApGH3.6很可能参与到小拟南芥花器官的形成和发育的过程。在不同浓度盐胁迫下,基因表达分析结果表明,随着胁迫时间的增加,ApGH3.6呈现持续上调的趋势,可以看出ApGH3.6参与响应逆境胁迫。植物激素信号转导途径是今后小拟南芥激素相关基因研究的工作重点,以此来进一步探索激素相关基因在生长发育及抗逆过程中的调控功能。
