京尼平苷酸对APP/PS1小鼠学习记忆能力及脑 内淀粉样蛋白沉积的影响
2019-07-11周张玖智侯加卫任盟乔杨光屈祖卫胡艳丽
周张玖智,侯加卫,任盟乔,杨光,屈祖卫,胡艳丽
(石河子大学药学院/新疆植物药资源利用教育部重点实验室, 新疆 石河子 832002)
衰老常伴随蛋白质的异常聚集或者淀粉样化,淀粉样蛋白沉积与许多神经退行性疾病息息相关[1]。随着老龄化社会的不断加剧,神经退行性疾病对我国老龄人群的危害日益加剧,阿尔茨海默病 (Alzheimer's disease, AD) 为众多神经退行性疾病中最常见的一类[2]。AD发病机制复杂且多样, 其具体致病机理尚不清楚,目前大多学者认为AD的核心发病机制是β-淀粉样蛋白(Amyloid β-protein, Aβ)的沉积[3]。Aβ生成增加和Aβ清除障碍,均会导致脑内Aβ产生与清除的失衡,通过多种途径启动Aβ诱导的下游反应,其中Aβ沉积诱导的慢性神经炎症反应已成为AD公认的发病机制之一[4]。因此了解Aβ生成和清除机制及神经炎症水平,对寻找潜在的AD防治策略至关重要。
杜仲系杜仲科植物杜仲的干燥树皮,京尼平苷酸(Geniposidic acid, GPA)是杜仲环烯醚萜类乙醇提取化合物[5]。大量研究显示,杜仲干燥树皮的水提物可在细胞水平有效保护PC-12细胞、BV-2细胞及SH-SY5Y细胞免受Aβ诱导的损伤并减少细胞凋亡[6-8];在动物水平,本课题组前期实验结果显示,京尼平苷酸可改善D-半乳糖/亚硝酸钠诱导的痴呆小鼠的学习记忆障碍[9]。基于京尼平苷酸具有抑制炎症及神经保护的作用,本研究在前期实验的基础上,以APP/PS1双转基因小鼠为模型,围绕Aβ沉积和神经炎症反应,以期为京尼平苷酸治疗AD奠定理论基础。
1 材料与方法
1.1 实验动物及材料
1.1.1 实验动物
6~7月龄C57BL/6 J遗传背景的APP/PS1((APPswe,SEN1dE9)85Dbo)小鼠60只及同月龄的C57BL/6 J小鼠12只,体质量23~27 g,购于南京大学模式动物研究所(批号:D000268)。动物随机分组后饲养于温度(22 ± 2)°C,湿度45%~55%的环境中,自由进水、摄食,定期更换垫料。所有实验动物操作均符合医学实验动物管理实施细则相关政策。
1.1.2 实验药品及主要试剂
京尼平苷酸(四川省维克奇生物科技有限公司);盐酸多奈哌齐片(卫材(中国)药业有限公司);硫黄素-T(美国Sigma公司);DAB 显色试剂盒(丹麦 Dako公司);防荧光猝灭剂(美国Vector公司);白介素-1β(IL-1β)、白介素-6(IL-6)、白介素-4(IL-4)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒(武汉博士德生物有限公司);IDE兔多克隆抗体(Millipore公司);BACE小鼠单克隆抗体(美国Santa Cruz公司);辣根酶标记山羊抗小鼠/兔 lgG(北京中杉金桥生物技术有限公司)。
1.1.3 仪器
DMS-2型Morris 水迷宫,DTT-2 型小鼠跳台仪,SBA-2型小鼠避暗仪(中国医学科学院药物研究所);RM2245型切片机(德国莱卡公司);DB-09 型石蜡包埋机(湖北德森科技有限公司);YABO 200 型漂烘片机(常州市雅博电子设备有限公司);酶标仪(美国 Thermo 公司);DHP-9162 电热恒温培养箱(上海齐欣科学仪器有限公司);电泳仪,电转仪(美国 BIO-RAD 公司);低温冷冻离心机(德国 Eppendorf 公司);超纯制水机(成都唐氏唐宁科技发展有限公司);PY-120 水平脱色摇床(北京鼎国生物技术发展中心);超低温冰箱(美国 Thermo 公司);UVP化学发光成像系统(美国 UVP 公司);万分之一电子天平(日本 A﹠G 有限公司);LSM510 型显微镜(日本Zeiss公司)。
1.2 方法
1.2.1 动物分组,模型的建立及给药
6~7月龄APP/PS1小鼠60只,随机分成5组,即转基因组、京尼平苷酸组(25 mg/kg、50 mg/kg、75 mg/kg)、多奈哌齐(0.75 mg/kg)组,每组12只。同窝野生C57BL/6 J小鼠12只作为野生组。治疗组小鼠灌胃给予相应药物,同时野生组和转基因组小鼠根据体重灌服相应体积的生理盐水,连续给药至行为学实验结束。
1.2.2 Morris 水迷宫实验
给予测试药90天后,Morris水迷宫检测痴呆小鼠学习记忆能力。实验前在水迷宫内倒入30 g高分散型二氧化钛,使池内呈奶白色环境,以便摄像装置更准确地记录小鼠游泳路径。实验过程中,水温保持在(22 ± 2)°C,保持房间光线恒定,环境安静。实验分为定位航行实验和空间探索实验。前5 d为定位航行实验,逃避平台位于水面下约1 cm,平台设于固定象限中心,小鼠每天从相邻象限和相对象限入水,入水缓慢且保持小鼠头朝池壁,记录每只小鼠的逃逸潜伏期作为训练成绩。若120 s内小鼠未能成功找到平台,则引导其至平台停留15 s,逃逸潜伏期以120 s计,休息10 s再从另一象限入水。第6天进行空间探索实验,移去平台,小鼠从选定象限头朝池壁入水,记录小鼠120 s内穿越原平台所在位置的次数。
1.2.3 硫黄素-T染色
石蜡包埋的脑组织连续冠状切片,切片厚3.5 μm。石蜡切片常规脱蜡、水化后,0.1% 硫黄素-T 50%乙醇染液室温孵育10 min,70%乙醇脱水、蒸馏水清洗后,通风晾干后用防荧光猝灭剂封片,避光保存。荧光显微镜下摄取脑组织的皮层区及海马区,评价京尼平苷酸对APP/PS1小鼠脑组织硫黄素-T阳性斑块(纤维状淀粉样斑块)沉积的影响。
1.2.4 Western blot 检测BACE,IDE蛋白表达
精确称取一定质量的海马或皮层组织,加入适量RIPA裂解液(含终浓度为1 mmol/L的PMSF)提取总蛋白,蛋白测定仪测定蛋白浓度。蛋白变性后进行SDS-PAGE凝胶电泳,将目的蛋白转至PVDF膜后室温封闭一小时,BACE(1∶500),IDE(1∶15000),β-actin(1∶1000)抗体4°C孵育过夜。次日,HRP标记的相应种属的二抗(1∶10000)室温孵育PVDF膜一小时后,UVP化学发光检测仪对条带实验结果进行信号收集。
1.2.5 ELISA 试剂盒检测IL-1β、IL-6、IL-4、TNF-α含量
精确称取一定质量的海马或皮层组织,按照每10 mg组织加入100 μL RIPA蛋白裂解液的比例加入RIPA,同时加入PMSF使其终浓度为1 mmol/L,制作成10%匀浆。收集组织匀浆上清并用蛋白测定仪测定蛋白浓度。各指标测定严格按照说明书步骤进行。显色结束后,于450 nm处测定O.D.值,绘制标准曲线,计算各指标含量。
1.2.6 统计学分析

2 结果
2.1 Morris 水迷宫
定位航行实验结果表明,与野生型小鼠比较,转基因小鼠从训练的第三天起潜伏期明显增加(P<0.05),提示转基因小鼠出现空间学习障碍;与转基因比较,GPA 25、75 mg/kg剂量组和多奈哌齐组潜伏期明显缩短(P<0.05)。空间探索实验结果显示,转基因小鼠穿越平台次数明显少于野生组(P<0.05),说明痴呆小鼠记忆力显著下降;与转基因组比较,GPA各组均不同程度增加了痴呆小鼠穿越平台次数,其中,GPA75 mg/kg和多奈哌齐组有统计学意义(P<0.05)(表1、表2)。


Tab.1 Effect of GPA treatment on APP/PS1 double transgenic mice in the probe test
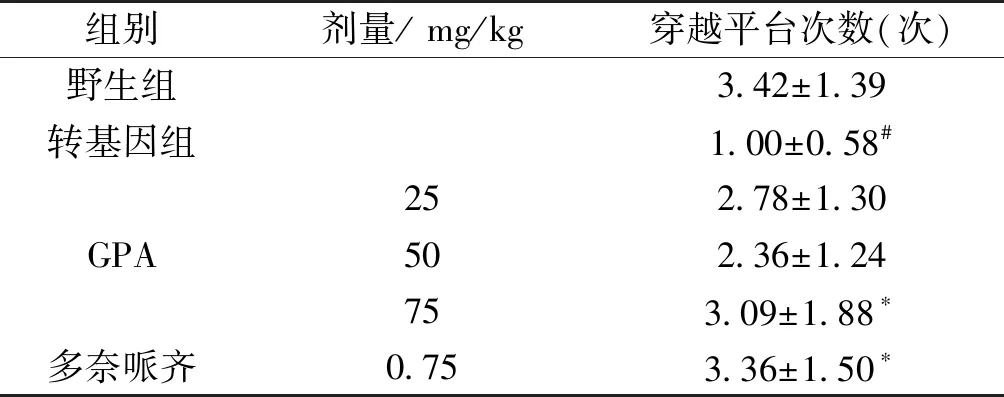
组别剂量/ mg/kg穿越平台次数(次)野生组3.42±1.39转基因组1.00±0.58#GPA252.78±1.30502.36±1.24753.09±1.88∗多奈哌齐0.753.36±1.50∗
注:与野生组比较#P<0.05;与转基因组比较*P<0.05(表2同)。


Tab.2 Effect of GPA treatment on APP/PS1 double transgenic mice in escape latency test
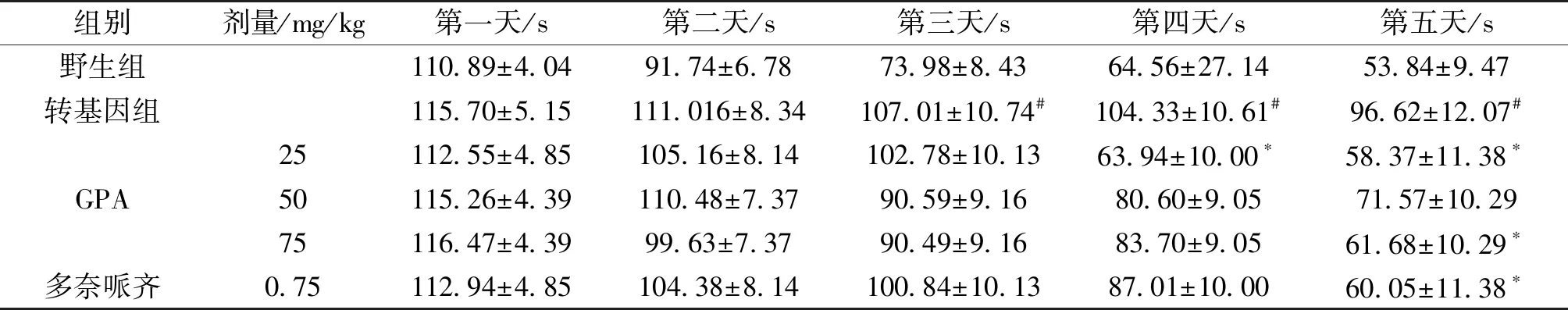
组别剂量/mg/kg第一天/s第二天/s第三天/s第四天/s第五天/s野生组110.89±4.0491.74±6.7873.98±8.4364.56±27.14 53.84±9.47转基因组115.70±5.15111.016±8.34107.01±10.74#104.33±10.61#96.62±12.07#GPA25112.55±4.85105.16±8.14102.78±10.1363.94±10.00∗58.37±11.38∗50115.26±4.39110.48±7.3790.59±9.1680.60±9.0571.57±10.2975116.47±4.3999.63±7.3790.49±9.1683.70±9.0561.68±10.29∗多奈哌齐0.75112.94±4.85104.38±8.14100.84±10.1387.01±10.0060.05±11.38∗
2.2 京尼平苷酸对APP/PS1转基因小鼠脑中硫黄素-T斑块表达的影响
皮层和海马组织各区Th-T染色结果显示,野生型小鼠皮层及海马区Th-T绿色荧光斑块数量较少。而转基因小鼠皮层及海马区Th-T斑块密且多,面积较大,亮度较高,Th-T百分面积显著增多(P<0.01);与转基因小鼠相比,GPA各剂量组及多奈哌齐组小鼠皮层和海马各区Th-T绿色荧光斑块显著减少,且亮度明显降低,Th-T荧光面积百分比显著降低(P<0.01)(图1、表3)。


Tab.3 Effect of GPA treatment on the percent area of Th-T marked Aβ positive plaque in APP/PS1 double transgenic mice brain

组别剂量/mg/kg海马(ROI%)皮层(ROI%)野生组0.63±0.050.48±0.06转基因组2.88±0.34##1.90±0.57##GPA251.73±0.30∗∗1.01±0.14∗∗501.03±0.18∗∗0.63±0.04∗∗751.13±0.22∗∗0.75±0.11∗∗多奈哌齐0.751.32±0.19∗∗0.74±0.08∗∗
注:与野生组比较##P<0.01;与转基因组比较**P<0.01。
2.3 京尼平苷酸对APP/PS1转基因小鼠脑组织中BACE,IDE蛋白表达的影响(图2)

A:海马50x; B:皮层200x图1 京尼平苷酸对APP/PS1小鼠大脑Th-T斑块的影响Fig.1 Effect of GPA treatment on APP/PS1 double transgenic mice in the of Th-T staining

图2 京尼平苷酸对APP/PS1小鼠皮层及海马组织IDE、BACE蛋白表达的影响Fig.2 Effect of GPA on the protein expression of BACE and IDE in the cortex and the hippocampus of APP/PS1 double transgenic mice
Western blot 结果图2显示,在皮层组织及海马组织中,与野生型小鼠比较,转基因小鼠IDE的表达水平显著降低(P<0.01),BACE的表达水平显著升高(P<0.01)。与转基因小鼠比较,GPA 25,50,75 mg/kg剂量组及多奈哌齐组IDE的表达水平明显降低(P<0.01),BACE的表达水平显著降低(P<0.01)。
2.4 京尼平苷酸对APP/PS1小鼠脑内IL- 1β、 IL-4、IL - 6、TNF-α含量的影响
与野生型小鼠比较,转基因小鼠皮层及海马组织中IL-1β、IL-6和TNF-α含量均显著升高,IL-4含量显著降低(P<0.01)。经GPA治疗后,转基因小鼠皮层及海马组织中IL-1β、IL-6和TNF-α含量均明显降低,其中GPA 50,75 mg/kg给药组及多奈哌齐给药组小鼠皮层中三者含量显著降低(P<0.01),GPA各给药组及多奈哌齐给药组小鼠海马中三者含量明显降低(P<0.05),GPA 50 mg/kg组小鼠皮层组织IL-4含量明显升高(P<0.05),但对海马组织内IL-4含量只有轻微升高的作用(表4、表5)。


Tab.4 Effect of GPA treatment on APP/PS1 double transgenic mice in the levels of IL-1β, IL-6, TNF-α and IL-4 in the cortex
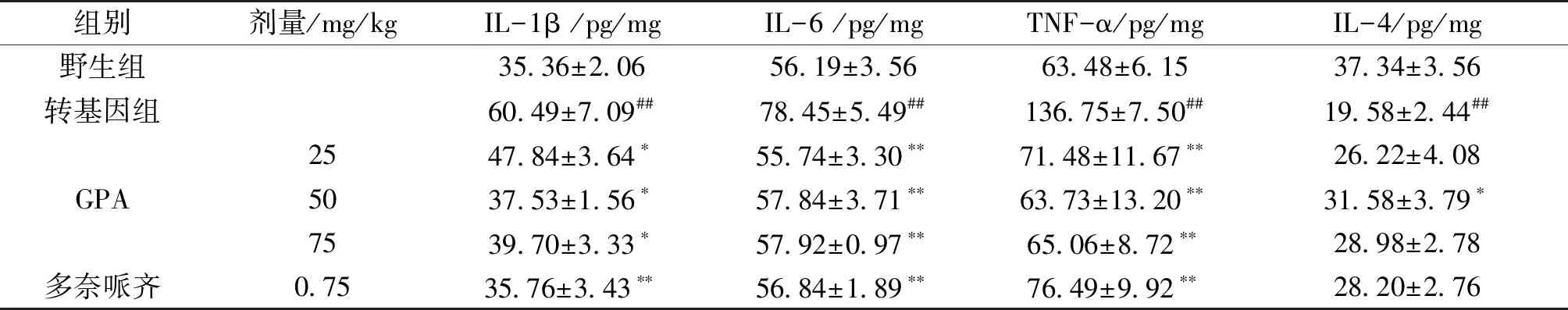
组别剂量/mg/kgIL-1β /pg/mgIL-6 /pg/mgTNF-α/pg/mgIL-4/pg/mg野生组35.36±2.0656.19±3.5663.48±6.1537.34±3.56转基因组60.49±7.09##78.45±5.49##136.75±7.50##19.58±2.44##GPA2547.84±3.64∗55.74±3.30∗∗71.48±11.67∗∗26.22±4.085037.53±1.56∗57.84±3.71∗∗63.73±13.20∗∗31.58±3.79∗7539.70±3.33∗57.92±0.97∗∗65.06±8.72∗∗28.98±2.78多奈哌齐0.7535.76±3.43∗∗56.84±1.89∗∗76.49±9.92∗∗28.20±2.76
注:与野生组比较##P<0.01;与转基因组比较*P<0.05,**P<0.01(表5同)。


Tab.5 Effect of GPA treatment on APP/PS1 double transgenic mice in the levels of IL-1β, IL-6, TNF-α and IL-4 in the hippocampus

组别剂量/mg/kgIL-1β/pg/mgIL-6/pg/mgTNF-α/pg/mgIL-4/pg/mg野生组32.58±1.4540.96±1.0724.80±6.8431.72±3.65转基因组42.95±2.19##63.39±3.62##60.57±8.62##17.94±1.55##GPA2538.64±1.34∗52.33±6.04∗34.72±7.13∗22.67±3.275036.22±0.82∗∗49.83±3.64∗36.82±6.91∗26.03±3.057535.97±1.40∗∗46.09±3.32∗∗34.38±5.34∗22.17±2.08多奈哌齐0.7536.17±0.70∗∗47.84±1.28∗34.70±8.20∗23.35±2.86
3 讨论
AD患者具有两大病理特征:神经元外Aβ沉积形成的老年斑(senile plaque, SP),以及神经元内由Tau蛋白过度磷酸化和营养不良性神经突起形成的神经纤维缠结(neurofibrillary tangles, NFTs)[10-11]。具有神经毒性的Aβ聚集,尤其是Aβ1-42,是触发病理级联的关键。β-淀粉样蛋白的大量沉积可活化星形胶质细胞和小胶质细胞,释放炎症介质,诱发中枢神经炎性反应或直接损伤神经元,最终导致记忆减退、认知障碍和人格改变[12]。空间记忆能力与海马和大脑皮层功能密切相关,Morris水迷宫实验是评价药物改善AD动物空间记忆及学习能力的经典实验,本实验结果显示,GPA具有改善APP/PS1转基因小鼠学习记忆能力的作用。
APP/PS1转基因小鼠很好地模拟了AD患者脑内慢性Aβ沉积和炎症过程,是可靠的AD动物模型[13]。硫磺素-T(Th-T)可以标记AD转基因小鼠脑组织内纤维状Aβ的β-折叠结构,荧光显微镜下观察到的绿色荧光即为Th-T标记的Aβ阳性斑块[14]。本实验中,Th-T可成功标记Tg小鼠脑内Aβ沉积,而WT小鼠未检测到荧光标记物,表明APP/PS1小鼠脑内存在典型的AD病理改变-Aβ沉积。经GPA治疗的小鼠皮层及海马组织内Aβ阳性斑块数量显著减少,阳性面积百分比显著降低,提示GPA可减轻脑组织的病理改变。
Aβ是β-淀粉样前体蛋白(β-amyloid precursor protein, APP) 在APP 的β-分泌酶和γ-分泌酶水解途径介导的病理状态下的代谢产物。β-分泌酶(β-site APP cleaved enzyme, BACE1)作为Aβ生成的限制酶,促进APP水解成Aβ,间接控制着Aβ 产生[15]。Heneka等研究显示,APP转基因小鼠出现Aβ沉积之前,脑内炎症部位的BACE1表达和活性明显增加,表明炎症过程可能直接促进局部Aβ的产生[16]。体内、体外研究均发现,胰岛素降解酶(Insulin-degrading enzyme, IDE)不但参与降解胰岛素,还发挥着降解Aβ的重要作用,是体内的Aβ降解酶之一,IDE活性与Aβ聚集程度呈负相关[17]。脑中的小胶质细胞和星形胶质细胞可分泌IDE至胞外,参与胞外Aβ的降解[18]。在能降解Aβ的几种酶中,IDE是唯一已知能降解可溶性和不溶性形Aβ的酶[19]。Farris等发现,小鼠IDE纯合子基因缺失造成IDE功能的完全丧失,会导致3月龄小鼠脑内Aβ1-40水平约升高65%[20]。当BACE-1活性增强,诱导Aβ 生成增多,IDE活性减弱,诱导Aβ降解降解机制发生障碍,易导致Aβ 团簇状聚集,沉积在脑内引起炎症等反应,造成神经元丢失和突触传导障碍。实验结果显示,京尼平苷酸干预APP/PS1双转基因小鼠3个月后,小鼠皮层及海马区BACE1蛋白表达显著降低,IDE蛋白水平显著升高,提示京尼平苷酸可通过影响Aβ的生成和降解两方面调控小鼠脑内Aβ水平。本实验通过ELISA实验检测到,与Tg小鼠相比,经京尼平苷酸治疗的APP/PS1小鼠皮层及海马区炎症因子(IL-1β、IL-6和TNF-α)表达显著降低,IL-4的表达有所增加,提示京尼平苷酸可减轻转基因AD小鼠的神经炎症,从而发挥神经保护作用。
综上所述,本研究提示京尼平苷酸可通过降低BACE活性同时增加IDE活性,减少APP剪切成具有神经毒性的Aβ的同时增加Aβ的降解,干预炎症因子释放,此过程以正反馈发挥神经保护作用,改善痴呆小鼠的学习记忆障碍。
