地龙抗血栓肽分离研究
2019-07-11王佳茜王少平刘万卉
王佳茜,王少平,刘万卉
(1.烟台大学药学院,山东 264000; 2.烟台市食品药品检验检测中心,山东 264000; 3.滨州医学院,山东 264000)
地龙为巨蚓科动物参环毛蚓Pheretimaaspergillum(E Perrier)、通俗环毛蚓PheretimavulgarisChen、威廉环毛蚓Pheretimaguillelmi(Michaelsen)或栉盲环毛蚓PheretimapectiniferaMichaelsen 的干燥体,前一种习称“广地龙”,后三种习称“沪地龙”[1-4],具有清热定惊,通络,平喘,利尿的功效。用于高热神昏,惊痫抽搐,关节痹痛,肢体麻木,半身不遂,肺热喘咳,尿少水肿,高血压等病症[5-8]。
地龙中的主要成分为蛋白质,其含量占总虫体的50%。地龙多为口服给药,其中的蛋白质无法直接消化进入人体,需要进行体内酶解成小分子多肽才能被人体吸收并发挥作用[9-12]。因此本试验模拟人体消化原理对地龙进行酶解得到地龙酶解液,同时采用多种方法对地龙酶解液进行分离,得到活性强、纯度高的组分。
1 仪器与试药
1.1仪器 BPH-9082型精密恒温培养箱(上海一恒科学仪器有限公司),HH-601超级恒温水浴锅(镇江瑞祥仪器有限公司),MS104型十万分一天平、MS105DU万分之一天平(梅特勒-托利多国际贸易上海有限公司),KQ2200DV型超声振荡仪(杭州法兰特超声波科技有限公司),DKH-43型实验室用膜处理设备(上海陶氏膜处理集团)、LG1100型蠕动泵(dragonlab仪器公司),DA201-C、D101、AB-8大孔吸附树脂(沧州宝恩树脂有限公司)、sephadex G15、sephadex G25、G50、Agilent BOZAX300SB-C18肽色谱柱(150 mm,5 μm)、C18半制备色谱柱(250 mm×50 mm,10 μm),以上色谱柱购自济南华哲实验仪器有限公司,TSK-GEL G2000SWXL凝胶色谱柱(300 mm,5 μm,125 Å)、RP-kromasilo C18色谱柱,以上色谱柱购自日本TSK公司,1 000 Da纳滤膜、3 000 Da超滤膜、烧杯(规格:10、100、1 000和5 000 ml),量筒(规格:10 和100 ml),培养皿(直径10 cm),试管(0.5 cm×10 cm),玻璃棒。
1.2试剂 凝血酶(批号20150610,活力:500 U/g,深圳生化制剂厂),琼脂糖(批号20151102,国药集团化学试剂有限公司),牛血纤维蛋白原(纯度95.3%,批号20140103,沈阳拜英生物科技有限公司),牛血清白蛋白BSA(纯度:99.9%,国药集团化学试剂有限公司),注射用尿激酶(活性:30万U/g,辽宁天正生物制药有限公司),生理盐水(500 ml,山东华鲁制药集团),分子量测定标准物质(BSA66430、血管紧张素1 045.5、低分子肝素钠3 700、乙酰胺乙酰胺乙酸189.1)购自上海源叶生物科技有限公司,磷酸二氢钠、磷酸氢二钠、硫酸铜、硫酸锂、钨酸钠、氢氧化钠、碳酸钠、酒石酸钾钠、磷酸、钼酸钠、盐酸均为分析纯,去离子水(实验室自制,密理博水处理系统)。
2 方法与结果
2.1纤维平板纤溶试验
2.1.1试剂配制
2.1.1.1磷酸(PBS)缓冲溶液制备 称取磷酸氢二钠和磷酸二氢钠适量,加入适量去离子水,制成pH为7.2的磷酸缓冲溶液。
2.1.1.2工作液 将生理盐水和配好的PBS溶液按照17∶1的比例配制工作液。
2.1.1.3牛纤维蛋白原溶液 取0.3 g牛纤维蛋白原,加工作液100 ml,配制成0.3%的牛纤维蛋白原溶液。
2.1.1.4凝血酶溶液 取凝血酶1.0 g,加生理盐水制成10 U/ml的溶液。
2.1.1.5尿激酶溶液 取30万U/g的尿激酶,加生理盐水,分别配制成100 000、50 000、10 000、1 000、500和100 U/ml的溶液。
2.1.2标准曲线建立 取工作液100 ml,采用电热套对其加热煮沸,加入0.5 g琼脂糖,待其彻底溶解后,取出,放凉至50 ℃,加入20 ml牛纤维蛋白原溶液、1.0 ml 10 U/ml凝血酶溶液,振荡后导入培养皿内部,每个培养皿10 ml,放入4 ℃冰箱冷藏15 min。用直径为1 mm打孔器进行打孔,并在每个孔内加入“2.1.1.5”项下各尿激酶标准溶液10 μl,放入恒温培养箱培养12 h(37 ℃)。取出后采用游标卡尺对溶圈进行测定,计算溶圈面积。以溶圈面积为纵坐标,以尿激酶活力(U)的对数为横坐标进行线性回归。 得到线性方程为Y=1.560 2X-1.833 1(R2=0.996 4),结果尿激酶活性在100~50 000 U范围内线性良好。
2.2多肽标准曲线
2.2.1对照品溶液 精密称取牛血清白蛋白10 mg,加去离子水溶解,而后转移至50 ml量瓶中定容,备用。
2.2.2碱性铜试液配制 精密称取烘干后的NaOH 10.0 g、Na2CO350 g,加水400 ml溶液,作为A液;再取酒石酸钾钠0.5 g、五水硫酸铜0.25 g,加水80 ml溶解,作为B液。使用时A液、B液混合定容至500 ml即得碱性铜试液。
2.2.3福林酚试液配制 取钨酸钠(Na2WO4·2H2O)50 g、钼酸钠12.5 g,加水500 ml置于2 000 ml圆底烧瓶内,再加入35%磷酸溶液25 ml、盐酸(质量分数为38.5%)50 ml,然后置于加热套内冷水回流加热,沸腾后计时,保持微沸10 h,再加硫酸锂25 g、去离子水50 ml,摇匀,再加0.2 ml溴,敞口加热挥发多余的溴,保持沸腾15 min,放凉,倒出,过滤,置于棕色量瓶内,定容至500 ml,备用。
2.2.4标准曲线建立 精密量取对照品溶液0.0、0.2、0.4、0.6、0.8和1.0 ml,分别置具塞试管中,各加水至1.0 ml,再分别加入碱性铜试液1.0 ml,摇匀,各加入福林酚试液[取福林试液储备液(1→16)]4.0 ml,立即混匀,置55 ℃水浴中反应5 min,取出,置冷水浴中冷却10 min,照紫外-可见分光光度法(《中国药典》2015年版一部附录Ⅴ A),以0号管为空白,在650 nm波长处迅速测定吸光度。以吸光度为纵坐标,牛血清白蛋白含量为横坐标,绘制标准曲线,并计算线性回归方程。线性回归方程为Y=2.028 3X+0.008 6(R2=0.999 1),表明肽在0~0.2 mg/ml范围内线性良好。
2.3样品制备与处理
2.3.1酶解液制备 取地龙药材(粉粹、过80目筛)100 g,加去离子水1 000 ml,先加热煎煮20 min,然后加0.1 mol/ml HCl溶液调pH至1.5,再加入胃蛋白酶1.0 g,37 ℃保温酶解1.0 h,而后再加2%NaOH溶液调pH至8.0,加胰蛋白酶1.0 g,继续酶解2.0 h,酶解完成后煮沸20 min,放凉,冷藏12 h,离心(4 500 r/min) 10 min,收集离心液,浓缩至500 ml。
2.3.2酶解液脱盐处理 调整地龙酶解液浓度到500 mg/ml,调pH至6.5,分别装入电渗析仪器内,先在流速15 L/h下平衡装置15 min,连通电源,在电压31 V条件下进行除盐操作,操作时间为150 min。采用电导仪进行测定得出脱盐率为95%。
2.4地龙活性肽分离
2.4.1超滤分离 采用3 000 Da、1 500 Da超滤膜对“2.3.2”项下的地龙酶解脱盐液进行超滤处理,设定压力为0.3 Mpa,流速为20 L/h,同时采用恒容间歇方法进行试验,将地龙酶解脱盐液分为<1 500 Da、1 500~3 000 Da和>3 000 Da 3种溶液。分别标记为L1、L2和L3。调整L1、L2、L3溶液质量浓度至5 mg/ml,采用“2.1”项下纤溶试验对3种溶液进行活性测定,得出体外纤溶活性结果,见表1。结果表明,体外纤溶活性大小顺序为L1>L2>L3。因此选用L1即<1 500 Da溶液进行下一步分离。

表1 超滤溶液活性结果(n=5)
2.4.2DA201-C树脂分离
2.4.2.1DA201-C树脂预处理 取DA201-C树脂适量,先加去离子水,充分浸泡12 h,过滤,反复几次,直至溶液无颜色变化为止。然后加95%乙醇浸泡12 h,过滤,反复几次,直至乙醇溶液无颜色变化为止,再使用去离子水冲洗至无醇味,备用。
2.4.2.2树脂吸附 将与处理好的DA201-C树脂装入树脂柱,然后将地龙酶解液<1 500 Da溶液调整浓度至20 mg/ml,调节pH至6.0,以2 BV/h的流速上样,下端接电脑自动收集器,每5 ml收集一试管,以A220 nm≤0.05为上样终点,静态吸附3 h后,采用去离子水、30%乙醇、50%乙醇和80%乙醇分别对吸附后的DA201-C树脂进行洗脱。分别收集洗脱液,浓缩,调整质量浓度至5 mg/ml。
2.4.2.3活性测定 采用“2.1”项下纤溶试验对4种洗脱溶液进行活性测定,得出体外纤溶活性结果。见表2。结果表明,30%乙醇洗脱液洗脱液纤溶活性最强,因此下一步对30%乙醇洗脱液进行分离。
2.4.3G15凝胶分离
2.4.3.1G15 sephadex凝胶预处理 取G15凝胶树脂,采用去离子水洗涤,过滤,去掉杂质后,再次采用去离子水充分浸泡24 h,备用。

表2 DA201-C树脂洗脱液活性结果(n=5)
2.4.3.2G15凝胶树脂分离 取G15凝胶树脂,装入树脂柱内,将过DA201-C树脂的30%乙醇洗脱液浓缩至10 mg/ml,从树脂柱上端装入,上样体积2 ml,上样后随即采用去离子水进行洗脱。下端接样品电脑自动收集器,每1 ml收集一个试管,在280 nm下检测每个试管的吸光度并记录,绘制以试管数为横坐标,试管吸光度为纵坐标的曲线。结果见图1。
从图1可以看出,G15将30%乙醇洗脱液分为两个部分,第一部分为试管7~14,第二部分为试管15~30,因此重复上述分离步骤50次,分别收集两个峰,分别命名为P1和P2。调整质量浓度为5 mg/ml,然后按照“2.1”项下纤溶试验对P1、P2进行活性测定,得出体外纤溶活性结果,见表3。
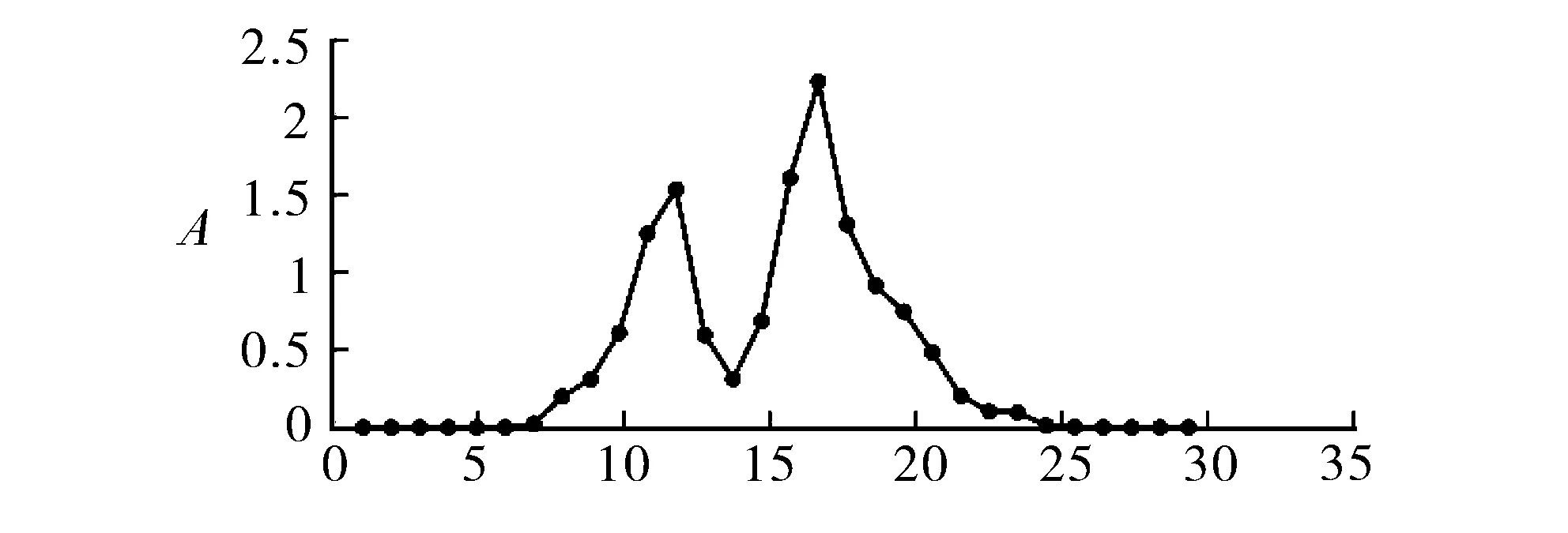
试管数图1 G15吸附结果图表3 G15分离样品活性结果

样品活性(U/g)P15 002.134 8±89.003 4P223 485.290 1±154.394 5
表3结果得出,G15分离得到的P1、P2活性大小为P2>P1,因此下一步对P2进行分离。
2.4.4液相分离 地龙酶解液采用超滤、DA201-C树脂、G15凝胶分离后得到活性较高的P2组分,为进一步了解P2起纤溶活性的物质,采用液相对P2组分进行进一步分离。
色谱条件:色谱柱:waters -C18肽色谱柱(250 mm×4.6 mm,5 μm);检测波长:220 nm;流速:1.0 ml/min;检测器:UV检测器;流动相:采用梯度洗脱方法:A:0.1%TFA乙腈,B:0.1%TFA水,0~55 min:95%B→50%B;55 min~75 min:50%B→95%B;进样量:20 μl。按照以上色谱条件进行试验。结果见图2。
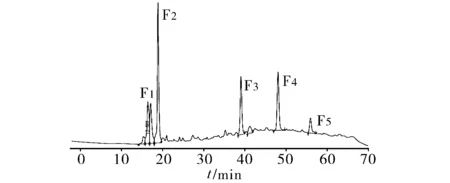
图2 色谱对P2组分的分离结果
根据图2所示,液相将P2组分分为5个主要峰,分别命名为F1、F2、F3、F4和F5,说明分离效果良好。因此按照上述液相条件采用半制备液相对组分P2进行半制备分离,分离得到F1、F2、F3、F4和F5样品,浓缩至质量浓度为2 mg/ml。并按照“2.1”项下体外纤溶活性试验对5个样品进行测定,结果见表4。结果5个组分的活性顺序为F3>F2>F1>F5>F4,说明F3组分为主要的活性成分。
采用Waters半制备液相对P2样品进行半制备,重复100次,接收F3组分,采用“2.1”、“2.2”项下方法对F3组分进行多肽含量、纤溶活性试验,得出多肽含量为95.13%,纤溶活性为60 021.302 9 U/g。

表4 5个组分活性结果
3 讨论
本试验以地龙为试验材料,结合人体对大分子蛋白的消化原理设计体外酶解方法对地龙药材进行体外酶解,得到地龙活性酶解液。同时采用电渗析、超滤、DA201-C树脂、saphedexG15凝胶树脂、液相进行分离,得到纯度高、活性强的组分F3。同时采用Waters半制备液相对F3进行半制备,然后对F3进行多肽含量与活性测定,得出F3多肽含量为95.13%,纤溶活性为60 021.302 9 U/g。
地龙作为传统中药具有活血化瘀的功效,现代研究得出,地龙中的活性成分为蚓激酶,蚓激酶为两种类型酶,即纤维蛋白溶酶原激活物和纤维蛋白溶酶;其中还有类似组织型纤维蛋白溶酶原激活物(t-PA)的成分。但是大分子蛋白并不能直接通过肠道被人体吸收,因此酶解后形成小分子肽才能更好地发挥药效作用。由于酶的位切点存在多样化,因此造成酶解多肽存在多个序列形成混合物。因此试验采用多种方法在多肽混合物中寻找活性较强的组分。后期试验将对F3采用LC-TOF2-MS、500 M核磁共振仪进行结构的分析。
