SUMO化修饰对卵母细胞染色体非整倍性的影响
2019-07-10任艳萍柳琼友雷小灿
任艳萍,柳琼友,雷小灿
遵义医科大学基础医学院组织胚胎学教研室,贵州遵义 563003
胎儿染色体非整倍性是流产和新生儿出生缺陷的主要原因之一[1]。研究发现,胎儿染色体非整倍性大多来自卵母细胞(精子占比4%~5%,卵母细胞占比 约95%)[2]。卵母细胞染色体非整倍性与女性年龄呈正相关,高龄女性(>35岁)卵母细胞染色体非整倍率显著上升[1, 3-4]。Kuliev等[5]对2830位女性的20 986颗卵母细胞进行FISH检测,发现35~45岁女性的卵母细胞染色体非整倍率高达46.8%。因此,卵母细胞染色体非整倍性是导致女性不孕、流产以及新生儿畸形的重要原因[6]。近年来,随着婚育年龄的逐年上升,年龄相关卵母细胞非整倍性对女性生殖健康和家庭幸福的威胁日益加剧,急需展开该领域的相关科学研究。本文将从SUMO(small ubiquitin-related modifier)化修饰对卵母细胞中Cohesin蛋白复合物的作用及其对微管动力学的影响两方面,分别探讨SUMO化修饰在姐妹染色单体过早分离型和非分离型卵母细胞非整倍性中的作用。
SUMO化修饰
蛋白翻译后修饰有磷酸化、乙酰化、泛素化、SUMO化等多种途径。其中,SUMO化修饰作为一种翻译后修饰,参与细胞增殖、分化、凋亡以及周期调控等众多生理调控过程[7]。近期研究发现,SUMO化修饰在卵母细胞减数分裂方面发挥重要作用[8- 10]。
SUMO化修饰相关因子
SUMO蛋白家族:SUMO蛋白家族包含4个成员,分别是SUMO- 1、SUMO- 2、SUMO- 3和SUMO- 4。其中,SUMO- 2和SUMO- 3的同源性很高,仅在N段存在3个氨基酸残基的差别,因此常被称为SUMO- 2/3[11];SUMO- 4只在肾脏、脾脏以及一些免疫组织中检测到其表达[12]。
SUMO化修饰相关酶:SUMO蛋白酶家族(sentrin-specific protease,SENPs)具有催化SUMO蛋白前体成熟,将SUMO蛋白从底物上移除的功能,包含6个成员,分别是SENP1、SENP2、SENP3、SENP5、SENP6和SENP7[13]。哺乳动物的E1酶是由SAE1-SAE2(又名AOS1-UBA2)异源二聚体组成的复合物,在调控细胞周期由G2向M期转换中发挥重要作用[14]。迄今发现的E2结合酶只有UBC9一种,该酶可识别底物上的蛋白结合保守序列ΨKxD/E(Ψ代表1个大的疏水氨基酸残基,K代表赖氨酸,x代表任意氨基酸,D代表天冬氨酸,E代表谷氨酸),并完成底物的SUMO化修饰[15]。在哺乳动物中,E3连接酶由活化的STATs抑制剂(protein inhibitor of activated STATs proteins,PIAS)1、PIAS3、PIASx和PIASy基因编码,敲除后对小鼠发育无显著影响,推测其可能并不是SUMO化修饰所必需的[16]。
SUMO化修饰过程SUMO化修饰过程可分为以下5步:(1)SUMO蛋白前体经SENPs移除C端的几个氨基酸,暴露出2个甘氨酸残基,形成具有生物活性的成熟的SUMO蛋白;(2)成熟的SUMO蛋白的甘氨酸残基与由SAE1-SAE2异源二聚体组成的E1酶的半胱氨酸残基结合,发生腺苷酰化;(3)SUMO蛋白被转移到E2结合酶Ubc9的半胱氨酸残基上,形成E2-SUMO硫脂复合物;(4)在E3连接酶的作用下,SUMO蛋白的2个甘氨酸残基与底物的赖氨酸残基之间形成异肽键;(5)在SENPs或去SUMO化异肽酶(desumoylating isopeptidase,DeSI)的作用下,SUMO蛋白从底物上解离,又可进入新的SUMO化过程[17]。
SUMO化修饰影响卵母细胞生发泡破裂率和第一极体排放率
在小鼠卵母细胞减数分裂的pre-MⅠ期、MⅠ期和MⅡ期,SUMO- 1定位于纺锤体的两极,SUMO2则集中定位于着丝粒附近[8]。通过向GV期小鼠卵母细胞显微注射SUMO- 1的SiRNA或SUMO- 1抗体,抑制SUMO- 1的表达或功能,生发泡破裂(germinal vesicle breakdown,GVBD)率和第一极体(first polar body,PB1)排放率显著降低[9]。由此可见,SUMO蛋白家族对调节卵母细胞减数分裂有重要影响[18]。
研究发现,过表达SENP2导致小鼠卵母细胞MⅡ期纺锤体形成缺陷[19]。在小鼠卵母细胞减数分裂期间,SENP3与纺锤体共定位,抑制SENP3导致GVBD和PB1排放率降低,微管组织中心(microtubule organizing centers,MTOCs)定位所必需的AuroraA表达水平下降且在纺锤体上的定位显著减少,SUMO- 2/3介导的SUMO化修饰下调[10]。泛素缀合酶9(ubiquitin conjugating enzymes 9,UBC9)在卵母细胞减数分裂各时期均有表达[20],抑制UBC9可显著降低小鼠卵母细胞GVBD率和PB1排放率[9]。以上实验结果表明,SUMO化修饰相关酶对卵母细胞减数分裂具有重要影响。
SUMO化修饰对卵母细胞染色体非整倍性的影响
目前普遍认为,在女性出生后几天起至排卵前GVBD期间,卵母细胞的长期停滞是导致卵母细胞非整倍率远高于精子的主要原因[21]。卵母细胞非整倍性主要来源于以下两类异常:(1)姐妹染色单体的过早分离,即姐妹染色单体分离异常(prematurely separated sister chromatids,PSSCs);(2)完整姐妹染色体对分离异常,称为非分离型[22]。
SUMO化修饰影响Cohesin蛋白复合物长期以来,Cohesin蛋白复合物丢失假说一直是卵母细胞非整倍性发生的主流分子机制:Cohesin是一种绑定同源染色体或姐妹染色单体的环形蛋白复合物,在从DNA复制到中期结束前,该复合物具有维持染色体间聚合的作用[23];随着母源年龄的增长,卵母细胞的长期停滞致使Cohesin蛋白复合物从染色体上逐渐丢失,姐妹染色体提前分离,最终形成非整倍性卵母细胞[24- 26]。但该假说不适用于解释,在青年和高龄小鼠卵母细胞核质互换实验中,青年小鼠卵母细胞胞质可挽救高龄小鼠卵母细胞细胞核的AⅠ期染色体迟滞的现象[27]。因此,Cohesin蛋白复合物降解假说更适合解释PSSCs导致的卵母细胞非整倍性,不适用于解释以AⅠ期染色体迟滞(完整的姐妹染色体对迟滞)为主要特征的非分离型卵母细胞非整倍性[27- 29]。
酵母有丝分裂研究中,将Cohesin蛋白复合物去SUMO化后,姐妹染色单体分离,表明SUMO化修饰在Cohesin蛋白复合物凝集姐妹染色单体过程中发挥重要作用[30- 32]。对细胞有丝分裂的研究发现,Cohesin、condensin等复合物的SUMO化状态对姐妹染色体凝集情况有重要影响[33]。抑制小鼠卵母细胞中SUMO- 1和UBC9的表达,Cohesin蛋白复合物的关键组成蛋白减数分裂重组蛋白(meiotic recombination protein,REC8)在纺锤体与染色体上的定位显著减少,卵母细胞非整倍率显著上升;同时SOMO- 1在老龄小鼠GV期卵母细胞中的表达和定位减少[9]。这些研究表明,SUMO化修饰是Cohesin蛋白复合物凝集姐妹染色单体所必须的。
减数分裂后期,Cohesin蛋白复合物的REC8亚基被Separase裂解,Cohesin从染色体上解离,染色体分离[34]。在后期之前,SGO2保护REC8,使其免遭Separase的作用而水解,敲除SGO2卵母细胞PSSCs率显著上升[35]。SGO2与年龄呈负相关,高龄雌性小鼠卵母细胞中,着丝点区域SGO2蛋白减少,PSSCs率显著上升[36- 37]。此外,Separase还受到两个独立抑制途径的调控:(1)Separase与其抑制剂Securin结合;(2)磷酸化的Separase通过cyclin B1与周期蛋白依赖性激酶Cdk1结合[38- 39]。在卵细胞中,抑制Securin或Cdk1均可提高Separase活性,引发PSSCs[40]。APC/CCdc20通过水解Securin和cyclin B1激活Separase[38];而在进入后期之前,纺锤体装配检查点(the spindle-assembly checkpoint,SAC)识别并水解APC/CCdc20,以避免PSSCs[41]。分别抑制Bub1和Mad2这2个SAC的关键组成均可导致PSSCs[42- 43]。
Pelisch等[44]在线虫中证实BUB- 1是SUMO化底物;Xiao等[45]在细胞水平上研究发现,抑制SUMO化可抑制Cdk1活性;Shabbeer等[46]在乳腺癌细胞系中发现,cyclin B1是SUMO化底物。本文将小鼠的Separase、Securin、Cdk1、cyclin B1、Bub1、Mad2和SGO2这7个Cohesin蛋白复合物调控因子进行SUMO化位点预测,发现所有7个调控因子的蛋白序列都存在高可能性的SUMO化修饰位点,其中Separase、Cdk1、cyclin B1、Bub1和SGO2这5个调控因子均存在至少1个评分0.9以上的SUMO化修饰位点(表1)。因此,可推测在Cohesin蛋白复合物调控因子中存在多个SUMO化修饰底物,SUMO化修饰通过调节这些底物的活性,影响卵母细胞非整倍性。
SUMO化修饰影响纺锤体微管动力学近年研究发现,在纺锤体形成的早期阶段,大约一半的高龄雌性卵母细胞出现瞬时多极纺锤体现象,且该现象与MⅠ期中板集合延迟、AⅠ期染色体迟滞和非整倍性卵母细胞的发生率呈正相关[28, 47]。2017年 Nakagawa等[27]研究发现,高龄小鼠的卵母细胞中存在明显的纺锤体微管动力学改变,诱发卵母细胞出现瞬时的多极纺锤体现象,导致微管-动粒黏附缺陷和非分离型卵母细胞非整倍性;且青年和高龄小鼠卵母细胞核质互换实验证明,高龄小鼠卵母细胞出现瞬时多极纺锤体和AⅠ期染色体迟滞的现象是源于年龄相关细胞质改变,与染色质的变化无关。因此,微管动力学改变是诱发高龄小鼠出现瞬时多极纺锤体,导致年龄相关的非分离型卵母细胞非整倍性的重要因素。
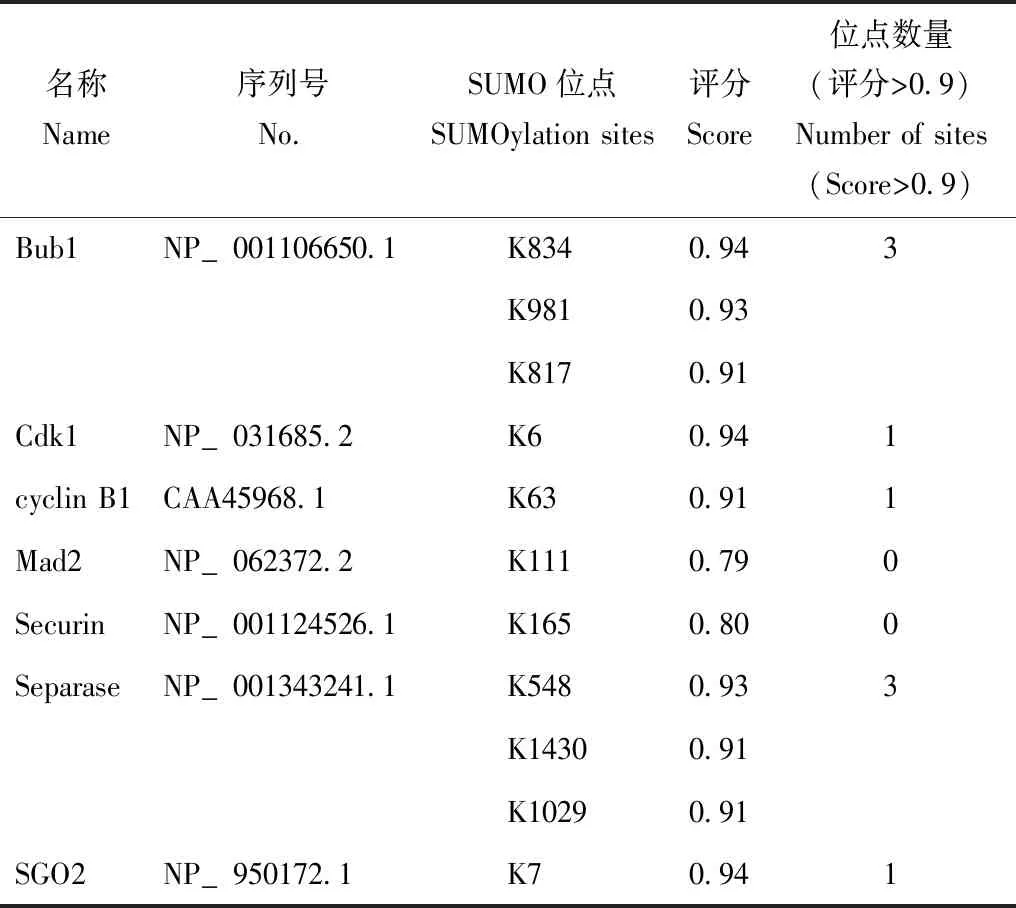
表1 Cohesin及其相关蛋白的SUMO化修饰位点预测Table 1 Predicted SUMOylation sites of Cohesin protein and related proteins
蛋白序列源自NCBI,SUMO化修饰位点预测源自SUMOplotTM(www.abge nt.com/tools);表中SUMO位点仅列出“高可能性的SUMO位点”中评分>0.9的位点,如没有评分>0.9的位点则列出“高可能性的SUMO位点”中评分最高的一个位点
The protein sequence is from NCBI,and the SUMOylation site is predicted from SUMOplotTM(www.abge nt.com/tools);the SUMOylation sites with the score of>0.9 are listed in the table;if there is no site with a score of>0.9,the highest scoring site is listed instead
在小鼠卵母细胞MⅠ期和MⅡ期,SUMO蛋白酶家族成员SENP7与卵母细胞纺锤体微管共定位,抑制SENP7的表达,γ位微管蛋白的错位定位,泛素化介导的蛋白酶体降解γ位微管蛋白,导致纺锤体形态异常,无法通过纺锤体装配检查点[48]。SUMO- 1介导的SUMO化翻译后修饰Plk1在卵母细胞减数分裂纺锤体组装中发挥重要作用,抑制剂抑制SUMO化修饰导致纺锤体形态异常率显著上升[49]。这些实验结果表明,SUMO化修饰可通过调节卵母细胞纺锤体动力学,从而影响卵母细胞非整倍性。
综上所述,卵母细胞非整倍性主要源于以下2个方面:Cohesin蛋白复合物丢失导致的姐妹染色单体的过早分离型卵母细胞非整倍性;以及纺锤体动力异常导致的姐妹染色单体对非分离型卵母细胞非整倍性。SUMO化修饰即可调节Cohesin蛋白复在染色体上的定位,影响过早分离型卵母细胞非整倍性,同时可调节纺锤体动力学,影响非分离型卵母细胞非整倍性(图1)。由此可见,SUMO化修饰对卵母细胞染色体非整倍性具有重要作用,但尚不清楚SUMO化修饰是通过修饰哪些底物影响卵母细胞非整倍性,其具体分子机制还有待进一步研究。
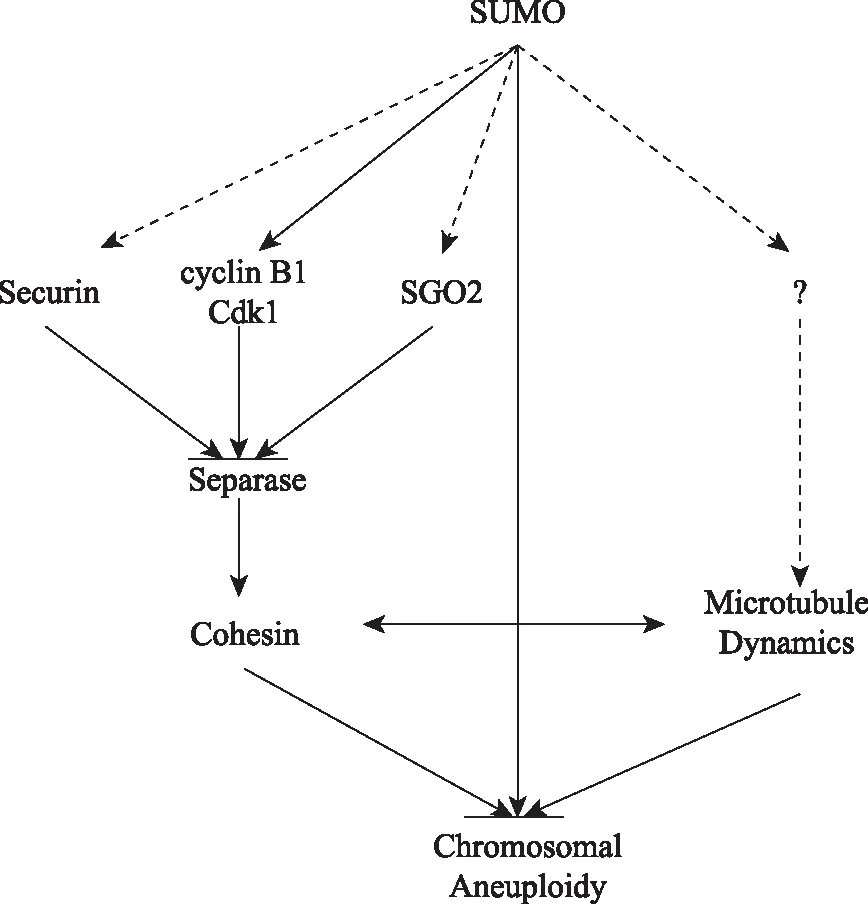
实线:已证实;虚线:推测
Solid line:confirmed;Dotted line:predicted
图1SUMO化修饰与卵母细胞非整倍性
Fig1SUMOylation and chromosomal aneuploidy in oocytes
