间介中胚层样细胞在肾脏再生中的应用
2019-07-10张建烨赵升田
张建烨,管 勇,孔 峰,赵升田
山东大学第二医院 1泌尿外科 2中心实验室,济南 2500333山东大学附属山东省立医院泌尿外科,济南 250012
慢性肾脏病所引起的终末期肾病已成为导致全球人口死亡的一个重要因素[1],其主要治疗措施包括透析和肾脏移植。由于长期透析会产生多种严重并发症,如心血管疾病、感染和骨病等,给患者及其家庭带来沉重的经济负担[2],因此肾脏移植是目前最为理想的替代治疗方式。然而,肾源的短缺及肾脏移植后需要终身服用抗免疫排斥药物严重限制了其广泛应用[3- 4],利用干细胞进行再生医学的研究则为终末期肾病的治疗带来希望,其中,肾脏脱细胞支架结合干细胞的研究引起了广泛关注。 2013年,Song等[5]首次采用脱细胞肾脏支架结合内皮细胞和上皮细胞共培养并进行原位移植,结果发现移植肾脏能够产生尿液,这是肾脏再生研究中一个里程碑式的进步。目前更多学者更加倾向于应用肾脏脱细胞支架结合干细胞进行肾脏再生研究,因为干细胞可多向分化,具有良好的可塑性,在特定条件下能分化为特定的细胞类型,因此,干细胞的引入使采用肾脏脱细胞支架实现肾脏再生的研究向前迈进了一步。哺乳动物肾脏的产生来源于间介中胚层,间介中胚层又分化为后肾间质、输尿管芽,之后分别分化为肾单位和集合管,故间介中胚层被认为是肾脏发生的初始阶段。脂肪干细胞(adipose-derived stem cells,ADSC)具有分化的多向性,便于从患者自身组织获取,容易培养并且具有成瘤性低的特点,目前研究已证实中胚层来源的脂肪干细胞可以向多个方向分化,并且可以跨越胚层向其他胚层分化[6- 7]。本研究拟通过诱导ADSC分化为间介中胚层样细胞,然后与肾脏脱细胞支架共培养,以期构建有部分肾脏结构的组织工程肾脏,为慢性肾病的治疗提供选择。
材料和方法
材料健康雄性Wistar大鼠,6~8周龄,体质量约250 g,由山东大学动物实验中心提供;动物维护遵循全国营养学会和医学会的指导原则,并经山东大学第二医院伦理委员会备案和审批[批准号:KYLL- 2017 (GJ)A- 0011]。ADSC完全培养基(ADSC基础培养基+10%胎牛血清+1%双抗+1%谷氨酰胺)(美国Cyagen公司)、ADSC成骨诱导分化培养基(成骨分化基础培养基+10%胎牛血清+0.1 μmol/L地塞米松+50 μmol/L抗坏血酸+10 mmol/L β-磷酸甘油)(美国Cyagen公司)、ADSC成脂诱导分化培养基(成脂分化基础培养基+10%胎牛血清+1 μmol/L地塞米松+10 μmol/L胰岛素+200 μmol/L吲哚美辛+0.5 mmol/L甲基黄嘌呤)(美国Cyagen公司)、ADSC成软骨诱导分化培养基(成软骨分化基础培养基+10%胎牛血清+10 μg/L TGF-β3+0.1 μmol/L地塞米松+50 μmol/L维生素C+6.25 mg/L胰岛素)(美国Cyagen公司);糖原合成酶激酶3抑制剂(CHIR99021)(美国R&D公司)、成纤维生长因子9(fibroblast growth factor 9,FGF9)(美国R&D公司)、抗CD34流式抗体(美国Thermo公司)、抗CD45流式抗体(美国Thermo公司)、抗CD90 流式抗体(美国Thermo公司)、抗CD105流式抗体(美国Thermo公司)、抗锌指蛋白转录因子(odd-skipped related 1,OSR1)抗体(英国Abcam公司)、抗配对盒基因- 2(paired-box 2,PAX2)抗体(英国Abcam公司)、抗E-钙黏素(E-Cadherin,E-CAD)抗体(英国Abcam公司)、抗GATA结合蛋白- 3(GATA-binding protein,GATA3)抗体(英国Abcam公司)、抗Wilms肿瘤基因1(Wilms’tumor 1,WT1)抗体(英国Abcam公司)。WB电泳仪(美国伯乐公司)、WB转膜仪(美国伯乐公司)、WB显影仪(美国ProteinSimple公司)、荧光显微镜(日本Olympus公司)。
ADSC获取采用10%水合氯醛麻醉Wistar大鼠,斜行剪开腹股沟区皮肤,剪取1块脂肪垫,使用PBS清洗,并置于培养皿中加入等体积的0.1%的Ⅰ型胶原酶,37 ℃旋转消化1 h,至变为白色乳糜状,弃去没有被消化的组织,将消化物置于离心机中1500 r/min(r=13 cm)离心10 min后弃去上清,用脂肪间充质干细胞完全培养基重悬底部细胞团,接种到培养瓶中,置于37 ℃、5% CO2培养箱中,每2 d更换培养基去除未贴壁的细胞和组织,每天在光镜下观察待细胞密度达培养瓶80%后进行消化传代,获得ADSC。
ADSC的成骨、成脂、成软骨诱导及鉴定待ADSC细胞密度接近80%时更换成骨诱导培养基,每3 d换液,21 d后进行茜素红染色,观察分化情况。同样方法采用成脂诱导培养基诱导ADSC,每3 d换液,诱导14 d后进行油红O染色,观察分化情况。采用成软骨诱导分化培养基诱导ADSC,每3 d换液,诱导21 d后进行阿利新蓝染色,观察成软骨诱导情况。
ADSC流式鉴定采用0.25%胰酶消化ADSC细胞,待大部分细胞悬浮后以等量体积的培养基中和胰酶,将混合液转移至15 ml离心管内1200 r/min(r=13 cm)离心5 min后弃上清液,加入PBS洗2次后将细胞分为6组,浓度均调整至1×106/ml,终体积为100 μl,按照说明中稀释比例每组中分别加入CD34、CD45、CD90、CD105流式抗体,并采用相同来源的免疫蛋白作为阴性对照。避光孵育30 min后再用PBS洗2次以洗除未结合抗体,重悬细胞上机检测。
间介中胚层样细胞的诱导待ADSC在培养皿中密度接近50%时开始诱导,实验采用Takasato诱导人多能干细胞(induce pluripotent stem cells,iPSC)向间介中胚层分化的诱导方案开启诱导[8- 9],于第0天、第2天加入8 μmol/L CHIR99021,于第4天、第6天加入200 ng/ml的FGF9进行诱导,诱导至第7天后收获间介中胚层样细胞,置于镜下观察细胞形态。
间介中胚层样细胞的免疫荧光鉴定将诱导7 d的ADSC细胞爬片弃去培养基,使用PBS冲洗3次后加入细胞固定液固定30 min,用PBS洗净,加入Triton X- 100通透30 min,而后使用5%山羊血清封闭液封闭1 h,洗净封闭液后分别加入OSR1和PAX2两种间介中胚层特异性表面标志物抗体4 ℃孵育过夜,第2天用PBS冲洗后加入一抗所对应的荧光二抗,室温孵育1 h后加入DAPI进行核染,5 min后洗净多余DAPI进行封片处理,置于荧光显微镜下观察,同时以未诱导ADSC作为对照进行染色观察。
间介中胚层样细胞的Western blot鉴定将诱导7 d后的ADSC消化后加入蛋白裂解液。每个样品取10 μg 行 SDS-PAGE 凝胶电泳实验,将蛋白质转膜至PVDF膜上,5%脱脂奶粉室温封闭1 h,一抗(OSR1和PAX2) 4 ℃孵育过夜,次日采用HRP标记的二抗室温孵育 1 h后用化学发光试剂显影。
肾脏脱细胞支架的获取将Wistar大鼠取腹部正中切口,结扎肾动脉分支以上的腹主动脉后,离断肾动脉、肾静脉和输尿管获取肾脏,并在肾动脉和输尿管插套管针,用蠕动泵以500 μl/min流速由动脉端灌注0.5%SDS进行脱细胞处理,6 h后肾脏变为透明样,再以同样流速灌注无菌PBS以冲洗SDS和细胞碎片。
肾脏脱细胞支架的再细胞化将诱导得到的间介中胚层样细胞通过支架动脉端和输尿管端注入,同脱细胞支架进行共培养,置于自制肾脏体外培养系统进行循环灌注,保持37 ℃恒温,并持续通气进行培养,10 d后获得再细胞化的肾脏。
再细胞化的脱细胞肾脏支架鉴定对结合间介中胚层样细胞的肾脏脱细胞支架进行HE染色。将组织进行包埋、切片,并给予脱蜡和复水处理。其后依次进行苏木素和伊红染色,伊红染色结束后再逆梯度酒精进行脱水,最后进行封片处理,置于显微镜下观察,肾脏脱细胞支架HE染色方法同上。对再细胞化支架进行免疫荧光鉴定,鉴定肾脏的足细胞标志物WT1和肾小管标志物GATA3及E-CAD的表达情况。
结 果
ADSC的鉴定传至第4代的ADSC在光镜下呈长梭形(图1A),成骨诱导21 d后可见骨化结节形成(图1B),成脂诱导14 d后可见圆形脂滴形成(图1C),成软骨诱导21 d后可见软骨球形成(图1D)。流式鉴定结果显示,细胞表面标志物中CD90和CD105表达阳性,阳性率分别为98.7%和98.3%;CD34和CD45表达阴性,阳性率分别为2.5%和1.9%,以相同来源的免疫蛋白作为阴性对照进行染色,阳性率为1.1%(图1E)。
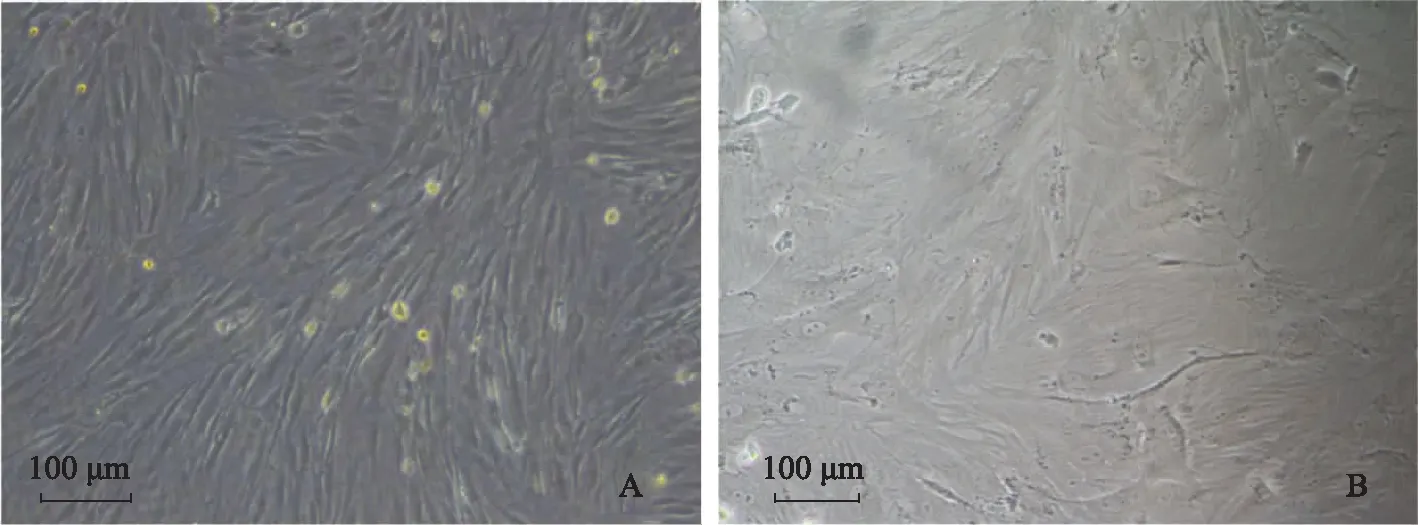
将ADSC向间介中胚层样细胞诱导后的形态观察利用体外培养不同时间点添加不同生长因子将ADSC向间介中胚层样细胞诱导7 d,可以观察到获得的间介中胚层样细胞形态较ADSC形态产生明显变化,细胞由长梭形逐渐变为扁平样的多边形(图2)。
间介中胚层样细胞的荧光鉴定将脂肪间充质干细胞向间介中胚层样细胞诱导,7 d后对细胞进行OSR1和PAX2两个间介中胚层特异性表面标志物的鉴定,结果显示可以观察到阳性表达,以ADSC做阴性对照,可以观察到上述两个标志物在ADSC中不表达(图3)。

ADSC:脂肪干细胞
ADSC:adipose-derived stem cells
A. ADSC光镜下形态;B.经成骨诱导后的茜素红染色;C.成脂诱导后的油红O染色;D.成软骨诱导后的阿利新蓝染色;E.流式检测ADSC标志物,CD90和CD105阳性率分别为98.7%和98.3%,CD34和CD45阳性率分别为2.5%和1.9%,相同来源的免疫蛋白作为阴性对照阳性率为1.1%(以上实验独立重复3次以上)
A.microscopic observation of ADSCs;B.alizarin red staining of ADSCs after osteogenic differentiation;C.oil red O staining of ADSCs after adipogenic differentiation;D.alcian blue staining of ADSCs after chondrogenic differentiation;E.surface marker analysis by flow cytometry:CD90 and CD105 were 98.7% and 98.3% and CD34 and CD45 were 2.5% and 1.9%,respectively
图1ADSC的成骨、成脂、成软骨诱导及流式鉴定
Fig1Induction of ADSCs adipogenic,osteogenic,chondrogenic differentiation and identification of ADSCs by flow cytometry
IM:间介中胚层
IM:intermediate mesoderm
A.ADSC诱导为间介中胚层样细胞分化前的细胞形态呈长梭形;B.诱导间介中胚层样细胞分化7 d后的细胞形态为扁平样多边形(以上实验独立重复3次以上)
A. ADSCs were spindle-shaped under microscope before induction;B. after induction of ADSCs into IM-like cells for 7 days,the cells became flat and polygonous (all these experiments repeated three times)
图2诱导脂肪干细胞分化为间介中胚层样细胞
Fig2Induction of ADSCs differentiate into IM-like cells

OSR1:锌指蛋白转录因子;PAX2:配对盒基因- 2;DAPI:4’,6-二脒基- 2-苯基吲哚
OSR1:odd-skipped related 1;PAX2:paired-bax 2;DAPI:4’,6-diamidino- 2-phenylindole
A.将诱导后获得的IM样细胞进行OSR1染色,可以观察到阳性表达,未诱导的ADSC为阴性表达;B.将IM样细胞进行PAX2染色,观察到阳性表达,未诱导ADSC为阴性表达(以上实验独立重复3次以上)
A. after induction of ADSC into IM-like cells,immunofluorescence of OSR1 showed positive results,with non-induced ADSCs as negative control;B. after induction of ADSCs into IM-like cells,immunofluorescence of PAX2 showed positive results,with non-induced ADSC as negative control (all these experiments repeated three times)
图3IM样细胞的鉴定
Fig3Identification of IM-like cells
间介中胚层样细胞的Western检测将诱导7 d所获得的间介中胚层样细胞进行Western blot验证,结果显示,以小鼠9.5 d胚胎躯干尾部位置的组织作为阳性对照,可以观察到诱导7 d后OSR1和PAX2的阳性表达,而诱导前的ADSC并没有观察到类似现象(图4)。
获取肾脏脱细胞支架取出大鼠肾脏,于肾动脉和输尿管插入套管针,由肾动脉灌注0.5%SDS,6 h后肾脏变为无色透明样,对取得的肾脏和肾脏脱细胞支架进行HE染色,可以观察到肾脏脱细胞支架中已无细胞结构,并且保留了正常肾脏的整体结构(图5)。
间介中胚层样细胞在脱细胞支架中的生长情况将间介中胚层样细胞从肾脏脱细胞支架的动脉端和输尿管端注入,结合支架共培养10 d后进行组织切片,通过HE染色可以观察到细胞在支架内均匀分布于肾小球,肾小管等部位(图6)。
间介中胚层样细胞在支架中的分化情况鉴定对再细胞化的支架进行免疫荧光鉴定,可以观察到E-CAD、GATA3和WT1的阳性表达(图7)。
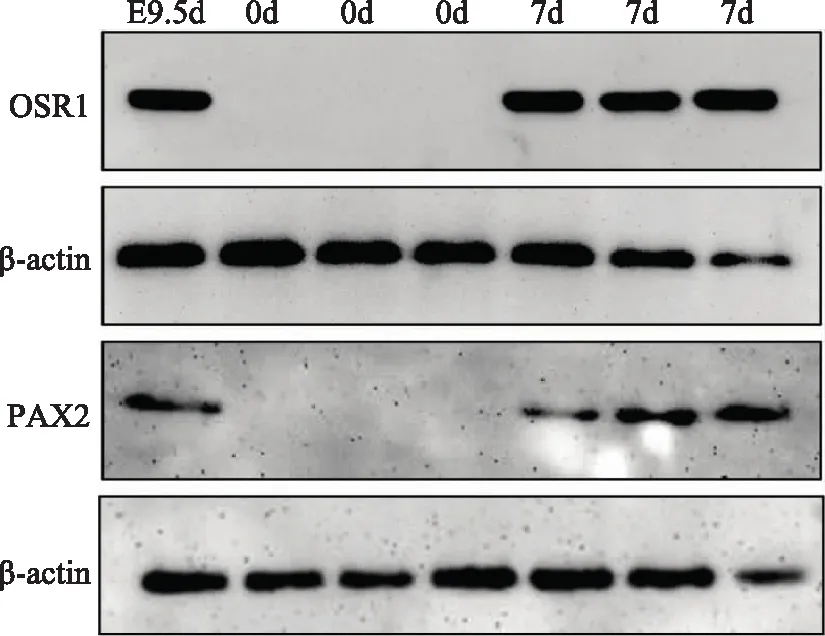
图4Western blot检测诱导前后OSR1和PAX2的表达情况,可以观察到诱导7 d后的细胞有阳性表达,而未诱导的细胞无此现象,以小鼠胚胎9.5 d组织作为阳性对照(以上实验独立重复3次以上)
Fig4Western blot for the detection of the expressions of PAX2 and OSR1 in ADSCs and IM-like cells,with mouse embryos at day 9.5(E9.5) a positive control;PAX2 and OSR1 were not expressed in ADSCs but were highly expressed in E9.5 and IM-like cells induced from ADSCs (all these experiments repeated three times)
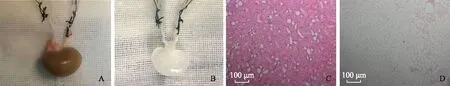
A.在大鼠肾脏肾动脉和输尿管插入留置针;B.经过6 h SDS灌注冲洗后大鼠肾脏由红色变为无色透明样;C.HE染色观察大鼠肾脏结构;D.HE染色观察肾脏脱细胞支架的结构,未见细胞成分(以上实验独立重复3次以上)
A.harvesting of kidney with arterial and ureteral cannulae;B. after 6 h of perfusion with SDS,the kidney became transparent;C.HE staining of normal kidney;D.HE staining of decllularized scaffold(all these experiments repeated three times)
图5脱细胞支架的制备与鉴定
Fig5Decellularization and identification of rat kidney scaffolds
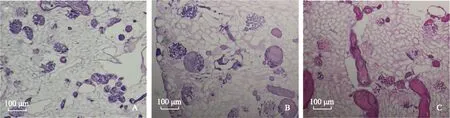
A.细胞分布整体情况;B.肾小球内的细胞分布;C.肾小管内的细胞分布情况
A.HE staining shows the gross appearance;B.cell distribution in the glomerulus region;C. cell distribution in in tubules
图6间介中胚层样细胞对脱细胞支架进行再细胞化
Fig6Recellularization of kidney scaffolds with IM-like cells
讨 论
在终末期肾病的治疗中,目前所采用的透析和肾脏移植并不能有效解决患者的疾病,透析可严重影响患者的生活质量,并产生心血管疾病及骨病等并发症[10];肾脏移植受供体短缺的限制而不能广泛应用,且患者需终身服用抗免疫排斥药物,给患者、家庭和社会带来巨大的经济负担[11]。肾脏再生研究的发展为慢性肾脏病、终末期肾病的治疗提供了一种新的策略。由于肾脏结构复杂,包括至少26种细胞[12],所以需要一种整体肾脏再生的方法。肾脏脱细胞支架具有正常肾脏结构,保留了细胞外因子,将脱细胞支架结合干细胞,可利用支架的微环境和细胞外基质所保留因子的作用诱导干细胞定向分化,产生肾脏结构,通过体内移植实现有结构和有功能的再生肾脏。
ADSC具有多向分化潜能并且成瘤性较低。经ADSC诱导的间介中胚层样细胞比胚胎干细胞和iPSC诱导所得细胞更加稳定。与其他干细胞相比,ADSC具有来源丰富、易培养、无免疫排斥、增殖速度快、能够跨胚层多向分化等优点。ADSC由中胚层分化而来,在特定的生长因子和环境诱导下可以向不同的细胞系分化,已经确认可以经过诱导成骨[13]、成脂[7]和成软骨分化[6],也可以分化为内胚层来源的肝细胞[14]、胰岛β样细胞[15]及外胚层来源的神经细胞[16]、心肌细胞[17]和上皮细胞[18]等。本研究则成功地在体外环境下将ADSC诱导分化为间介中胚层样细胞。因体外诱导获得的细胞未能完全模拟体内发育的间介中胚层而得到全部肾脏细胞类型,为将其与体内发育产生的间介中胚层细胞加以区分,本研究将体外诱导的细胞命名为间介中胚层样细胞,表示可以表达间介中胚层细胞的表面标志物OSR1和PAX2,并能经过诱导进一步分化为肾系细胞类型,但不能完全实现体内发育阶段的间介中胚层生物特性的一类细胞。
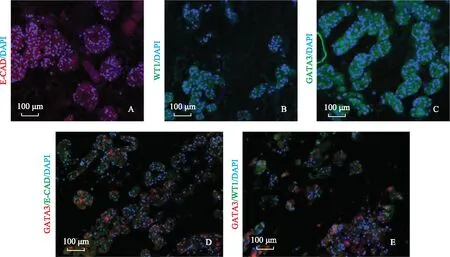
E-CAD:E-钙黏素;GATA3:GATA结合蛋白- 3;WT1:Wilms肿瘤基因- 1
E-CAD:E-cadherin;GATA3:GATA binding protein- 3;WT1:Wilms’tumor- 1
A.肾小管区域可见E-CAD阳性表达;B. 足细胞区域可见WT1阳性表达;C.肾小管区域可见GATA3阳性表达;D.GATA3与E-CAD共染;E.GATA3与WT1共染(以上实验独立重复3次以上)
A. expression of E-CAD in tubules;B. expression of WT1 in podocytes region;C. expression of GATA3 in tubules;D. expressions of GATA3 and E-CAD;E. expressions of GATA3 and WT1 (all these experiments repeated three times)
图7免疫荧光鉴定再细胞化肾脏
Fig7Identification of recellularized kidney by immunofluorescence
本研究对诱导所得的间介中胚层样细胞进行鉴定,进一步确定所诱导的细胞能够表达间介中胚层细胞标志物,随后将其作为种子细胞结合肾脏脱细胞支架用于肾脏再生研究。将间介中胚层样细胞和支架共培养10 d后可以观察到细胞黏附现象,免疫荧光鉴定可以发现间介中胚层样细胞结合支架可以产生肾小管样和足细胞样的分化,证明经过诱导的干细胞结合脱细胞支架后可以进一步分化,而在先前的研究中直接利用干细胞结合支架并不能观察到分化的情况,可见脱细胞支架具有诱导处于特定细胞阶段的干细胞分化的能力,可作为一种理想的生物材料用于肾脏再生研究。
以往研究显示,将干细胞结合脱细胞支架进行共培养后可以观察到干细胞在支架中贴附,但不能产生肾脏祖细胞或表达肾脏特有的标志物[19]。本研究则可观察到肾小管和足细胞标志物的表达,这是实现肾脏再生研究向前迈进的一步。目前,基于肾脏再生的研究主要集中在以下5种技术的应用:脱细胞支架[20]、囊胚互补[21]、后肾移植[22]、肾脏类器官[8]和生物人工肾[23]。其中,肾脏脱细胞支架结合干细胞是一种较为理想的肾脏再生方式。研究表明,肾脏脱细胞支架保持了原先肾脏的正常三维结构,并且支架内的细胞因子在脱细胞前后没有明显变化,这些细胞因子的存在使干细胞在支架内能够定向分化[24]。但有研究显示,单纯的未经诱导的干细胞在支架作用下并不能展现出良好的分化能力[25],考虑可能由于干细胞的分化方向多样,仅仅依靠支架内细胞因子的含量不足以使单纯未经诱导的干细胞定性分化为某种特定的成体细胞。此外,不同分化阶段的干细胞结合支架产生进一步分化所涉及的信号通路可能不同,未诱导干细胞结合支架所涉及的信号通路可能与干细胞自身分化的信号通路产生冲突,因而在支架内的干细胞不能展现出良好的定向分化能力。因此,本研究将干细胞首先诱导至间介中胚层样细胞阶段,再通过脱细胞支架的作用诱导间介中胚层样细胞向肾系分化,结果也证实了该思路的可行性。
总之,国内外研究所面临的问题是干细胞的贴附及分化效率不够令人满意,并且尚不能起到替代完整肾脏功能的作用,这也是我们今后研究的重点。一旦脱细胞支架技术能够成功,将会为终末期肾病的治疗提供新的选择。
