Y染色体性别决定基因相关的高速泳动蛋白家族9和胃动蛋白1在胃癌中的表达及其与预后的关系
2019-07-10陈江波徐国帅蔡相军刘洪涛孙凯丽
陈江波,徐国帅,蔡相军,刘洪涛,孙凯丽,罗 雪
1中国人民解放军北部战区总医院和平分院普通外科,沈阳 1100032中国医科大学研究生院,沈阳 1101223中国人民解放军北部战区总医院和平分院病理科,沈阳 110003
胃癌是全球范围内最主要的致死性癌症之一,2012年中国胃癌的死亡病例达到32.5万例[1]。中国胃肠肿瘤外科联盟的统计数据显示,2014~2016年在外科就诊的胃癌患者中,早期胃癌所占比例仅为19.5%[2],而胃癌的早期诊断与治疗是改善其预后的关键因素。近年研究表明,分析胃癌相关基因及其表达产物的变化对了解胃癌的生物学行为有重要意义。胃动蛋白1(gastrokine- 1,GKN1)是一种胃肠黏膜特异性表达蛋白,能够抑制上皮间质转化(epithelial-mesenchymal transition,EMT)并下调Wnt信号通路中β-catenin和cyclin D1的表达,发挥抑癌效应[3]。经典Wnt/β-catenin信号通路的异常活化与肿瘤(包括胃癌)的发生、发展密切相关。 Y染色体性别决定基因相关的高速泳动蛋白家族9(Sry-related high mobility group box 9,SOX9)蛋白既是Wnt/β-catenin信号通路的调节因子,也是其下游靶蛋白,作为转录因子,它与多种肿瘤的发生有关[4- 5],但在胃癌中的作用尚不明确且存在争议。SOX9和GKN1都与β-catenin密切联系,而两者在胃癌中表达的相关性及预后情况在国内外少有报道,本研究探讨了SOX9和GKN1在胃癌中的表达及其与患者临床病理因素和预后的关系,旨在为胃癌发病机制的探索及其诊断和治疗提供新的方向和思路。
对象和方法
对象2012年1月至2013年5月于中国人民解放军北部战区总医院和平分院收治并手术治疗的70例胃癌患者,收集所有患者的临床资料并根据病例号选取相应的病理蜡块(包括胃癌和癌旁组织)。纳入标准:(1)术前未行放化疗及靶向药物治疗;(2)肿瘤为原发病灶且术前、术中均未发现远处转移;(3)术式为D1或D2胃癌根治术,受检淋巴结≥15个;(4)术后标本均经病理证实为腺癌,病理资料完整;(5)癌旁组织距离肿瘤边缘≥5 cm。70例胃癌患者中,男52例,女18例;平均年龄(61.7±10.2)岁(32~82岁),平均肿瘤大小为(4.3±2.5)cm(0.5~11.0 cm)。肿瘤分期参照2010年由美国癌症联合委员会(American Joint Committee on Cancer,AJCC)发布的第7版TNM分期标准[6],因纳入的胃癌患者均无远处转移,故本研究无Ⅳ期病例。70例癌旁胃黏膜组织中,27例为肠化生组织,43例为正常胃黏膜组织。本研究获中国人民解放军北部战区总医院和平分院伦理委员会批准,所有患者均签署知情同意书。
免疫组织化学染色采用免疫组织化学SP法对70例胃癌标本和相应癌旁组织进行染色,具体为:石蜡标本经4 μm连续切片,脱蜡、水化,pH6.0柠檬酸盐修复液中高压抗原修复;3%H2O2消除内源性过氧化物酶活性后用正常山羊血清封闭组织中的非特异性结合位点;滴加一抗SOX9(1∶ 400)或GKN1(1∶ 400),4℃孵育过夜。复温并洗涤后滴加二抗和HPR标记的链霉卵白素;DAB显色5 min;自来水冲洗后用苏木紫复染、分化、返蓝;脱水、透明、中性树脂封片。选择已知的阳性切片作为阳性对照,以PBS溶液(pH=7.3)代替一抗作阴性对照。染色结果由2名副高以上的病理科医师采用双盲法进行判定,按细胞着色程度评分:(1)无着色,0分;(2)浅黄色,1分;(3)棕黄色,2分;(4)棕褐色,3分。每张切片按白细胞计数法随机连续选择 10个高倍视野(10×40),各计数100个细胞,按阳性细胞比例的平均值评分:(1)<5%,0分;(2)6%~25%,1分;(3)26%~50%,2分;(4)51%~75%,3分;(5)>75%,4分。最后以两项评分的乘积判定结果:(1)0分,阴性;(2)1~3分,弱阳性;(3)4~6分,中度阳性;(4)7~12分,强阳性。统计分析时,≥4分定为高表达,<4分定为低表达。
临床随访与记录通过患者门诊、病房复查及电话回访等方式对其进行术后随访,随访起止日期为2012年1 月9日至2018年5月31日。终点事件定义为患者死于胃癌复发或转移,删失数据包括随访日期截止患者仍存活、患者失访、患者死于其他病因或意外。记录患者的生存时间,以月为单位。
统计学处理采用SPSS 19.0统计软件,计数资料间的比较采用Pearsonχ2或连续性校正的χ2检验,多个计数资料间的多重比较采用χ2分割法;采用Kaplan-Meier法绘制生存曲线,两组患者生存率的比较采用Log-rank检验;对可能影响胃癌预后的因素进行Cox单因素分析,将P<0.05的变量纳入Cox比例风险回归模型进行多因素分析,其中χ2分割法根据比较次数重新规定检验水准,P<0.05为差异有统计学意义。
结 果
SOX9蛋白在胃癌组织、肠化生组织和正常胃黏膜组织中的表达在正常胃黏膜中,SOX9的阳性染色主要定位于胞浆;在胃癌组织中以胞核、胞浆混合性表达为主,其胞核染色明显增强(图1)。SOX9在胃癌组织、肠化生组织和正常胃黏膜组织中的高表达率分别为92.9%(65/70)、77.8%(21/27)和55.8%(24/43),差异有统计学意义(χ2=21.722,P<0.001);其中,SOX9在胃癌组织中的高表达率明显高于正常胃黏膜组织(χ2=21.850,P<0.001)。单独观察胞核内染色发现,SOX9在胃癌组织、肠化生组织和正常胃黏膜组织中的高表达率依次为67.1%(47/70)、37.0%(10/27)和23.3%(10/43),差异有统计学意义(χ2=22.129,P<0.001);其中,SOX9在胃癌组织胞核内的高表达率明显高于肠化生组织(χ2=7.288,P=0.007)和正常胃黏膜组织(χ2=20.524,P<0.001)(表1)。
GKN1蛋白在胃癌组织、肠化生组织和正常胃黏膜组织中的表达GKN1主要在正常胃黏膜中表达,阳性染色定位于胞浆(图2)。在胃癌组织、肠化生组织和正常胃黏膜组织中,GKN1的高表达率分别为37.1%(26/70)、44.4%(12/27)和76.7%(33/43),差异有统计学意义(χ2=17.239,P<0.001);其中,GKN1在正常胃黏膜组织中的高表达率明显高于肠化生组织(χ2=7.537,P=0.006)和胃癌组织(χ2=16.742,P<0.001)(表1)。
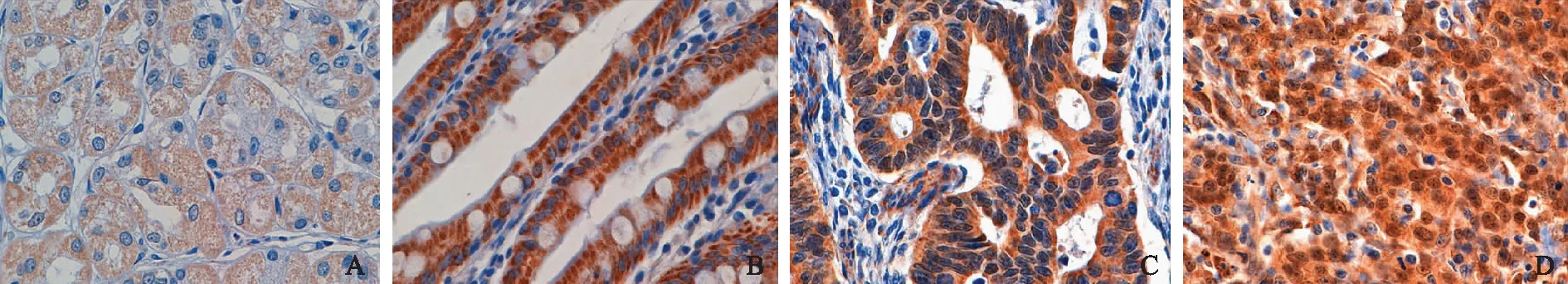
SOX9:Y染色体性别决定基因相关的高速泳动蛋白家族9
SOX9:Sry-related high mobility group box 9
A.正常胃黏膜组织中低表达(胞浆弱阳性,胞核阴性);B.肠化生组织中高表达(胞浆强阳性,部分胞核弱阳性);C.中分化胃癌中高表达(胞浆强阳性,胞核中度阳性);D.低分化胃癌中高表达(胞浆、胞核均强阳性)
A. low expression in normal gastric mucosa(weakly positive staining in cytoplasm and negative staining in nucleus);B.high expression in intestinal metaplasia(strongly positive staining in cytoplasm and weakly positive staining in parts of the nucleus);C.high expression in moderately differentiated gastric cancer(strongly positive staining in cytoplasm and moderately positive staining in nucleus);D. high expression in poorly differentiated gastric cancer(strongly positive staining in both nucleus and cytoplasm)
图1SOX9在胃癌和癌旁组织中的表达(免疫组织化学染色,×400)
Fig1Expression of SOX9 in gastric carcinoma and adjacent tissue(immunohistochemistry,×400)
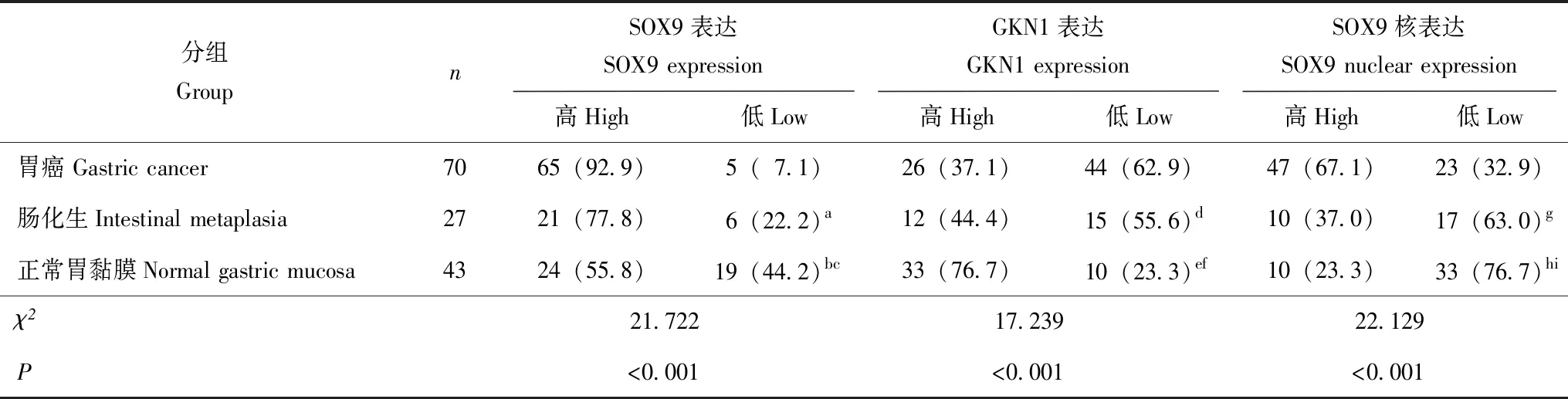
表1 SOX9和GKN1在胃癌组织、肠化生组织和正常胃黏膜组织中的表达[n(%)]Table 1 Expressions of SOX9 and GKN1 in gastric cancer,intestinal metaplasia,and normal gastric mucosa[n(%)]
SOX9:Y染色体性别决定基因相关的高速泳动蛋白家族9;GKN1:胃动蛋白1;多个样本率间的两两比较采用χ2分割法,组数为3时,α’=0.0125;与胃癌组比,a:连续校正的χ2=3.034,P=0.082;b:χ2=21.850,P<0.001;d:χ2=0.436,P=0.509;e:χ2=16.742,P<0.001;g:χ2=7.288,P=0.007;h:χ2=20.524,P<0.001;与肠化生组比:c:χ2=3.485,P=0.062;f:χ2=7.537,P=0.006;i:χ2=1.543,P=0.214
SOX9:Sry-related high mobility group box 9;GKN1:gastrokine- 1;χ2segmentation method was used in multiple comparisons among multiple sample rates when the number of groups is 3,α’=0.0125;a:χ2test with continuity correction,χ2=3.034,P=0.082;b:χ2=21.850,P<0.001;d:χ2=0.436,P=0.509;e:χ2=16.742,P<0.001;g:χ2=7.288,P=0.007;h:χ2=20.524,P<0.001 compared with gastric cancer group;c:χ2=3.485,P=0.062;f:χ2=7.537,P=0.006;i:χ2=1.543,P=0.214 compared with intestinal metaplasia group

GKN1:胃动蛋白1
GKN1:gastrokine- 1
A.正常胃黏膜组织中高表达(强阳性);B.肠化生组织中高表达(中度阳性);C.高分化胃癌中低表达(弱阳性);D.低分化胃癌中低表达(阴性)
A. high expression in normal gastric mucosa(strongly positive);B.high expression in intestinal metaplasia(moderately positive);C. low expression in well-differentiated gastric cancer(weakly positive);D.low expression in poorly-differentiated gastric cancer(negative)
图2GKN1在胃癌和癌旁组织中的表达(免疫组织化学染色,×400)
Fig2Expression of GKN1 in gastric carcinoma and adjacent tissue(immunohistochemistry,×400)
胃癌组织中GKN1的表达和SOX9在胞核内的表达与临床病理特征的关系胃癌组织中,SOX9在胞核内的表达与组织分化程度有关(χ2=9.922,P=0.007),其在低分化胃癌胞核内的表达明显高于高分化胃癌(校正χ2=7.531,P=0.006);而GKN1的表达与组织的分化程度(χ2=12.113,P=0.002)和是否为印戒细胞癌有关(χ2=6.746,P=0.009),其在印戒细胞癌中的表达明显低于其他病理类型的胃腺癌,在低分化胃癌中的表达显著低于高分化(校正χ2=7.531,P=0.006)和中分化胃癌(χ2=7.249,P=0.007)(表2)。

表2 GKN1的表达和SOX9在胞核内的表达与胃癌患者临床病理特征的关系[n(%)]Table 2 Relationships of the GKN1 expression and the nuclear expression of SOX9 in gastric cancer tissue with the clinicopathological features of gastric cancer patients[n(%)]
多个样本率间的两两比较采用χ2分割法,组数为3时,α’=0.0125;与低分化胃癌组比,a:连续性校正的χ2=7.531,P=0.006;c:χ2=2.963,P=0.085;d:连续性校正的χ2=7.531,P=0.006;f:χ2=7.249,P=0.007;与中分化胃癌组相比,b:连续性校正的χ2=1.567,P=0.211;e:连续校正的χ2=0.324,P=0.569
χ2segmentation method was used in multiple comparisons between multiple sample rates,when the number of groups is 3,α’=0.0125;a:χ2test with continuity correction,χ2=7.531,P=0.006;c:χ2=2.963,P=0.085:d:χ2test with continuity correction,χ2=7.531,P=0.006;f:χ2=7.249,P=0.007 compared with poorly differentiated gastric cancer;b:χ2test with continuity correction,χ2=1.567,P=0.211;e:χ2test with continuity correction,χ2=0.324,P=0.569 compared with moderately differentiated gastric cancer
胃癌组织中SOX9在胞核内的表达与GKN1表达的相关性70例患者中,胃癌组织中SOX9胞核内高表达47例,其中,GKN1高表达10例,GKN1低表达37例;SOX9胞核内低表达23例,其中,GKN1高表达16例,GKN1低表达7例;SOX9在胞核内的表达与GKN1的表达呈显著负相关(χ2=15.424,P<0.001)。
预后分析70例胃癌患者的中位随访时间为42.5个月(5~75个月),其中6例失访,38例死亡,随访率为85.71%;中位生存时间为51个月(95%CI:33.7~68.3个月);术后5年总生存率为45.0%。将病例分组后采用Kaplan-Meier法绘制生存曲线,结果显示,SOX9在胞核内高表达组与低表达组的患者中位生存时间分别为39个月(95%CI:21.7~56.3个月)和>71个月;5年生存率分别为33.8%和 67.5%,差异有统计学意义(χ2=5.811,P=0.016)(图3)。GKN1高表达组和低表达组的患者中位生存时间分别为>71个月和39个月(95%CI:22.9~55.1个月);5年生存率分别为60.0%和35.6%,差异有统计学意义(χ2=4.062,P=0.044)(图4)。进一步研究表明,在37例SOX9胞核内高表达且GKN1低表达的胃癌患者中,中位生存时间为37个月(95%CI:26.2~47.8个月),5年生存率为28.8%。

图3SOX9在胃癌组织胞核内高表达组与低表达组患者的生存曲线
Fig3Survival curves of patients with high and low nuclear expressions of SOX9 in gastric cancer
以患者是否因胃癌复发或转移而死亡与患者的生存时间作为应变量,单因素Cox回归分析结果表明,胃癌的大体类型、浸润深度、淋巴结转移情况、TNM分期、分化程度、GKN1的表达水平和SOX9在胞核内的表达水平与胃癌患者的生存期有关(P均<0.05)。将这些变量(浸润深度和淋巴结转移已经体现在TNM分期中,故未纳入)纳入Cox比例风险回归模型,进一步多因素结果分析显示,TNM分期晚(Ⅱ期:HR=7.435,95%CI:1.313~42.096,P=0.023;Ⅲ期:HR=12.214,95%CI:2.677~55.721,P=0.001)和SOX9蛋白在胞核表达水平高(HR=3.297,95%CI:1.199~9.065,P=0.021)是影响胃癌患者预后的独立危险因素(表3)。

图4GKN1在胃癌组织中高表达组与低表达组患者的生存曲线
Fig4Survival curves of patients with high and low expression of GKN1 in gastric cancer

表3 Cox比例风险回归模型对胃癌患者预后的单因素和多因素分析Table 3 Univariate and multivariate analyses of the prognosis of gastric cancer patients by Cox proportional hazard regression model
讨 论
SOX基因家族由Y染色体的性别决定区域(sex determination region of Y Chromosome,SRY)相关的基因组成,SOX9是SOX家族的E亚组成员之一[7],在成体(包括胃肠道)干细胞的分化和自我更新中发挥关键作用,在多种不同来源的肿瘤中表达并存在差异[8]。SOX9已被确定为β-catenin的下游靶蛋白,两者之间存在调控环,经典Wnt/β-catenin信号通路的过度活化与胃癌的发生相关[4- 5],而SOX9在胃癌中的相关研究较少,且结果存在争议。Liu等[9]通过免疫组化染色发现SOX9在胃癌组织中表达增加,并与TNM分期和淋巴结转移相关。其他实验也表明,SOX9 在晚期胃癌中过度表达[5,10],并与肿瘤的侵袭和转移有关[10]。也有研究显示,SOX9在早期胃癌中高表达,但在晚期胃癌的表达出现下调[11- 12]。 Zhang等[13]同样发现SOX9在胃癌中表达上调,但未得出与临床病理因素存在相关性的结论。本研究结果显示,SOX9在正常胃黏膜组织、肠化生组织和胃癌组织中的表达依次升高,其高表达率分别为55.8%、77.8%和92.9%,与Liu等[9]研究结果相似。SOX9的阳性染色定位于胞核与胞浆,其在胃癌组织胞核内的高表达率(67.1%)明显高于肠化生组织(37.0%)和正常胃黏膜组织(23.3%);进一步研究发现,在胃癌组织中,SOX9在胞核内的表达水平与组织的分化程度相关,但与TNM分期等其他临床病理因素无关,而Choi等[12]认为SOX9在晚期胃癌中表达下调,本研究则发现SOX9在Ⅰ、Ⅱ和Ⅲ期胃癌中胞核内的高表达率分别为72.0%、40.0%和71.4%,差异无统计学意义,后续可纳入Ⅳ期胃癌标本并增加样本量进一步证实。这些研究结果表明,SOX9在胃癌组织中的过度表达以胞核染色增加为主要表现。这一生物学行为可能与胃癌的发生和发展密切相关,其在胞核内的表达水平可能直接或间接影响肿瘤的恶性程度,结合转录因子的特点,笔者推测这种生物学行为可能是SOX9蛋白在胞质内合成增多并过度活化而进入细胞核参加转录调控的过程,深入研究SOX9的入核与转录调控机制可能有助于胃癌发病机制的认识及其生物学行为的干预。
GKN1是胃动蛋白家族的成员之一,在人胃黏膜组织的表达具有促进上皮细胞的增殖和损伤后修复等作用。Yoon等[14]采用免疫组织化学方法分别在36例(90%)和170例(89.5%)腺瘤和胃癌患者中检测到GKN1表达的减少或缺失。本研究结果显示,GKN1在正常胃黏膜中表达丰富(76.7%),在肠化生和胃癌组织中表达下降,其高表达率分别为44.4%和37.1%,与Mao等[15]研究结论一致。此外本研究还发现,GKN1在胃癌中的表达降低与组织的分化程度和病理类型是否为印戒细胞癌相关,这同样提示GKN1的表达下调与胃癌的恶性程度有关。如上所述,GKN1在胃黏膜处于癌前病变时便开始出现表达下降,这可能与早期胃癌的发生有关,目前已有不少相关分子机制的研究,但无明确的定论。Yoon等[16- 17]研究认为,GKN1可抑制与幽门螺杆菌感染相关的CagA所产生的致癌作用,并通过降低RhoA的表达来阻止胃癌细胞的侵袭和迁移。GKN1也可能通过P21waf和p16/Rb通路的活化来诱导胃癌细胞的衰老和凋亡[18]。此外,GKN1的表达能够抑制EMT和胃癌细胞的迁移,这伴随着E-cadherin的重新表达和β-catenin的表达下降[3],SOX9则通过 Wnt/β-catenin 通路影响胃癌细胞的增殖。本研究结果表明,在胃癌组织中,SOX9在胞核内的表达与GKN1的表达呈负相关,与Choi等[12]研究结果一致,其体外实验还证明,GKN1的异常表达能够抑制SOX9在AGS和MKN- 1胃癌细胞中的表达。但两者的直接调控关系有待深入研究。
既往研究显示,SOX9在结直肠癌中的过度表达影响了患者术后的生存时间[19]。本研究随访结果发现,SOX9在胃癌组织胞核内的高表达和TNM分期晚是影响患者预后的独立危险因素。Santos等[5]也认为SOX9的高表达与胃癌患者较低的总生存率和无病存活率相关,但Choi等[12]研究认为,SOX9在胃癌中的过度表达与患者总体生存率的关系无统计学意义。Moss 等[20]研究发现,GKN1在肠型胃癌中表达下降与不良预后有关。结合本研究结果,GKN1虽不是胃癌患者的独立预后因素,但在低表达组中,患者的中位生存时间和5年生存率明显低于高表达组,提示前者预后相对较差,后续研究可增加样本量后进一步探讨。本研究还发现,在SOX9胞核高表达且GKN1低表达胃癌患者中,其中位生存时间和5年生存率更低,结合两蛋白在胃癌中的表达的负相关性,同时检测两者在胃癌中的表达可能更有助于患者的预后评估。
综上,本研究结果发现,SOX9在胃癌组织中的表达增加,其在胞核内的表达水平与组织分化程度有关;而GKN1在胃癌组织中的表达下降,其表达水平与组织分化程度和是否为印戒细胞癌有关;两者表达呈负相关,SOX9和GKN1的表达变化可能在胃癌的恶性生物学行为中发挥重要作用。SOX9在胃癌组织胞核内的高表达和TNM分期晚是影响患者预后的独立危险因素,SOX9可能是胃癌患者的潜在预后标志物。联合检测SOX9和GKN1的表达情况并进一步研究其分子作用机制可能为胃癌的早期诊断、靶向治疗以及预后评估提供新思路。
(志谢:感谢中国医科大学硕士研究生导师蔡相军和刘洪涛教授在实验设计、实施以及论文撰写中提出的宝贵意见;感谢实验室老师提供的技术指导;感谢北部战区总医院和平分院普外科、病案室为研究提供了详细的临床病例资料;感谢病理科为实验提供了宝贵的病理资料和蜡块组织并协助完成了实验后期的阅片评分工作)
