帕瑞昔布对缺血再灌注后肺组织血红素加氧酶-1表达水平及凋亡程度的影响*
2019-07-06吕强刘宇胡云霞李美亭
吕强,刘宇,胡云霞,李美亭
(四川省医学科学院·四川省人民医院 麻醉科,四川 成都 610072)
肺缺血再灌注(ischemia reperfusion,IR)时,中性粒细胞在肺内聚集,炎症介质释放,活性氧(reactive oxygen species,ROS)生成增加,引起细胞和组织损伤,甚至发生肺衰竭。
血红素加氧酶-1(heme oxygenase-1,HO-1)表达增加是细胞应激过程中最重要的保护机制之一。研究显示,HO-1 表达增加可减轻肺IR 损伤及内毒素诱发的急性肺损伤[1-2]。HO-1 的保护作用与其抗氧化、维持微环境稳定、抗炎症反应和抗凋亡有关[3]。
帕瑞昔布为特异性环氧化酶-2(Cyclooxygenase 2,COX-2)抑制剂。ZHANG 等[4]在大鼠肝IR 时发现,帕瑞昔布预处理可抑制炎症反应及氧化应激而减轻肝脏损伤。抑制COX-2 也可减轻脑、肾IR 损伤,以及骨骼肌IR 引起的肺损伤[5-7]。另外,COX-2特异性抑制剂还可经过ROS 途径诱导血管平滑肌细胞和巨噬细胞表达HO-1[8]。帕瑞昔布能否减轻肺IR损伤;是否与肺组织内HO-1 表达变化有关还不清楚。本研究用不同剂量帕瑞昔布处理肺IR,检测肺内丙二醛(Malondialdehyde,MDA)和髓过氧化物酶(Myeloperoxidase,MPO)、肺组织病理改变、凋亡程度及HO-1 表达情况,探讨帕瑞昔布对肺IR 损伤的影响机制,以及是否与剂量相关。
1 材料与方法
1.1 实验动物与试剂
40 只无特定病原体(SPF)级健康雄性成年SD大鼠(280~300g),购于四川省人民医院实验动物研究所,动物许可证号:SCXKU1172013-15。MDA和MPO 试剂盒(南京建成生物工程研究所),TUNEL试剂盒(上海碧云天生物技术有限公司),Trizol 试剂(美国Invitrogen 公司),逆转录试剂盒(德国Qiagen公司),HO-1 抗体(武汉三鹰生物技术有限公司)。
1.2 实验方法
1.2.1 动物分组与模型复制将大鼠随机分为5 组(每组8 只):对照组(C 组)、缺血再灌注组(IR 组)、帕瑞昔布低剂量组(L 组,2mg/kg)、帕瑞昔布中剂量组(M组,10mg/kg)及帕瑞昔布高剂量组(H 组,20mg/kg)。C 组仅游离出左侧肺门,其余各组根据文献[9],复制大鼠单侧肺IR 模型,IR 组单纯阻断左侧肺门;L 组、M 组和H 组分别在阻断左侧肺门前15min,经股静脉注射帕瑞昔布2、10 及20mg/kg。实验过程中,经股静脉给予C 组和IR 组大鼠等体积生理盐水。
1.2.2 标本收集左肺缺血60min,再灌注120min后,放血处死大鼠,立即取出左肺,剪为上、中、下3部分。
1.2.3 肺组织湿重/干重计算取出左肺上段组织后,立即称量湿重,随后放入80℃烘箱内干燥48h,称量干重,并计算湿重/干重。
1.2.4 MDA 及MPO 检测取部分左肺中段组织匀浆,离心后吸取上清液,根据试剂盒操作指南分别检测肺内MDA 和MPO 含量。
1.2.5 观察肺病理改变取左肺下段组织,用4%多聚甲醛固定3d。然后用石蜡包埋并切片,厚度10μm。经HE 染色,并用光学显微镜观察肺泡形态、结构改变及肺间质水肿等变化。
1.2.6 肺组织凋亡细胞检测根据TUNEL 凋亡试剂盒说明书操作完成后,在光学显微镜下随机读取每张切片中的5 个视野,阳性细胞数/总细胞数×100%即为凋亡指数(apoptotic index,AI)。
1.2.7 逆转录聚合酶链反应(RT-PCR)检测肺内HO-1 mRNA 表达取左肺中段组织,用Trizol 试剂抽提总RNA,逆转录试剂盒逆转录为cDNA,以β-actin 为内参照,引物序列见表1。反应条件为:95℃预变性60s,95℃变性15s,54℃退火20s,70℃延伸40s,40 个循环后,70℃延伸5min。根据每组RT-PCR 的Ct 值,用2-ΔΔCt计算目的基因mRNA 的相对表达量。

表1 HO-1 及β-actin 引物序列
1.2.8 肺内HO-1 蛋白检测使用Western blotting检测HO-1 蛋白质含量。经电泳、转膜、封闭后,加入HO-1 抗体(1 ∶1000 稀释),置于4℃冰箱16h。漂洗后,加入β-actin 抗体(1 ∶10000 稀释),室温孵育1 h。滴加显影液,采集图像。图像用Image J 软件进行分析,相对定量HO-1 蛋白表达丰度。
1.3 统计学方法
数据分析采用SPSS 17.0 统计软件,经正态性检验,计量资料符合正态分布,以均数±标准差(±s)表示,方差齐时,组间比较采用单因素方差分析,两两比较用LSD-t检验,方差不齐时采用Games-Howell检验,P<0.05 为差异有统计学意义。
2 结果
2.1 肺组织湿重/干重
各组湿重/干重值比较,差异有统计学意义(P<0.05)。与C 组比较,其余4 组湿重/干重值均升高(P<0.05),其中IR 组升高最明显,其次为L 组,而M 组和H 组升高最少(P<0.05),且M 组和H 组差异无统计学意义(P>0.05)。见表2。
2.2 MDA 含量及MPO 活性
各组MDA 含量及MPO 活性比较,差异有统计学意义(P<0.05)。与C 组比较,其余4 组肺内MDA 含量升高,MPO 活性增强;IR 组MDA 含量及MPO 活性增加最多,L 组次之,M 组和H 组增加较少。除M组和H 组组间差异无统计学意义(P>0.05)外,其余各组间差异有统计学意义(P<0.05)。见表2。
2.3 肺组织AI 情况
各组AI 比较,差异有统计学意义(P<0.05)。C 组肺组织中仅可见少量凋亡细胞,IR 组凋亡细胞增加,L组肺组织中凋亡细胞也增加,但较IR 组减少(P<0.05),M 组和H 组凋亡细胞也增加,但较IR 组和L 组进一步减少(P<0.05)。见表2 和图1。
2.4 肺组织病理改变
C 组肺泡结构基本完整;IR 组肺泡破坏严重,肺泡壁增厚明显,伴有大量炎症细胞浸润;L 组肺损伤较IR 组减轻,M 和H 组肺损伤较L 组进一步改善,肺泡较完整,炎症细胞浸润减少。见图2。
2.5 肺组织HO-1 表达水平
各组HO-1 mRNA 和蛋白表达比较,差异有统计学意义(P<0.05)。C 组肺组织中HO-1 mRNA 和蛋白仅有少量表达,IR 组和L 组较C 组高(P<0.05),M 组和H 组较L 组进一步增加(P<0.05)。H 组较M组HO-1 mRNA 表达增加(P<0.05),但HO-1 蛋白表达差异无统计学意义(P>0.05)。见表3。
表2 各组湿重/干重、MDA、MPO 及AI 比较 (n=8,±s)

表2 各组湿重/干重、MDA、MPO 及AI 比较 (n=8,±s)
注:1)与C 组比较,P<0.05;2)与IR 组比较,P<0.05;3)与L 组比较,P<0.05
组别 湿重/干重 MDA/(nmol/mg) MPO/(u/g) AI/%C 组 4.29±0.40 1.60±0.15 1.71±0.16 2.14±0.60 IR 组 5.81±0.631) 3.65±0.351) 3.55±0.321) 31.17±3.581)L 组 5.41±0.321)2) 3.21±0.301)2) 2.98±0.251)2) 26.89±3.891)2)M 组 4.93±0.421)2)3) 2.39±0.281)2)3) 2.45±0.161)2)3) 18.16±3.641)2)3)H 组 4.84±0.291)2)3) 2.24±0.231)2)3) 2.30±0.251)2)3) 17.34±2.761)2)3)F 值 14.558 72.471 69.892 63.322 P 值 0.000 0.000 0.000 0.000
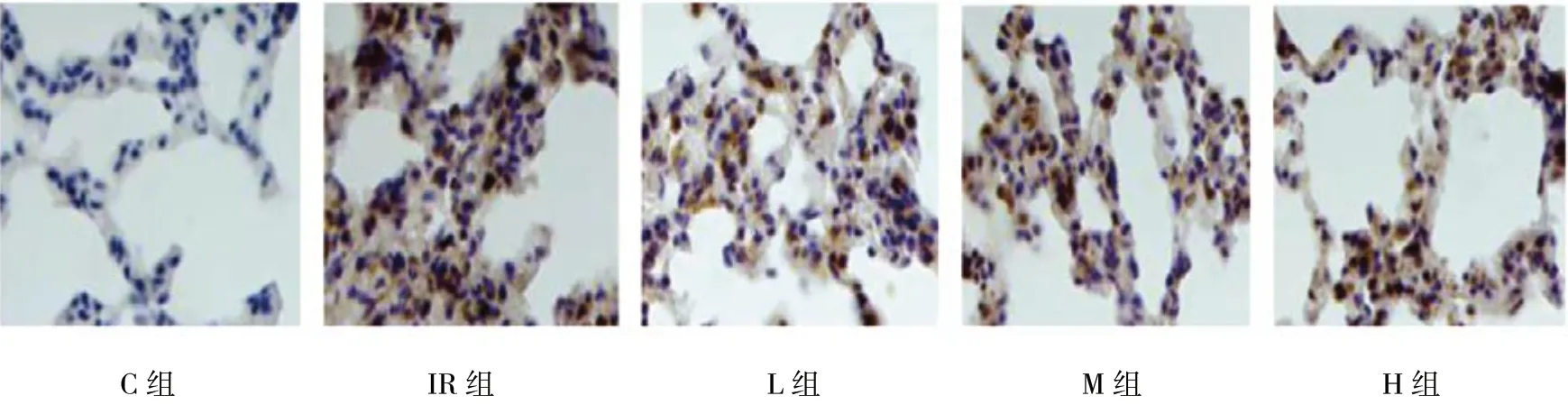
图1 各组肺组织凋亡细胞 (TUNEL×400)

图2 各组肺组织病理改变 (HE×200)
表3 各组肺组织HO-1 mRNA 和蛋白表达比较 (n=8,±s)
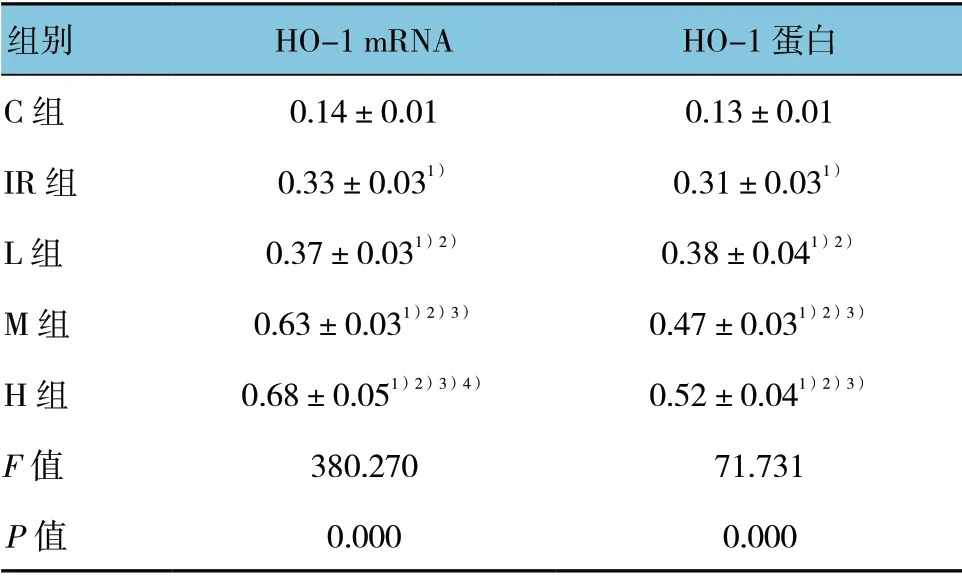
表3 各组肺组织HO-1 mRNA 和蛋白表达比较 (n=8,±s)
注:1)与C 组比较,P<0.05;2)与IR 组比较,P<0.05; 3)与L 组比较,P<0.05;4)与M 组比较,P<0.05
组别 HO-1 mRNA HO-1 蛋白C 组 0.14±0.01 0.13±0.01 IR 组 0.33±0.031) 0.31±0.031)L 组 0.37±0.031)2) 0.38±0.041)2)M 组 0.63±0.031)2)3) 0.47±0.031)2)3)H 组 0.68±0.051)2)3)4) 0.52±0.041)2)3)F 值 380.270 71.731 P 值 0.000 0.000
3 讨论
肺IR 时,中性粒细胞在肺内聚集、活化,引起肺组织炎性损伤;另外,ROS 生成增加,还可引起肺组织氧化损伤。该因素均可导致肺血管内皮屏障受损,通透性升高,因此,肺IR 后,使得大量血浆成分渗出,容易出现肺间质水肿。肺组织湿重/干重值可以间接反映液体渗出程度。MDA 为脂质过氧化反应的终末产物,肺IR 时,肺组织中MDA 含量与氧自由基生成呈正相关[10]。在IR 肝损伤研究中发现,选择性COX-2 抑制剂可降低MDA、诱导型一氧化氮合酶(iNOS)等氧化应激产物的生成[11]。MPO 主要存储于中性粒细胞的嗜天青颗粒内,因此,肺组织中MPO 活性可间接反映肺组织中中性粒细胞浸润程度。
本研究发现,肺IR 后,肺组织湿重/干重值增加;MDA 含量和MPO 活性均升高。给予帕瑞昔布2 mg/kg可降低湿重/干重值,降低MDA 含量和MPO 活性;给予帕瑞昔布10 mg/kg,以上指标降低更多;给予帕瑞昔布20 mg/kg,并未进一步改善,表明帕瑞昔布可减轻IR引起的肺间质水肿,减少中性粒细胞在肺内聚集,抑制脂质过氧化反应,在一定程度上呈剂量依赖性。
本研究结果显示,不同剂量帕瑞昔布预处理均可减轻IR 肺损伤,减少肺组织内细胞凋亡。在IR 损伤、炎症、应激等情况下,多种因素促进COX-2 表达增加,并在组织损伤过程中发挥作用,因此,阻断COX-2 而具有抗炎特性[12]。同样,在肺IR 时,肺内COX-2 表达水平也上升[13]。在呼吸机诱导的肺损伤时,帕瑞昔布可减轻局部及全身炎症反应,降低肺泡上皮通透性、减轻肺间质水肿;还可减少细胞凋亡[14]。所以,帕瑞昔布可能从多个环节减轻IR 肺损伤。
本研究还发现,帕瑞昔布增加IR 肺组织内HO-1表达;随着帕瑞昔布剂量增加,HO-1 mRNA 逐渐增加,然而帕瑞昔布10 mg/kg 和帕瑞昔布20 mg/kg 处理后HO-1 蛋白并无变化。有研究显示,使用高浓度特异性COX-2 抑制剂时,可能会失去选择性,而同时抑制COX-1[15]。因此,大剂量帕瑞昔布,是否会通过COX-1 途径在转录水平影响HO-1 表达还需进一步研究。
HO-1 具有抗炎、抗凋亡和抗氧化等特性。肺缺血后处理可通过增加HO-1 表达,而减轻肺IR 损伤[16]。HO-1 还能增强血管内皮对抗补体介导的损伤而发挥肺保护作用[17]。另外,HO-1 的肺保护功能可能还与其催化代谢产物一氧化碳和胆绿素有关。大鼠肺缺血损伤时,一氧化碳既可减少白细胞瘀滞、纤维蛋白聚集、改善气体交换,提高存活率,又抑制肺内胞外信号调节激酶(ERK)活化、早期反应蛋白-1 表达。因此减少组织因子、Serpine-1、白细胞介素-1 和TNF-α表达[18]。一氧化碳还可诱导抗凋亡蛋白表达,减少Caspase-3 活化,同时激活应激反应转录因子[19]。胆绿素同样也可以通过抗炎、抗凋亡和抗氧化作用保护缺血再灌注肺损伤[20]。
COX-2 抑制剂诱导HO-1 表达可能是通过抑制COX-2 产生的。但在硝普钠介导的细胞毒性研究中发现,COX-2 抑制剂诱导HO-1 表达并不依赖于抑制COX-2[21]。因此,帕瑞昔布的具体机制介导缺血再灌注肺组织内HO-1 的表达,还需要进一步研究。
帕瑞昔布可减轻大鼠肺IR 后肺组织水肿程度,抑制脂质过氧化;减轻IR 肺损伤,减少肺组织内细胞凋亡,上述效应在一定程度上呈剂量依赖性,并且可能与帕瑞昔布增加IR 肺组织中HO-1 表达有关。
