HPV感染对宫颈COX-2表达及血PGE2表达水平的影响*
2019-07-06黄晶潘宜云周小娟余英程细云刘联斌申昌梅罗德平
黄晶,潘宜云,周小娟,余英,程细云,刘联斌,申昌梅,罗德平
(赣州市肿瘤医院 1.妇科,2.化疗科,3.检验科,江西 赣州 341000)
人乳头状瘤病毒(human papillomavirus,HPV)感染可导致慢性炎症,炎症相关基因环氧合酶-2(cyclooxygenase,COX-2)及前列腺素E2(Prostaglandin E2,PGE2)在慢性炎症启动致癌信号通路过程中均具有重要作用,且可以相互作用,共同促进肿瘤的增殖、凋亡及转移过程[1-3]。本研究初步探讨HPV 感染对慢性宫颈炎组织、子宫颈上皮瘤(cervical intraepithelial neoplasia,CIN)和宫颈癌组织中的COX-2 表达水平及血PGE2含量的影响;研究从宫颈炎症病变至宫颈癌转化的不同阶段,HPV 感染的状态及程度与COX-2 和PGE2表达的相关性,揭示HPV 感染与炎症反应在宫颈病变进展及评估宫颈早期病变的重要性。可望为进一步阐明宫颈癌发生、发展的分子生物学机制,为相关疾病的临床诊断、治疗、预后提供理论与实验依据,为宫颈癌的三级预防提供新的视角。
1 资料与方法
1.1 临床资料
选取2014年1月—2015年12月赣州市肿瘤医院符合纳入标准的初诊为宫颈癌患者40 例作为宫颈癌组。年龄28~69 岁,中位年龄45 岁;腺癌5 例 (12.5%),鳞癌35 例(87.5%)。按照国际妇产联盟 (Figo)宫颈癌分期,Ⅰ期16 例(40.0%),Ⅱ期10 例(25.0%),Ⅲ期14 例(35%),取标本前均未接受放、化疗。选取同期因妇科疾病治疗或门诊治疗的慢性宫颈炎患者20 例(宫颈炎组)及CIN 患者20 例(CIN 组)。
宫颈癌患者纳入标准:①初诊宫颈癌病理诊断明确患者;②Karhofsky 评分>70 分;③2 周内未服用消炎痛、阿司匹林等影响前列腺素代谢类药,3 d 内未做阴道冲洗或使用阴道内药物,24 h 内无性生活;④最小年龄18 岁,最大年龄70 岁;⑤患者自愿并签署同意书。
慢性宫颈炎、CIN 患者纳入标准:①慢性宫颈炎、CIN 诊断明确;②2 周内未服用消炎痛、阿司匹林等影响前列腺素代谢类药,3 d 内未做阴道冲洗或使用阴道内药物,24 h 内未进行性生活;③最小年龄18 岁,最大年龄70 岁;④患者自愿并签署同意书。排除标准:①合并其他恶性肿瘤患者;②盆腔有放疗史;③合并有其他严重心、肺、肝、肾疾病史患者;④近期服用COX 抑制剂如:阿司匹林、消炎痛等。研究经本院医学伦理委员会批准,所有患者知情并签署知情同意书。
1.2 方法
1.2.1 HPV 病毒检测标本的采集HC Ⅱ配套采样器采集保存宫颈细胞标本1 份,受检者取膀胱截石位,窥阴器暴露宫颈后,采用专用宫颈细胞采集刷按顺/逆时针旋转3~5 圈,收集细胞后固定,标本上标注姓名、年龄及病案号相关信息。按照美国Digene 公司HC Ⅱ HPV DNA 检测试剂盒说明书步骤,通过杂交捕获Ⅱ代技术检测HPV(16、18、31、33、35、39、45、51、52、56、58、59 和68 型),DML 2000 微孔板判读器测量样本的相对光单位(relative light unit,RLU),宫颈癌组的RLU/标准阳性对照的RLU 比值≥ 1.0 诊断为HPV 阳性,若比值<1.0,则判定为阴性。
1.2.2 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测COX-2 mRNA术中取新鲜手术切除宫颈病变标本,立即放入液氮中保存备用。Trizol 提取组织总RNA,根据Promega(北京)生物技术有限公司M-MLV 操作说明书逆转录合成cDNA。qRT-PCR 检测组织COX-2 及内参基因GAPDH的表达。引物序列:COX-2 正向引物为5'-CTCCTGTGCCTGATGATTGC-3',反向引物为5'-CAGCCCGTTGGTGAAAGC-3';GAPDH 正 向 引 物为5'-TGACTTCAACAGCGACACCCA-3',反向引物为5'-CACCCTGTTGCTGTAGCCAAA-3'。采用20.0 μl 反应体系:SYBR Taq 10.0 μl,正反向引物(2.5 μmol/L) 各0.5 μl,cDNA 1.0 μl,RNase-Free H2O 8.0 μl,反向 引物(2.5 μmol/L)0.5 μl。逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)参数:95℃预变性2 min,95℃变性15 s,58℃退火20 s,72℃延伸20 s,总计45 个循环。
1.2.3 ELISA 检测血PGE2含量分别采集CIN 组及宫颈癌组患者空腹静脉血5 ml,5% EDTA 防凝,采血后2 000 r/min 离心5 min,分离血浆,置入-20℃冰箱中冷冻保存待测。ELISA 检测血清PGE2的水平,PGE2检测试剂盒购自美国R&D 公司。
1.3 统计学方法
数据分析采用SPSS 22.0 统计软件。符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,两组比较采用t检验或秩和检验,相关分析采用Spearman 法,P<0.05 为差异有统计学意义。
2 结果
2.1 HPV 病毒载量及COX-2 在不同宫颈组织中的表达
随着宫颈病变进展,HPV 病毒载量也增多,其中宫颈炎组(3.6±0.6)、CIN 组(6.5±1.5)、宫颈癌组(10.4±2.9),CIN 组及宫颈癌组与宫颈炎组比较,差异有统计学意义(F=66.950,P=0.000)(见图1A);qRT-PCR 检测结果可见不同宫颈组织中COX-2 mRNA 均有一定程度表达,与宫颈炎组(4.1±0.9)比较,CIN 组(7.6±1.3)中COX-2 表达升高,差异有统计学意义(t=9.884,P=0.001);宫颈癌组(10.5±1.1)中COX-2 mRNA 表达与CIN 组比较,差异有统计学意义(t=-9.052,P=0.000),宫颈癌组中COX-2 mRNA 表达升高。由此可知,COX-2 表达与宫颈癌进展有关(见图1B)。
2.2 宫颈组织中HPV 感染与COX-2、PGE2 mRNA 表达的相关性
根据HPV 感染状态而分的HPV 阴性组和HPV阳性组的COX-2 mRNA 表达水平分别为(4.7±1.2)和(10.2±1.6),HPV 感染阳性宫颈组织中COX-2 mRNA 表达水平高于阴性宫颈组织(t=15.062,P=0.000)(见图2A);血清PGE2mRNA 表达水平分别为(7.0±1.9)和(10.5±2.3),HPV 感染阳性宫颈组织中PGE2mRNA 表达与阴性宫颈组织比较,差异有统计学意义(t=6.426,P=0.000)阳性宫颈组织中PGF2mRNA 表达升高(见图2B)。
2.3 宫颈癌患者血清PGE2 与HPV 病毒载量的相关性
宫颈癌患者HPV 感染阳性与血清PGE2含量相关,进一步分析得出患者HPV 感染后,随HPV 病毒载量升高,血清PGE2含量亦随之升高,宫颈癌患者血清PGE2与HPV DNA 载量呈正相关(rs=0.257,P=0.003)。见图3。
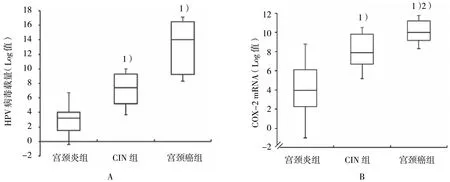
图1 HPV 病毒载量与COX-2 在不同宫颈组织中的表达 (±s)
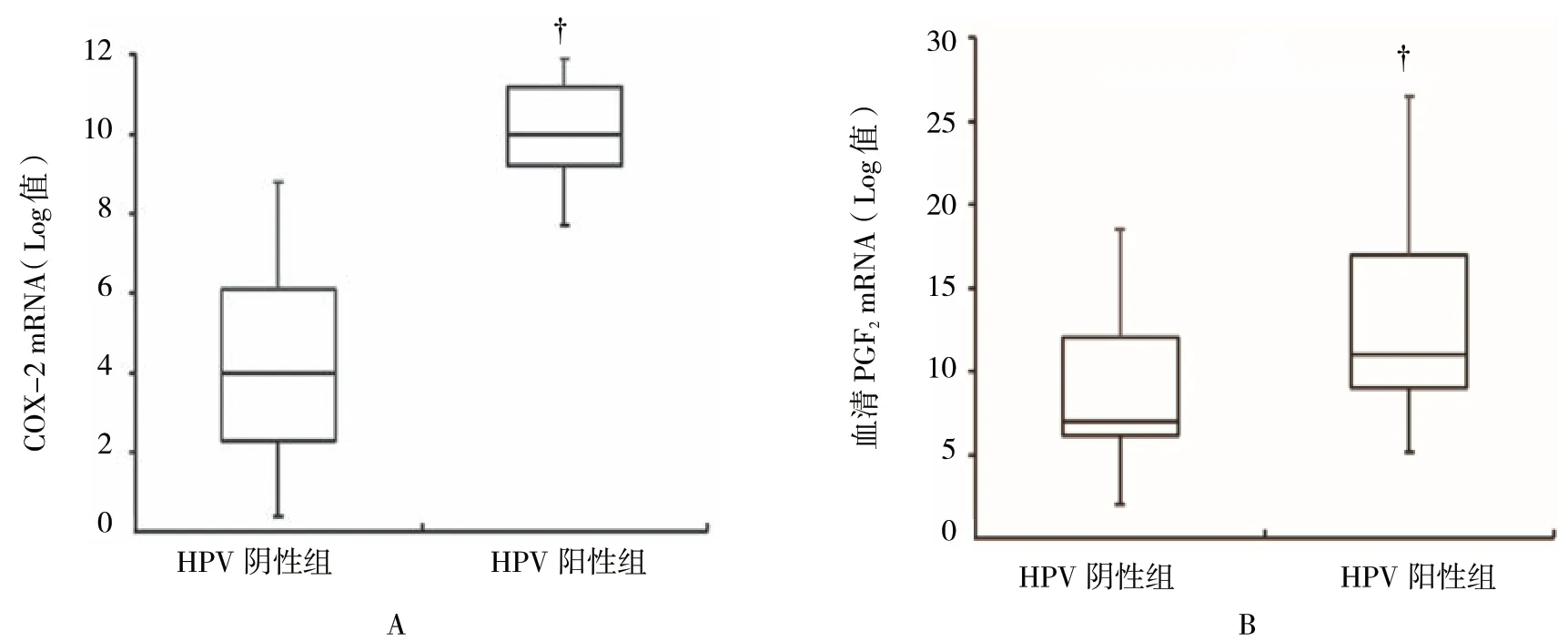
图2 宫颈组织HPV 感染与COX-2、PGE2 mRNA 表达的相关性 (±s)
2.4 宫颈癌组织COX-2 mRNA 与血清PGE2 mRNA 表达的相关性
高表达COX-2 mRNA 与血清PGE2mRNA 表达增加相关,本研究结果进一步提示宫颈组织癌中COX-2 mRNA 表达 与血清PGE2mRNA 表达相关,COX-2、PEG2mRNA 表达经正态性检验(P<0.05)不服从正态分布,采用Spearman 相关性检验分析COX-2、PEG2mRNA 表达之间的相关性,结果显示两者呈正相关(rs=0.684,P=0.000)。见图4。
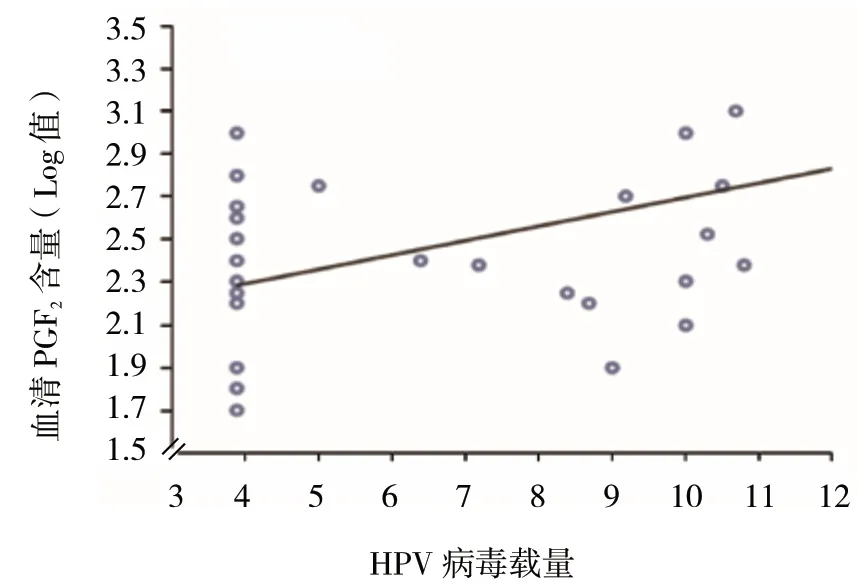
图3 血清PGE2 与HPV 病毒载量的相关性

图4 宫颈癌组织COX-2 mRNA 表达与血清PGE2 mRNA表达的相关性
3 讨论
宫颈癌是女性第二大常见恶性肿瘤,全球每年的新发例数约为53 万,占所有女性肿瘤的12 %,死亡数达27.5 万例[4]。我国是宫颈癌的高发区,占全世界新发例数的1/5~1/4,每年2 万~3 万妇女死于宫颈癌,严重威胁女性健康[5]。2004年IRAC 指出,HPV感染是CIN 及宫颈癌发生的必要因素,尤其是HPV 16 的持续感染。早期宫颈癌的治愈率在90%以上,早发现早治疗是提高宫颈癌治愈率的关键。HC Ⅱ是目前宫颈癌筛查最常见方法之一,应用于HPV 感染的筛查,具有高度敏感性、客观性及可重复性。许多研究指出CIN 的病变程度与HPV 病毒载量相关,HPV病毒载量越高,宫颈癌发生的风险越高[6-7],但也有研究指出HPV 病毒载量与宫颈病变无相关[8],该结论仍存在一定争议。本研究通过HC Ⅱ检测HPV 分型及病毒载量,以HPV 16 感染为主,统计分析宫颈癌HPV 病毒载量最高,CIN 次之,宫颈炎最低。
COX 是前列腺素生物合成过程中的关键限速酶,可催化花生四烯酸转化成各类前列腺素[9]。前列腺素合成后,以自分泌或旁分泌方式释放并结合细胞特异性G 蛋白偶联受体,从而参与调控细胞内的生理活动[10]。COX-2 作为宫颈癌预后的危险因素,与临床分期、淋巴结转移、肿瘤生长浸润及淋巴结转移均密切相关,甚至贯穿宫颈癌病变的整个过程[11-13]。本研究结果显示,COX-2 在宫颈癌及CIN 组织中表达均高于宫颈炎组织,这与早期病变时主要以炎症反应为主这一因素相关。HPV 病毒E6、E7基因可诱导COX-2 异常高表达,这与其E6、E7 蛋白结合性抑制p53 及pRb 蛋白,进而导致DNA 损伤修复受损;E6 蛋白转录激活C-myc基因并与诱导COX-2 表达相关[14-15]。本研究中,HPV感染后可提高COX-2基因的表达。
PGE2是花生四烯酸在COX 作用下的产物之一,其过表达可促进肿瘤细胞增殖、迁移、肿瘤血管生成,抑制肿瘤细胞凋亡,以及弱化宿主免疫功能,邹余粮等[16]研究发现血清及组织PGE2含量与宫颈病变程度呈正相关,这与COX-2 蛋白生成增加或活性增强促进PGE2表达有关。SALES 等[17]证实,COX-2 与PGE2受体在宫颈癌组织中表达同时上调。本研究发现COX-2表达与PGE2呈正相关。此外,HPV 感染阳性宫颈病变组织血清PGE2含量高于HPV 感染阴性,进一步分析发现PGE2含量与HPV-DNA 载量呈正相关,HPV 感染如何促进PGE2表达还有待进一步研究。DEVA 等[18]在白色念珠菌中插入含HPV16 病毒序列,感染阴道上皮系统后促进PGE2合成酶表达,从而提高PGE2表达。研究指出HPV16 E5 蛋白可通过COX-2 依赖途径促进宫颈癌细胞PGE2受体EP4 表达[19]。
目前HPV 检测已列入宫颈癌常规筛查中,但HPV 定量检测存在争议。EINSTEIN 等研究[20]指出在确诊宫颈癌前,HPV 感染且高病毒载量,进展为宫颈癌概率较低病毒载量者高30~60 倍。多种高危型HPV 病毒载量与宫颈癌前病变有关,研究表明[21]HPV16 病毒载量对宫颈癌病变预测最为重要,HPV 16感染者高病毒载量与CIN2+(CIN2 及以上病变)病变级别存在相关()。HPV定量检测对宫颈癌具有重要预测意义。本研究认为,在已确定HPV 感染患者中进行HPV 定量检测具有必要性,同时COX-2 与PGE2等炎症相关分子水平检测亦有重要临床指示作用。
