神经病理性疼痛大鼠不同大小DRG神经元兴奋性分型的研究*
2019-07-06谭朝阳周颖屈祖卫张萌陈沁怡田俊杰许珍珍邓诗瑜李丽马克涛司军强
谭朝阳,周颖,屈祖卫,张萌,陈沁怡,田俊杰,许珍珍,邓诗瑜,李丽,马克涛,司军强
[1.石河子大学医学院 生理教研室(新疆地方与民族高发病教育部重点实验室),新疆 石河子 832000;2.石河子大学药学院 药理系,新疆 石河子 832002]
神经病理性疼痛是一种慢性疼痛,持续6 个月以上,它通常是由炎症、烧伤、躯体感觉系统的疾病或功能紊乱等造成的。根据2011年的流行病学调查显示,神经病理性疼痛的患病率为3.3%~8.2%[1]。目前,坐骨神经分支选择性损伤(spared nerve injury,SNI)模型已经被广泛用于神经病理性疼痛的研究[2-4],该模型能较稳定地改变实验动物的行为学,且能造成与临床神经病理性疼痛相似的综合症状。背根神经节(dorsal root ganglion,DRG)神经元作为外周感觉传入的第一级神经元,在痛觉的产生和传递中发挥重要作用。研究表明,DRG 神经元大小不一,其直径的大小与其功能间存在关系。其中,小直径的DRG 神经元由无髓鞘的C 纤维(C)和薄髓鞘的A 纤维(Aδ)组成,传递伤害性刺激、热刺激和机械刺激产生的感觉信号,而大直径的DRG 神经元由有髓鞘的A 纤维(Aβ)组成,传递非伤害性的刺激。不同大小神经细胞间的功能差异,可能是由神经元的化学物质、解剖、电生理特性及神经元对疼痛信息处理模式的差异共同造成的[5-6]。兴奋性是衡量神经细胞功能的最基本指标,人们通常用动作电位发放频率的高低来评价细胞的兴奋性,发放频率越高,兴奋性也就越高,反之亦然。有研究者根据发放频率和注入电流强度之间的关系将DRG 分为3 种兴奋类型[7]。基于此,本实验研究神经病理性疼痛状态下DRG 神经元兴奋性分型的变化,并在此基础上分析兴奋性分型与细胞大小的关系,希望能从兴奋性分型和细胞大小的角度对神经病理性疼痛的产生机制进行探讨。
1 材料与方法
1.1 实验动物及分组
清洁级SD 大鼠75 只,体重180~220 g,雌雄不拘,由新疆医科大学动物实验中心提供(动物编号:SCXK 新2003-0001)。将大鼠随机分成Control 组、Sham 组和SNI 组。其中,Control 组5 只(行为学实验5 只),Sham 组35 只(行为学实验5 只,膜片钳实验30 只),SNI 组35 只(行为学实验5 只,膜片钳实验30 只)。
1.2 主要试剂和仪器
胰蛋白酶Type Ⅲ、胶原酶Type IA、胰蛋白酶抑制剂、DMEM 培养基(购自美国Sigma 公司),Multi Clamp 700B 膜片钳放大器(美国Axon 公司),P-2000 微电极拉制仪(美国Sutter 公司),Digidata 1550A 数据采集系统(美国Axon 公司),MP-225 微操纵仪(美国Sutter 公司),UGO BASILE 37370 全自动热辐射刺激仪(意大利Gemonio 公司)。
1.3 动物模型复制
参照DECOSTERD 和RICHNER 等[2,8]的方法,测量并记录各组大鼠的体重,用3%戊巴比妥钠(3 g 戊巴 比妥钠粉剂溶入100 ml 生理盐水)按照0.17 ml/100 g的剂量麻醉各组大鼠。取俯卧位固定于鼠板上,切口处附近用剃毛刀剃毛暴露皮肤,碘伏消毒铺巾。于左后腿外侧近髂后上棘处平行于股骨划开皮肤,顺肌肉纹理钝性分离股二头肌,用玻璃分针暴露并分离坐骨神经的3 个分支(胫神经、腓总神经、腓肠神经)。用3-0 医用真丝编织线分别结扎胫神经和腓总神经,系紧后在结扎远端切断,保留2~4 mm 的远侧残端,分层缝合肌肉和皮肤。动物单笼分开饲养用于实验。Sham 组大鼠麻醉及暴露神经的方法同上,用玻璃分针分离3 个分支后,不做任何处理,随即分层缝合肌肉和皮肤,单笼饲养。
1.4 记录热缩足潜伏期
参照本实验室前期研究[9-10],在模型复制前1 天、模型复制后第1、7、14 和21 天对Control 组、Sham组及SNI 组大鼠进行热缩足潜伏期的测试。设定UGO BASILE 37370 全自动热辐射刺激仪参数:红外线强度IR 值为50,时间上限为30 s。将大鼠放置于玻璃面板上的有机玻璃观察盒内,移动玻璃板下的红外线发射器。瞄准大鼠后肢足心部位照射,按动计时开关。大鼠受照射后肢抬离面板,仪器感应并停止记时,此时记录到的时间为大鼠的热缩足潜伏期,将其作为疼痛阈值的指标。间隔30 min 待大鼠安静后,进行下一次测量。每只大鼠测量3 次,取平均值。
1.5 记录冷刺激抬足时间
在热缩足潜伏期测试结束30 min后,待大鼠安静,进行冷刺激抬足时间的测试。参照2014年NORCINI等[11]的方法,将大鼠放置在自制的观察笼内,待其安静,小心地将0.1 ml 丙酮滴到大鼠左后足底外侧的皮肤上,立即用计时器计时。大鼠出现抬足的现象,直至大鼠将左后足放下时,停止计时。此时记录到的时间就是大鼠的冷刺激抬足时间。间隔30 min 待大鼠安静后,进行下一次测量。测量3 次,取平均值。所有测量都在当日18:00~20:00 进行。
1.6 急性分离消化DRG 神经元
在本实验室前期研究[12-13]的基础上略做改进,用颈椎脱臼法处死大鼠,粗剪剪开其背部皮肤,沿脊柱两侧取出L4~L6 段脊柱。将取出的脊柱沿矢状面对半剖开,放入盛有氧饱和的细胞外液中(细胞外液成分:NaCl 150 mmol/L,KCl 5 mmol/L,MgCl21 mmol/L,HEPES 10 mmol/L,D-glucose 10 mmol/L,Sucrose 20 mmol/L,CaCl23.32 mmol/L,用1 mol/L 的NaOH 调节pH 值为7.35~7.45,蔗糖调节溶液的渗透压为772.5~849.75 kPa)。在10 倍显微镜下,于剖开的左侧椎管内侧去除脊髓,用游丝镊剥除结缔组织被膜,逐个取出椎间孔中的DRG 及其相连的神经根。用精细角膜剪和游丝镊仔细剪除与DRG 相连的神经根。将取出的DRG 放入直径为4 cm 的玻璃皿中,用精细角膜剪将DRG 充分剪碎,用胶头滴管将剪碎的组织转移入15 ml 的离心管中,随后加入3 ml 配制好的消化酶溶液(胰蛋白酶Type Ⅲ0.24 mg/ml 和胶原酶Type IA 0.6 mg/ml,溶剂为DMEM 培养基)。将EP 管放入37℃水浴锅中,消化2~4 min,边消化边吹打,避免产生气泡。消化结束后立即加入少量胰蛋白酶抑制剂终止消化。用胶头滴管将细胞悬液滴到膜片钳专用的细胞培养皿中,静置待细胞贴壁,待细胞贴壁充分后,加入氧饱和的细胞外液。
1.7 全细胞膜片钳记录
参照本实验室原有方法[12-14],将盛有急分离DRG神经元的细胞培养皿放置在膜片钳显微镜载物台上,100 倍显微镜下选取膜表面光滑、整体透亮、状态良好的DRG 细胞作为实验对象。选用Sutter Instrument 公司带芯的硼硅酸盐玻璃毛坯,使用P-2000 微电极拉制仪拉制成微电极,实验选取电阻值为2~8 MΩ 的微电极,充灌电极内液(K-Gluconate 130 mmol/L,NaCl 10 mmol/L,MgCl2·6 H2O 1.2 mmol/L,CaCl22 mmol/L,EGTA 5 mmol/L,HEPES 10 mmol/L,D-Glucose 7.5 mmol/L。用1 mol/L 的KOH 调节pH 值为7.35~7.45,蔗糖调节溶液的渗透压为772.5~849.75 kPa),将充灌好细胞内液的玻璃微电极连接在微操纵仪上,用5 ml 空注射器给予一定正压。操作微操纵仪,使微电极尖端靠近并接触细胞,接触细胞的瞬间可以从膜测试窗口观察到电极电阻略微升高。随后撤去正压,用嘴吸法给予微电极内部一定负压,同时将钳制电位逐步调节至-60 mV,待细胞与电极间形成GΩ 封接后,用嘴吸破膜法或同时辅助以电击破膜法破膜(膜片钳放大器提供的Zap 功能)。破膜后,阻值仍维持在GΩ 以上的细胞用于实验。
在显微镜下记录细胞直径。在I=0 模式下记录细胞的静息电位,在电压钳模式下(钳制电位-60 mV),记录膜电容。在电流钳模式下,给予细胞一系列斜坡刺激记录动作电位。记录的信号经Multi Clamp 700B膜片钳放大器放大,给予10 kHz 的滤波后,由Axon Digidata 1550A 数模/模数转换器转换,采样频率为10~20 kHz。
1.8 统计学方法
热辐射刺激缩足潜伏期测量值和冷刺激抬足时间的结果采用SPSS 17.0 统计软件进行分析,全细胞膜片钳数据应用Clampex 10.6 软件采集记录,用Clampfit 10.6 软件进行测量分析,用SPSS 17.0 软件进行统计分析,所有数据最终运用GraphPad Prism 5.0 软件进行绘图。计量资料以均数±标准差(±s)表示,不同时间点的比较采用重复测量设计的方差分析,其余计量资料3 组及以上的比较采用单因素方差分析,两组间比较采用独立样本t检验,计数资料以率(%)表示,比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 行为学测试结果
Control 组、Sham 组及SNI 组术前1 天、术后第1、7、14 和21 天的热缩足潜伏期的比较采用重复测量设计的方差分析,结果:①不同时间点热缩足潜伏期有差异(F=427.215,P=0.000);②3 组间热缩足潜伏期有差异(F=99.294,P=0.000);③3 组间热缩足潜伏期随时间的变化趋势无差异(F=0.007,P=0.993)。见表1 和图1。
Control 组、Sham 组及SNI 组术前1 天、术后第1、7、14 和21 天的冷刺激抬足时间的比较采用重复测量设计的方差分析,结果:①不同时间点冷刺激抬足时间有差异(F=33.984,P=0.000);②3 组间冷刺激抬足时间有差异(F=2.940,P=0.024);③3 组间冷刺激抬足时间随时间的变化趋势有差异(F=78.158,P=0.000)。说明3 组的不同处理方式对冷刺激抬足时间的影响有差异。见表2 和图2。
表1 模型复制后热缩足潜伏期的变化 (s,±s)

表1 模型复制后热缩足潜伏期的变化 (s,±s)
组别 n术前1 天 术后第1 天 术后第7 天 术后第14 天 术后第21 天Control 组 5 25.3±3.3 24.3±3.4 25.3±3.6 24.7±3.9 25.8±3.4 Sham 组 35 26.1±3.5 25.2±3.6 25.6±4.1 24.1±3.9 25.4±3.4 SNI 组 35 25.9±3.6 23.3±3.8 26.4±3.1 24.2±3.2 25.3±3.7
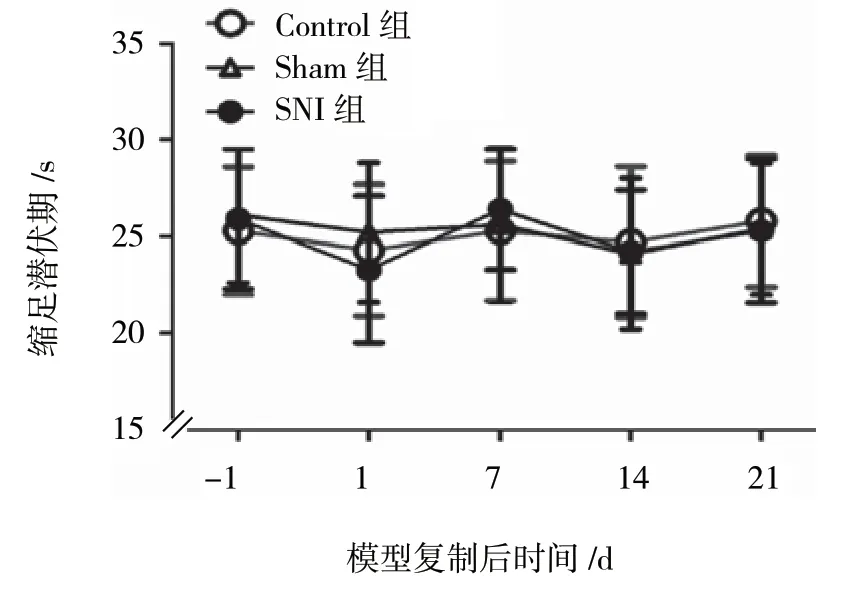
图1 模型复制后热缩足潜伏期的变化
2.2 SNI 大鼠DRG 神经元的兴奋性分型发生改变
为明确正常大鼠DRG 神经元的兴奋性分型情况,运用全细胞膜片钳技术,在电流钳模式下给予记录电极内一个斜坡刺激(时长1 000 ms,电流强度0~2 500 pA),再根据细胞对注入刺激的不同反应将细胞分为3 种类型。1 型细胞:在给予较小强度(50~500 pA)刺激时就能产生较低频率的动作电位,并且随着电流强度增加动作电位频率逐渐增加。2 型细胞:在给予较小强度的刺激时,不产生动作电位;但在给予较高电流强度(1 500~2 500 pA)刺激时,出现较高频率的动作电位。3 型细胞:兴奋性较低,不产生动作电位(见图3)。结果表明,正常大鼠DRG神经元存在3 种兴奋性类型的细胞,进一步对3 种类型细胞的主被动模特性进行分析(见表3)。方差分析结果显示:1、2 和3 型细胞的静息电位比较差异无统计学意义(P>0.05)。1、2 和3 型细胞直径比较差异有统计学意义(P<0.05),进一步两两比较,1 型 细胞直径小于3 型细胞直径(P<0.05),2 型细胞的直径与其他两种类型细胞比较差异无统计学意义(P>0.05)。1、2 和3 型细胞膜电容比较差异有统计学意义(P<0.05),进一步两两比较,1 型细胞的膜电容低于3 型细胞的膜电容(P<0.05)。
表2 模型复制后冷刺激抬足时间的变化 (s,±s)

表2 模型复制后冷刺激抬足时间的变化 (s,±s)
组别 n术前1 天 术后第1 天 术后第7 天 术后第14 天 术后第21 天Control 组 5 2.62±0.82 2.44±0.76 2.83±0.86 2.53±0.88 2.71±0.77 Sham 组 35 2.59±1.30 3.21±1.34 2.82±1.21 2.42±1.32 2.79±1.37 SNI 组 35 2.61±1.46 6.52±1.33 8.79±1.27 11.62±1.45 12.81±1.22

图2 模型复制后冷刺激抬足时间的变化
为明确SNI 复制模型前后,大鼠DRG 神经元兴奋性分型如何变化,本研究运用全细胞膜片钳技术,在电流钳模式下对463 个DRG 细胞(Sham 组205 个,SNI 组258 个)进行记录。根据兴奋性的3 种类型进一步分类,可以看出:Sham 组中,1、2 和3 型细胞的构成比分别为44.39%、4.88%和50.73%;而SNI 组中,相应的数据为54.26%、7.36%和38.37%。两组间各型细胞的构成比有差异(P<0.05),SNI 组的细胞构成比与Sham 组比较,差异有统计学意义(χ2=7.340,P=0.025),1 和2 型细胞构成比增加,而3 型细胞的构成比降低。见图4。

图3 SD 大鼠DRG 神经元兴奋性分型
表3 SD 大鼠不同兴奋性类型DRG 的基本特性 (±s)
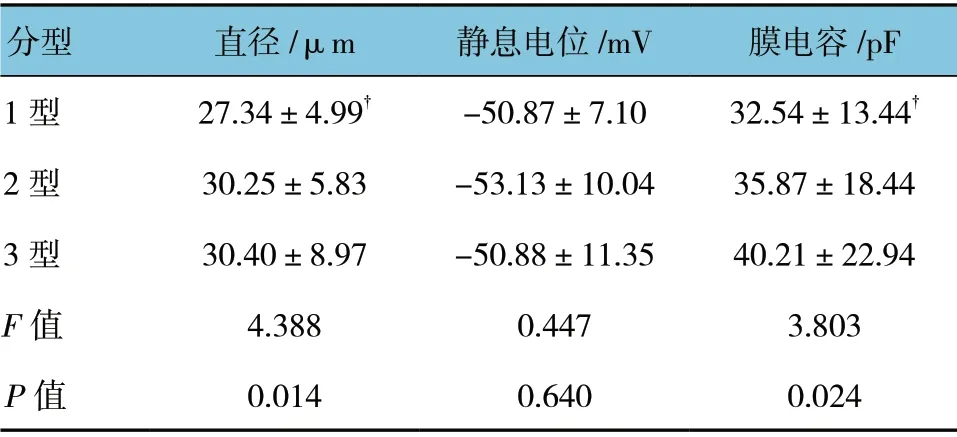
表3 SD 大鼠不同兴奋性类型DRG 的基本特性 (±s)
注:†与3 型比较,P<0.05
分型 直径/μm 静息电位 /mV 膜电容/pF 1 型 27.34±4.99†-50.87±7.10 32.54±13.44†2 型 30.25±5.83-53.13±10.04 35.87±18.44 3 型 30.40±8.97-50.88±11.35 40.21±22.94 F 值 4.388 0.447 3.803 P 值 0.014 0.640 0.024
2.3 SNI 模型复制前后不同大小DRG 神经元兴奋性分型的变化
为探讨正常SD 大鼠DRG 神经元兴奋性分型与直径之间的关系,本研究比较Control 组内不同大小神经元各兴奋性分型细胞的构成比。细胞按直径大小分为:小细胞(直径<25 μm)、中细胞(25 μm ≤直径<40 μm)和大细胞(直径≥40 μm),再按照兴奋性分型进一步分类。其中,小细胞1、2 和3 型细胞的构成比分别为44.44%、2.22%和53.33%;中细胞1、2 和3 型细胞的构成比分别为50.00%、5.88%和44.12%;大细胞1、2 和3 型细胞的构成比分别为12.50%、4.17%和83.33%。可以看出,中、小细胞3 型细胞的构成比与大细胞比较,差异有统计学意义(χ2=7.210,P=0.027),中、小细胞3 型细胞的构成比较低,而1型和2 型细胞的构成比较高。见图5。
为探讨神经病理性疼痛状态下,DRG 神经元兴奋性分型和直径之间的关系,比较SNI 组内不同大小神经元各兴奋性分型细胞的构成比。按直径大小以及兴奋性分型进行分类,其中,小细胞1、2 和3 型细胞的构成比分别为43.10%、3.45%和53.45%;中细胞1、2 和3 型细胞的构成比分别为59.04%、9.04%、31.91%;大细胞1、2 和3 型细胞的构成比分别为33.33%、0.00%和66.67%。可以看出模型复制后,中细胞1、2 和3 型细胞构成比与大细胞比较,差异有统计学意义(χ2=6.390,P=0.041),中细胞3 型细胞构成比较低,而1 和2 型细胞构成比较高。小细胞1、2 和3 型细胞构成比与大细胞比较,差异无统计学意义(χ2=0.960,P=0.620)。见图6。

图4 SNI 模型大鼠DRG 神经元兴奋性分型的变化 (±s)

图5 SD 大鼠DRG 神经元兴奋性分型与直径的关系 (±s)

图6 SNI 模型大鼠DRG 神经元兴奋性分型与直径的关系 (±s)
3 讨论
神经病理性疼痛是指由躯体感觉神经系统的损伤或疾病而直接造成的疼痛[15],包括疱疹后神经痛、三叉神经痛和中风后疼痛等。研究发现,神经病理性疼痛与DRG 神经元的兴奋性密切相关。HODGKIN[16]在放电频率与注入电流强度间的关系的基础上,提出关于神经元兴奋性分型的理论。XIE 等[7]研究发现,DRG 神经元也能表现出基于动作电位爆发模式的不同兴奋性分型,且发现神经元兴奋性分型的比率不是一成不变的。在DRG 慢性压迫模型导致的慢性疼痛状态下,1 型神经元的比率显著增加,而兴奋性较低的3 型神经元的比率显著减少。该改变表明一部分3型神经元在病理状态下转化成兴奋性较高的1 型神经元。本研究结果显示,正常SD 大鼠DRG 神经元存在3 种兴奋性类型,兴奋性高的1 型细胞其直径和膜电容明显小于兴奋性低的3 型细胞;坐骨神经选择性损伤后,大鼠DRG 神经元的兴奋型类型发生了改变,1 型和2 型细胞比例增大,3 型细胞比例减少,表明神经病理性疼痛状态下,兴奋性低的3 型细胞向兴奋性高的1 型和2 型细胞转化。
研究报道,不同大小的DRG 神经元,其功能也存在不同。这种功能上的差异,可能是由神经元的化学物质、解剖、电生理特性和神经元对疼痛信息处理模式的差异共同造成的[5-6]。例如,按照与IB4 结合的不同特点,小直径的DRG 被分为IB4 阳性的肽能神经元和IB4 阴性的非肽能神经元,而大直径DRG的NF200 表达为阳性[17-18]。有研究者还通过多种单细胞技术,将DRG 神经元分为10 种类型和14 种亚型[19]。研究表明,在DRG 慢性压迫模型引起的NP 状态下,大直径的DRG 的兴奋性分型发生明显的变化,并且该变化与DRG 中超极化激活的阳离子电流的大小变化有关[7]。KANG 等[20]发现,SNI 大鼠上中等直径DRG 神经元CaV3.2 T 型钙通道的改变,可能是神经病理性疼痛的产生机制。JIANG 等[21]发现,在大鼠小直径的DRG 神经元上,IgG 免疫复合物(IgG-IC)能激活Ⅰ型Fc-γ 受体介导疼痛的产生,大中直径的DRG 神经元不存在该现象。本研究表明,大鼠DRG神经元的兴奋性分型与其直径大小存在关系。正常状态下,大直径的DRG 神经元主要是兴奋性低的3 型细胞;而中、小直径神经元主要是兴奋性较高的1 型和2 型细胞。坐骨神经选择性损伤后,大直径的DRG神经元的3 型细胞构成比仍较中细胞高,但较小细胞之间的差异无统计学意义。
综上所述,在神经病理性疼痛状态下,DRG 神经元兴奋性分型发生明显改变,兴奋性较高的1 型和2型细胞构成比增高,而兴奋性较低的3 型细胞构成比降低,这可能是神经病理性疼痛状态下产生痛觉过敏的机制之一。此外,大鼠DRG 神经元的直径大小与其兴奋性分型间存在关系,中小细胞的兴奋性较大细胞兴奋性高,表明中小细胞在神经病理性疼痛的产生过程中发挥更为重要的作用。但是在神经病理性疼痛状态下,DRG 神经元兴奋性分型改变的机制,以及不同直径大小的DRG 神经元兴奋性类型差异的机制仍有待探索。
