核因子E2相关因子2在晶状体上皮细胞抗氧化损伤中的作用*
2019-07-06朱丽华李佳李兵
朱丽华,李佳,李兵
(1.山东中医药大学附属眼科医院 山东省中西医结合眼病防治重点实验室,山东 济南 250002;2.锦州医科大学附属第一医院,辽宁 锦州 121000)
全世界主要的致盲疾病中,白内障占首要位置。晶状体上皮细胞是晶状体前囊膜下一层单层细胞,维持晶状体的正常代谢,阻挡房水内任何有害物质进入晶状体,一旦晶状体上皮细胞功能障碍,就会引起晶状体代谢紊乱,出现混浊,最终导致白内障。白内障的诱发因素很多,氧化应激是主要原因,其次是细胞凋亡,氧化损伤也是细胞凋亡的诱发因素之一[1]。过量的活性氧(ROS)可以直接攻击脂质、蛋白质和DNA,导致晶状体受损,还可以作为信号通路的上游信号分子,激活细胞内多种信号转导通路和转录因子并介导过氧化氢H2O2对晶状体的损伤[2]。
核因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)是细胞抵御氧化损伤、抗凋亡的重要转录因子。近来研究发现,Nrf2 蛋白对各种以氧化应激和凋亡为主要发病机制的疾病都具有保护作用[3-4]。本研究主要探讨Nrf2 在晶状体上皮细胞对抗H2O2氧化损伤和凋亡的作用,并为今后探讨防治白内障提供新的思路和途径。
1 材料与方法
1.1 材料和试剂
人晶状体上皮细胞(SRA01/04)购自中国科学院上海细胞所,MEM 培养基购自美国BI 公司,活性氧检测试剂盒购自上海碧云天生物有限公司,超氧化物酶歧化酶(SOD)检测试剂盒购自南京建成生物工程研究所,Nrf2 一抗、剪切型Caspase-3(Cleaved-Caspase-3)、Bax、Bcl-2 一抗购自美国Absci 公司,GAPDH、辣根过氧化物酶二抗购自杭州弗德生物公司,Dapi 染色液购自北京索莱宝公司,荧光二抗购自北京博奥森公司,核浆蛋白提取试剂盒购自上海碧云天生物有限公司。
1.2 仪器和设备
恒温水浴箱(上海森信RP-9160),转印槽(美国Biorad 公司),垂直电泳槽(美国Biorad 公司),电泳凝胶成像分析系统(上海天能公司),台式高速冷冻离心机(美国Beckman 公司),免疫荧光显微镜(日本Olympus 公司),酶标仪、流式细胞仪、超净台及孵育箱(美国Biorad 公司),恒温摇床(美国Forma Scientific 公司),超微量分光光度计(美国Bioteck/EPoch 公司),制冰机(意大利Scotsman AF100 公司)
1.3 方法
1.3.1 细胞培养将SRA01/04 培养在含10%胎牛血清(FBS)的MEM 培养基中,置于37℃、5%二氧化碳CO2培养箱中培养,用0.25%胰酶常规传代。
1.3.2 MTT 检测不同浓度H2O2处理的SRA01/04 活性将细胞按照不同处理方式分组。分为正常对照组(不加入H2O2)、H2O250 μmol/L 组(加入50 μmol/L H2O2)、H2O2100 μmol/L 组(加入100 μmol/L H2O2)、H2O2200 μmol/L 组(加 入200 μmol/L H2O2)、H2O2300 μmol/L 组(加入300 μmol/L H2O2)和H2O2400 μmol/L 组(加入400 μmol/L H2O2)。取对数生长期的SRA01/04按2×103个/100μl 浓度接种在96 孔板,MEM 培养基(含10% FBS)培养24 h 使细胞贴壁,后加入稀释好的含不同浓度H2O2的MEM 培养基中,分别培养24 和48 h 后酶标仪检测光密度(OD)值。
1.3.3 细胞分组将细胞按照不同处理方式分组:正常对照组(不加入H2O2),H2O2低浓度组(H2O2浓度为100μmol/L),H2O2中浓度组(H2O2浓度为200μmol/L),H2O2高浓度组(H2O2浓度为300μmol/L),Nrf2 抑制组(GSK-3β+H2O2300μmol/L)。
1.3.4 流式细胞术检测ROS 含量5 组细胞处理48h 后,将细胞收集于稀释好的DCFH-DA 中,细胞培养箱中培养20min。用无血清培养液洗涤细胞3 次,充分去除未进入细胞内的DCFH-DA。
1.3.5 SOD 含量检测将5 组细胞处理48h 后,收集细胞和上清液,每组分为空白管、对照空白管、测试管和对照测试管,混匀,37℃孵育20min,450nm处酶标仪读数,细胞中SOD 活力=SOD 抑制率/ 50%×12×样品稀释倍数。
1.3.6 Western blotting 检测Nrf2 总蛋白、核蛋白、浆蛋白,Cleaved-Caspase-3,Bax 和Bcl-2 相对表达将5 组细胞处理48h 后,每组的1/2 细胞用于提取细胞中的核蛋白、浆蛋白,其余1/2 细胞用于提取总蛋白。考马斯亮蓝定量。蛋白经过SDS-PAGE 分离后转移到PVDF 膜,用脱脂奶粉封闭1h,封闭好的PVDF 膜分别浸于不同的一抗孵育液里(兔抗Nrf2 以1 ∶500,兔抗Cleaved-Caspase-3、Bax 和Bcl-2 以1 ∶500 稀释,兔抗GAPDH 以1 ∶1000 稀释)4℃孵育过夜,TBST清洗。将PVDF 膜浸于辣根过氧化物酶标记的羊抗兔二抗(1 ∶1000)孵育液中1.5h,TBST 清洗。利用高敏感性化学发光检测方法成像。
1.3.7 免疫荧光检测Nrf2 在细胞内的表达和定位将4 组细胞按3000 个/100μl 接种于有小圆玻片上的6 孔板上,在细胞培养箱贴壁24h,按照分组相应处理48h 后,磷酸盐缓冲液冲洗玻片,4%多聚甲醛固定5min,磷酸盐缓冲液冲洗玻片,0.5%聚乙二醇辛基苯基醚(Triton X-100)透明10min 增加细胞膜通透性,1%牛血清白蛋白封闭1h,兔抗Nrf2 一抗4℃封闭过夜,羊抗兔二抗1h,6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole 4',DAPI)染核10min,磷酸盐缓冲液冲洗,将小圆玻片置于载玻片上,荧光显微镜下观察。
1.4 统计学方法
数据分析采用SPSS 17.0 统计软件,计量资料以均数±标准(±s)表示,采用重复测量设计的方差分析和单因素方差分析,两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组不同时间的细胞活力比较
各个浓度实验组与正常对照组不同时间点的细胞活力比较,经重复测量设计的方差分析,结果:①不同时间点的细胞活力有差异(F=268.540,P=0.000),处理时间为48h 时,细胞活力最低。②组间细胞活力有差异(F=126.450,P=0.001),在48h 时,各浓度组的细胞活力的变化最有意义。③各浓度实验组与正常对照组的细胞活力变化趋势有差异(F=254.110,P=0.002)。与正常对照组比较,H2O250μmol/L 组、H2O2100μmol/L 组、H2O2200μmol/L 组及H2O2300μmol/L组的细胞活力均下降(P<0.05),当浓度为400μmol/L 时,细胞不可逆死亡。见表1。
2.2 各组ROS 含量比较
处理48h 后,各组ROS 含量的比较,经方差分析,差异有统计学意义(F=2851.340,P=0.000),与正常对照组比较,各处理组的ROS 含量升高(P<0.05),Nrf2 抑制组与H2O2高浓度组比较,差异无统计学意义(P>0.05)。见图1 和表2。
2.3 各组SOD 含量比较
处理48h 后,各组SOD 含量比较,经方差分析,差异有统计学意义(P<0.05);与正常对照组比较,各处理组的SOD 含量降低(P<0.05),与H2O2高浓度组比较,Nrf2 抑制组SOD 含量减少(P<0.05)。见表2。
表1 各组不同时间的细胞活力比较 (±s)

表1 各组不同时间的细胞活力比较 (±s)
组别 12 h 24 h 48 h正常对照组 0.762±0.113 0.756±0.021 0.751±0.020 H2O2 50 μmol/L 组 0.712±0.010 0.709±0.091 0.711±0.012 H2O2 100 μmol/L 组 0.586±0.041 0.487±0.030 0.411±0.012 H2O2 200 μmol/L 组 0.391±0.024 0.352±0.031 0.231±0.043 H2O2 300 μmol/L 组 0.305±0.102 0.272±0.087 0.178±0.010 H2O2 400 μmol/L 组 0.013±0.001 0.004±0.009 0.001±0.006
2.4 各组各蛋白表达的比较
处理48h 后,各组Bax、Bcl-2、Cleaved-Caspase-3、Nrf2 总蛋白、Nrf2 核蛋白、Nrf2 浆蛋白表达的比较,经方差分析,差异有统计学意义(P<0.05)。与正常对照组比较,H2O2各个浓度组Bax 表达下降(P<0.05);与正常对照组比较,H2O2低浓度组Bcl-2 表达差异无统计学意义(P>0.05),其余各组差异有统计学意义(P<0.05);H2O2各个浓度组Cleaved-Caspase-3 表达下降(P<0.05);各个浓度组Nrf2 总蛋白、核蛋白表达升高(P<0.05);Nrf2 浆蛋白表达下降(P<0.05)。与H2O2高浓度组比较,Nrf2 抑制组Bax 表达升高(P<0.05)、Bcl-2 表达降低(P<0.05)、Cleaved-Caspase-3表达升高(P<0.05),Nrf2 抑制组的Nrf2 总蛋白、核蛋白、浆蛋白基本不表达。见图2 和表3。

图1 各组ROS 含量比较
表2 各组细胞ROS 和SOD 含量 (±s)
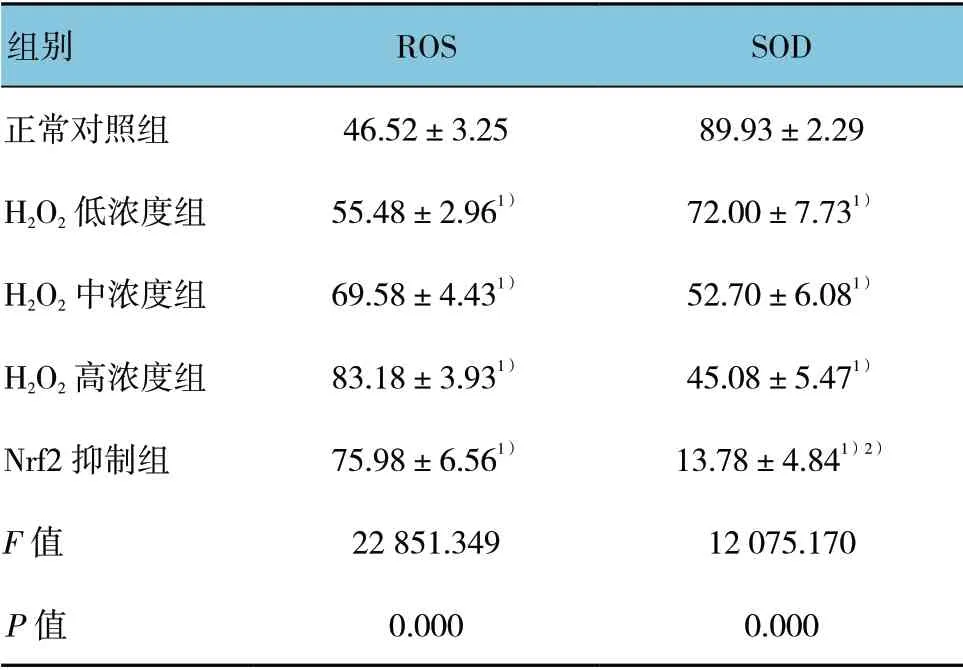
表2 各组细胞ROS 和SOD 含量 (±s)
注:1)与正常对照组比较,P<0.05;2)与H2O2 高浓度组比较,P<0.05
组别 ROS SOD正常对照组 46.52±3.25 89.93±2.29 H2O2 低浓度组 55.48±2.961) 72.00±7.731)H2O2 中浓度组 69.58±4.431) 52.70±6.081)H2O2 高浓度组 83.18±3.931) 45.08±5.471)Nrf2 抑制组 75.98±6.561) 13.78±4.841)2)F 值 22 851.349 12 075.170 P 值 0.000 0.000

图2 Bax、Bcl-2、Cleaved-Caspase-3 及Nrf2 总蛋白、核蛋白、浆蛋白的相对表达量
表3 各组细胞内各蛋白的相对表达比较 (±s)
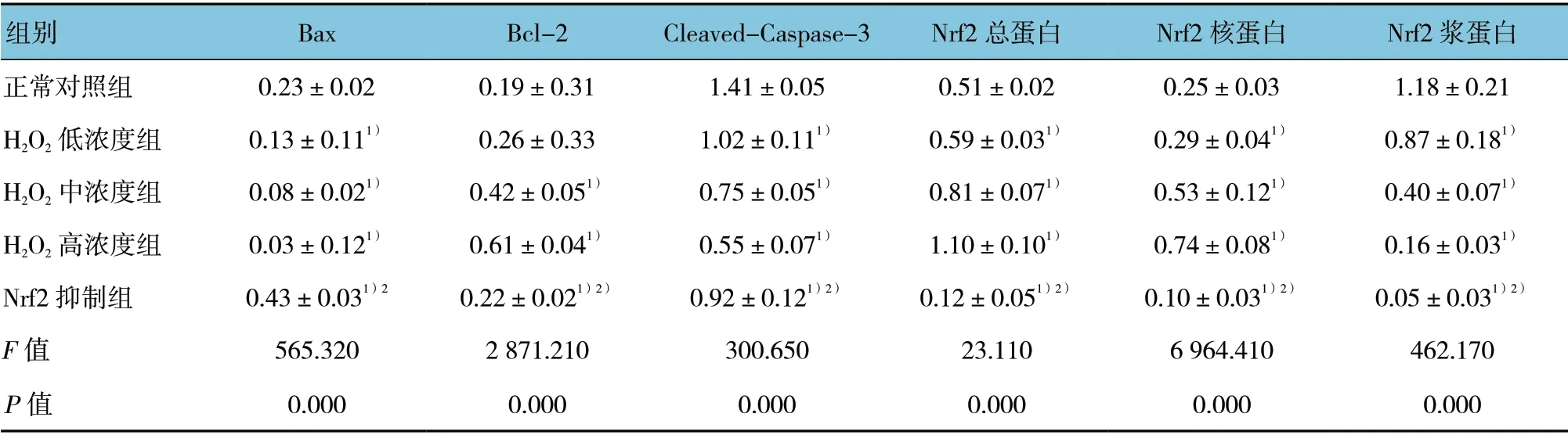
表3 各组细胞内各蛋白的相对表达比较 (±s)
注:1)正常对照组比较,P<0.05;2)与H2O2 高浓度组比较,P<0.05
组别 Bax Bcl-2 Cleaved-Caspase-3 Nrf2 总蛋白 Nrf2 核蛋白 Nrf2 浆蛋白正常对照组 0.23±0.02 0.19±0.31 1.41±0.05 0.51±0.02 0.25±0.03 1.18±0.21 H2O2 低浓度组 0.13±0.111) 0.26±0.33 1.02±0.111) 0.59±0.031) 0.29±0.041) 0.87±0.181)H2O2 中浓度组 0.08±0.021) 0.42±0.051) 0.75±0.051) 0.81±0.071) 0.53±0.121) 0.40±0.071)H2O2 高浓度组 0.03±0.121) 0.61±0.041) 0.55±0.071) 1.10±0.101) 0.74±0.081) 0.16±0.031)Nrf2 抑制组 0.43±0.031)2 0.22±0.021)2) 0.92±0.121)2) 0.12±0.051)2) 0.10±0.031)2) 0.05±0.031)2)F 值 565.320 2 871.210 300.650 23.110 6 964.410 462.170 P 值 0.000 0.000 0.000 0.000 0.000 0.000
2.5 Nrf2 在细胞内的表达和定位
细胞经H2O2各浓度组处理48h 后,与正常对照组比较,Nrf2 表达增多,且发生核内转移,H2O2高浓度组核内转移最为明显。Nrf2 抑制组检测不到Nrf2的表达。见图3。
3 讨论
Nrf2 广泛存在于多个组织器官内,在正常环境下的细胞中,Nrf2 处于静止状态,并不表达。当细胞处于氧化应激状态时,Nrf2 与Keap1 解离并释放[5-6],Nrf2 进入细胞核,Nrf2-ARE 信号通路活化并发挥细胞保护作用,经研究证实,Nrf2-ARE 信号通路调节的内源性保护基因有200 多个,在增强组织抗氧化能力、保护组织细胞免受毒物损害、抗凋亡、抗炎、抗肿瘤等方面起着非常重要的作用[7-8]。该信号通路上调其基因产物的表达对帕金森病、脑出血、白癜风、糖尿病肾病等均具有很强的组织细胞保护能力[9-11]。ROS能引起一系列的生化改变,包括脂质、蛋白、核酸损伤。晶状体上皮细胞细胞膜由脂质组成。当受到自由基的攻击,产生过氧化物。氧化损伤也可以让蛋白结构和构向改变,导致晶状体混浊,自由基也可以导致DNA损伤,引起细胞生物活性改变,导致细胞凋亡、突变,最终晶状体变混浊。

图3 Nrf-2 的表达和定位 (免疫荧光×200)
Bcl-2 家族与Caspase 家族,作为重要的抗凋亡蛋白,在线粒体通路中分别发挥着凋亡调节作用和凋亡执行作用。Bax、Bak 等存在于胞质中,是Bcl-2 家族的促凋亡蛋白,而Bcl-2、Bcl-xL 等则是抑凋亡蛋白,位于线粒体膜上。Cleaved-Caspase-3 是Caspase家族中最重要的凋亡执行蛋白,是细胞凋亡的主要效应因子,它的活化表明细胞凋亡进入不可逆阶段,是Caspase 家族中最重要的促凋亡蛋白。
笔者还发现,促凋亡基因Cleaved-Caspase-3 和Bax 随H2O2浓度升高而下降,而抑凋亡蛋白Bcl-2 随H2O2浓度升高而升高,表明晶状体上皮细胞自身有抗一定的凋亡能力,推测这可能与晶状体上皮细胞氧化应激后,Nrf2 表达增多有关。研究发现,Nrf2 的负性调节除了Keap1 之外,Gsk-3β 可以介导核内Nrf2 的出核降解,从而负性调节Nrf2 相关通路[12]。在本实验中,当Nrf2 活性受到抑制后,晶状体上皮细胞受到上游相同的ROS 的刺激,产生的抗氧化酶SOD 下降,促凋亡基因Cleaved-Caspase-3 及Bax 升高,而抑凋亡蛋白Bcl-2 降低,验证晶状体上皮细胞自身的抗氧化应激与抗凋亡能力与Nrf2 表达有关。
随着H2O2浓度的升高,Nrf2 蛋白表达增多,并且在H2O2中浓度组出现核易位趋势,在H2O2高浓度组出现明显核易位,这表明Nrf 表达增多和核易位增强了晶状体上皮细胞自身抗氧化损伤的能力。
本研究显示,Nrf2 蛋白表达和核易位在晶状体上皮细胞自身抗氧化损伤和凋亡中起重要作用,可为白内障形成机制和药物治疗的研制提供一个新的思路。
