藜麦茶加工工艺及酚类物质组成分析
2019-07-05张艺沛史一恒袁亚宏岳田利
张艺沛,张 婷,史一恒,袁亚宏,岳田利*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
藜麦(Chenopodium quinoa Willd.)是一种藜科植物,原产于南美洲,是一种营养全面的伪谷物。藜麦蛋白质含量高于普通谷物,接近牛奶蛋白价值,具有适宜人类利用的氨基酸组成和比例[1-2]。藜麦油脂中富含人体所必需的ω-3和ω-6等多不饱和脂肪酸[3]。此外藜麦中还含有大量的膳食纤维和其他有益的微量元素,如多酚、维生素和矿物质等[4-5]。Tang Yao等[6]研究发现藜麦中有20多种酚类化合物以游离态和结合态形式存在,主要以酚酸类化合物为主,包括阿魏酸和香草酸及其衍生物;部分以黄酮类存在,如槲皮素、山柰酚及其糖苷等。这些多酚化合物已显示出不同的体外生物学潜力,如抗菌、抗炎、抗氧化、抗肿瘤等多种生物活性[7-9]。目前藜麦的食用方法主要以直接蒸煮为主,市场上深加工产品稀缺,极大地限制了藜麦的流通和消费。
随着生活水平的提高,人们越来越关注食品的健康保健功能。保健功能类茶饮品以其独特的风味和营养特性受到消费者青睐,尤其以谷物杂粮为原料开发的谷物茶越来越受欢迎,并逐渐成为茶饮料市场的主流产品[10]。焙烤作为一种加工工艺,广泛用于谷物食品加工。有研究表明,不同食用种子经过焙烤处理会改变其酚类物质的分布,在某些情况下,焙烤可以增强种子的抗氧化活性进而提高其营养价值。Chandrasekara等[11]发现焙烤可以使腰果总酚含量增加、抗氧化活性增强。Dewanto等[12]研究表明甜玉米经热加工后游离态总酚含量、游离态阿魏酸含量和总抗氧化活性显著增加,结合态总酚含量降低。赵霞[13]总结了焙烤、蒸制和煮制过程中燕麦多酚的变化情况,发现焙烤处理对提高燕麦游离态和结合态多酚含量更具优势。Wu Li等[14]研究高粱茶的加工工艺,发现高粱中的总酚、总黄酮和原花青素含量在浸泡、蒸制过程中显著降低,而在焙烤过程中均显著增加。本研究以去壳藜麦为原料,通过茶汤真空浸制、烘干、焙烤等工艺制成一款新型茶饮料,并研究其游离态和结合态酚类物质组成及含量的变化。旨在扩大藜麦产品市场,为藜麦茶的工厂化生产提供理论基础。
1 材料与方法
1.1 材料与试剂
青藜1号采自于青海省乌兰县藜麦种植基地。
没食子酸、原儿茶酸、对羟基苯甲酸、绿原酸、香草酸、表儿茶素、香兰素、对香豆酸、阿魏酸、异阿魏酸、芦丁、根皮苷、槲皮素、肉桂酸、山柰酚(分析标准品) 上海源叶生物科技有限公司;甲醇、乙酸、乙腈(均为色谱级) 美国天地有限公司;Folin-Ciocalteu显色剂 上海荔达生物科技有限公司;古黟茯砖茶 黄山市天方茶叶有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
SHB-III循环水式多用真空泵 郑州长城科工贸有限公司;RE-5205旋转蒸发仪 上海亚荣生化仪器厂;恒温电热鼓风干燥箱 中仪国科科技有限公司;KWS1538J-F5M电烤箱 格兰仕集团电器股份有限公司;FW-400AD高速万能粉碎机 天津鑫博得仪器有限公司;85-2恒温磁力搅拌器 上海浦东物理光学仪器厂;UV-1240紫外-可见分光光度计、LC-15C高效液相色谱仪 日本岛津公司;HC-3018R型低温高速离心机安徽中科中佳科学仪器有限公司;HWY-2112全温摇床上海南荣实验室设备有限公司。
1.3 方法
1.3.1 工艺流程
藜麦筛选→淘洗过滤→茯砖茶汤真空浸制→烘干→焙烤→冷却→包装→成品。
藜麦筛选:筛选优质的脱壳藜麦,去杂;淘洗过滤:将上述优选的藜麦用清水淘洗2 次,去除灰尘后将水沥干;茯砖茶汤真空浸制:称取60 g古黟茯砖茶,加入2 000 mL水煮20 min,纱布过滤,取茶汤定容到2 000 mL备用。将上述过滤后的500 g藜麦置于真空浸制装置,加入2 000 mL茯砖茶汤,真空度0.07 MPa条件下45 ℃水浴浸制90 min;烘干:将上述浸制过的藜麦置于恒温鼓风干燥箱内,在70 ℃条件下干燥30 min;焙烤:将上述烘干的藜麦置于电烤箱内,201 ℃焙烤10 min;冷却包装:将上述焙烤过的藜麦茶自然冷却至室温后密封包装。
1.3.2 Plackett-Burman试验设计
在单因素试验的基础上确定各因素的范围,以藜麦茶感官评分为响应值,采用Design-Expert 8.0创建一个N为12的Plackett-Burman试验,对茶汤质量浓度(A)、液固比(B)、真空浸制温度(C)、真空浸制时间(D)、烘干温度(E)、烘干时间(F)、焙烤温度(G)、焙烤时间(H)8 个变量进行筛选,另选3 个因素为虚拟变量来衡量试验误差,通过统计分析筛选出对藜麦茶制备有显著影响的因素。
1.3.3 最陡爬坡试验
根据Plackett-Burman试验筛选出的显著因素,设计爬坡方向,确定合适的步长,以藜麦茶感官评分为响应值,快速高效地逼近各个因素的最佳区域。
1.3.4 响应面试验设计
在Plackett-Burman试验的基础上,采用Box-Behnken试验设计方法,选取焙烤温度、焙烤时间、烘干时间3 个影响显著的因素,以最陡爬坡试验的最优值为中心点,设计3因素3水平的响应面试验。综合赵琳[15]和曾亮[16]等优化苦荞茶和青稞茶工艺的评价指标,以感官评分和总酚含量为响应值进行优化。试验设计如表1所示。

表1 Box-Behnken试验因素与水平Table 1 Factors and levels used for Box-Behnken design
1.3.5 藜麦茶感官评价
藜麦茶产品品质由汤色、香气、滋味3 个因素组成,参照GB/T 23776—2018《茶叶感官审评方法》确定各因素的权重为:汤色20%、香气40%、滋味40%。详细评分标准见表2。每份样品称取2 g,加100 mL 80 ℃以上热水浸泡8 min。由10 名(5 男5 女)经过专业培训的人员组成感官评价小组进行品评打分,各因素得分相加即为藜麦茶感官评定总分。

表2 藜麦茶感官评价标准Table 2 Criteria for sensory evaluation of quinoa tea
1.3.6 酚类化合物的提取
参考Sani等[17]的方法并进行适当调整。分别取藜麦和藜麦茶,35 ℃烘干后充分粉碎成粉末过120 目筛,密封干燥备用。精确称取3 g粉末与20 mL 70%甲醇溶液(含有0.01% HCl)溶液混合,以400 r/min转速在室温下搅拌2 h,随后超声15 min,将混合物在6 000 r/min条件下离心15 min,收集上清液,将残余物按上述步骤重复提取2 次。合并60 mL粗提液,此处得到的是游离态和结合态的酚类物质,用于进一步研究不同的生物活性组分。
取15 mL粗提液蒸发至干,重悬于3 mL酸化水(用HCl调至pH 2),用2 mL乙酸乙酯萃取,重复3 次,合并有机层用N2吹干,得到的残留物为游离态酚酸,重溶于3 mL 70%甲醇溶液,置于-20 ℃冰箱待测。
对于水相部分,加入4 mol/L NaOH(终浓度为2 mol/L),室温下反应4 h,用HCl调至pH 2。将释放的酚类物质用乙酸乙酯萃取3 次,得到碱水解结合酚类。剩余水相用HCl(终浓度为2 mol/L)在85 ℃水解1 h,将释放的酚类物质用乙酸乙酯萃取3 次,得到酸水解结合酚类。
茯砖茶汤酚类物质提取:取20 mL制备好的茶汤浓缩至3 mL,用2 mL乙酸乙酯萃取,重复3 次,合并有机层用N2吹干,重溶于4 mL 70%甲醇溶液,置于-20 ℃冰箱待测。
1.3.7 总酚含量和总黄酮含量测定
使用Folin-Ciocalten法测定总酚含量。分别取50 μL没食子酸标准品和样品,加1 mL去离子水,125 μL Folin-Ciocalten试剂,混匀静置8 min,加375 μL 7.5% Na2CO3溶液,加水至2.5 mL,室温避光2 h,于765 nm波长处测定吸光度[18]。没食子酸标准溶液质量浓度分别为0、50、100、150、200、250、300、350、400 mg/L,样品总酚含量表示为每克中含没食子酸毫克数。
总黄酮含量测定采用亚硝酸钠-氯化铝法。分别取250 μL儿茶素标准品和样品,加入1 100 μL、0.066 mol/L NaNO2溶液混匀反应5 min,加入150 μL、0.75 mol/L A1Cl3溶液混匀反应5 min,加入1 mL、0.5 mol/L NaOH溶液,补水至2.5 mL,充分混匀反应6 min后在510 nm波长处测定吸光度[19]。儿茶素标准溶液质量浓度为0、31.25、62.5、125、250、500 mg/L,样品总黄酮含量表示为每克含儿茶素毫克数。
1.3.8 高效液相色谱对酚类物质组成分析
采用Water xTerra MS C18色谱柱(250 mm×4.6 mm,5 μm)。流动相A:含0.5%乙酸-乙腈溶液(50∶50,V/V),流动相B:2%乙酸溶液。梯度洗脱条件:0~50 min,10%~55% B;50~60 min,55%~100% B;60~65 min,100%~10% B;65~75 min,保持10% B[20]。柱温40 ℃;流速1 mL/min;进样量20 μL。对于不同的酚类化合物,分别在波长280 、320 nm和360 nm处检测。
1.4 数据处理
采用Design-Expert 8.0软件进行试验设计,采用OriginPro 9.0、SPSS 19软件进行作图和数据分析。P<0.05,差异显著;P<0.01,差异极显著。所有数据均重复测定3 次,结果以平均值表示。
2 结果与分析
2.1 Plackett-Burman试验设计结果
8 个因素12 组试验,以藜麦茶感官评分为响应值,每组平行测定3 次,结果见表3。
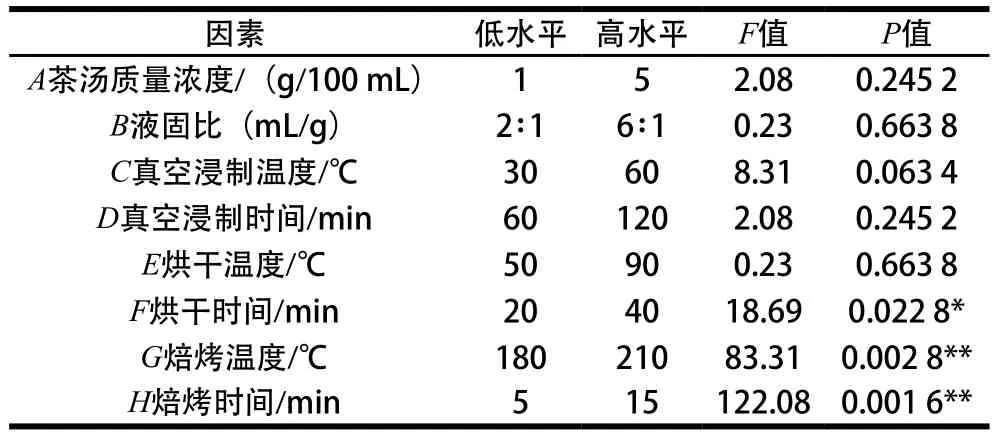
表3 Plackett-Burman试验因素水平及影响Table 3 Factors and levels used for Plackett-Burman design and significance test
从表3可以看出,烘干时间(P=0.022 8)对藜麦茶感官评分影响显著,焙烤温度(P=0.002 8)和焙烤时间(P=0.00 16)对藜麦茶感官评分影响极显著,对这3 个因素进一步优化,影响不显著的因素根据其效应的正负和大小取值。
2.2 最陡爬坡试验结果
根据Plackett-Burman设计结果,选取烘干时间、焙烤温度、焙烤时间3 个因素进行最陡爬坡试验,结果如表4所示。

表4 最陡爬坡试验设计及结果Table 4 Steepest ascent design with experimental results
由表4可知,第3组得到的感官评分最高,故3 个因素的中心点分别为:烘干时间30 min,焙烤温度200 ℃,焙烤时间10 min。
2.3 响应面试验结果
2.3.1 Box-Behnken试验设计方案及结果
应用Design-Expert 8.0数据处理软件对试验数据进行拟合,结果如表5所示。

表5 Box-Behnken试验设计及结果Table 5 Box-Behnken design with experimental results
2.3.2 模型的建立与方差分析
对以上数据进行分析,经二次多元回归拟合,结果如表6、7所示。2 个模型的P值均小于0.000 1,失拟项P值均大于0.05,表明回归模型极显著。预测值与实验值之间有很好的相关性R2(感官评分)值为0.995 6,R2(总酚含量)值为0.997 1。由F值可知,各因素对藜麦茶感官评分和总酚含量的影响大小均为:焙烤温度(A)>焙烤时间(B)>烘干时间(C)。经回归拟合,分别得到Y1(感官评分)和Y2(总酚含量)的二次元回归方程:
Y1=85.40+1.75A+0.75B+0.50C-3.00AB-1.00AC-1.00BC-9.20A2-2.70B2-1.70C2
Y2=3.65+0.49A+0.21B+0.04C-0.055AB-0.071AC+0.049BC-0.30A2-0.099B2-0.11C2
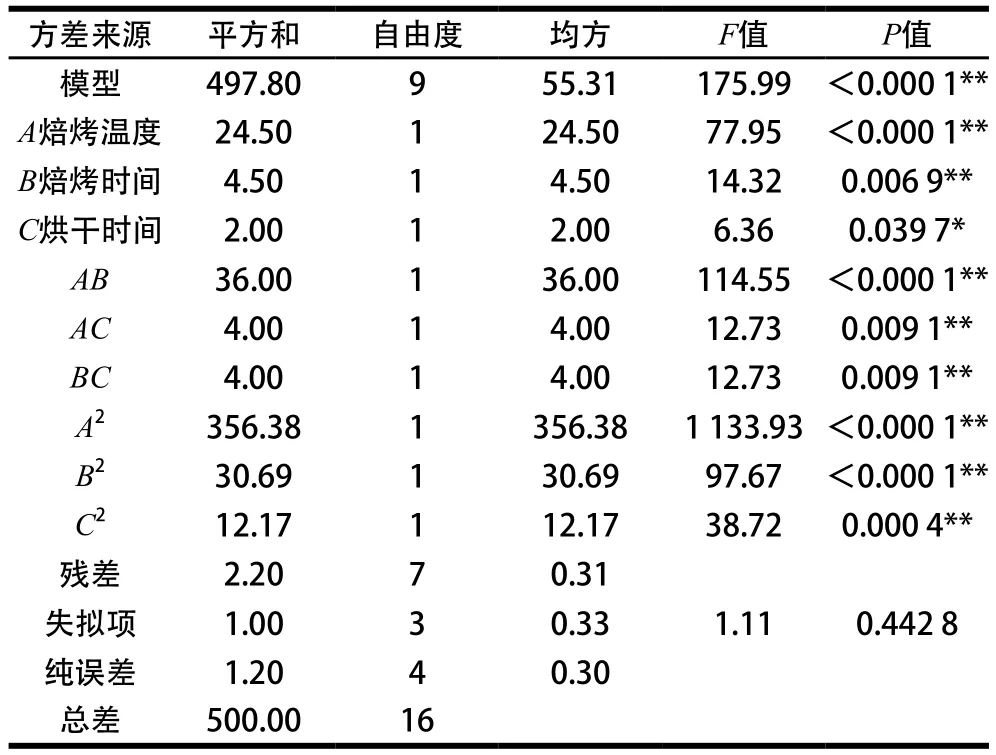
表6 感官评分的方差分析Table 6 Analysis of variance of sensory evaluation

表7 总酚含量的方差分析Table 7 Analysis of variance of total phenolic content
2.3.3 响应面优化分析
对表5数据进行处理得到响应面,由图1a、b可知,当焙烤时间和烘干时间一定时,随着焙烤温度的升高感官评分先增大,达到极大值后,随着焙烤温度的增高,感官评分开始下降。这是由于焙烤温度过低藜麦茶有生味,而温度过高会有焦糊味。由图1a、c可知,当焙烤温度和烘干时间一定时,随着焙烤时间的延长,感官评分先增大后减小,由于焙烤时间短,藜麦茶的香气没有被烤制出来,而焙烤时间过长会产生焦糊味。由图1b、c可知,当焙烤温度、焙烤时间一定时,随着烘干时间的延长感官评定也是先增大后减小的变化趋势,但是图像的曲线走势较平滑,说明烘干时间对感官评分的影响没有焙烤温度和焙烤时间显著。
由图1d~f可知,焙烤温度、焙烤时间和烘干时间两两交互项对藜麦茶的总酚含量均产生了显著影响。比较图1e、f,焙烤温度对藜麦茶总酚含量的影响较焙烤时间显著,再比较图1d、e,焙烤时间对藜麦茶总酚含量的影响较烘干时间显著,这与方差分析结果一致。如图1d所示,当烘干温度处于0水平时,藜麦茶总酚含量随焙烤温度升高而增加,且在焙烤温度0~1水平时增加最显著,这与Carciochi等[21]研究结果一致。当固定焙烤温度时,藜麦茶总酚含量随焙烤时间延长先增大后减小。如图1e所示,焙烤时间处于0水平,当固定烘干时间时,藜麦茶总酚含量随焙烤温度增加而增加。如图1f所示,焙烤温度处于0水平时,焙烤时间和烘干时间的交互作用比其他两两交互项的交互作用弱。当固定烘干时间时,藜麦茶总酚含量随焙烤时间延长而增加。当固定焙烤时间时,藜麦茶总酚含量随烘干时间延长先增加后减小。
由回归方程拟合得出藜麦茶的最佳加工工艺条件为:焙烤温度201.32 ℃、焙烤时间10.31 min、烘干时间30.31 min。此条件下模型预测的感官评分为84.93,总酚含量为3.81 mg/g。结合实际生产,将理论值修正为焙烤温度201 ℃、焙烤时间10 min、烘干时间30 min,此条件下进行验证实验,所得藜麦茶的感官评分为86.32,与预测值相比误差为1.6%;总酚含量为3.73 mg/g,与预测值相比误差为2.1%,可见由该模型优化的藜麦茶最优工艺条件准确可靠。
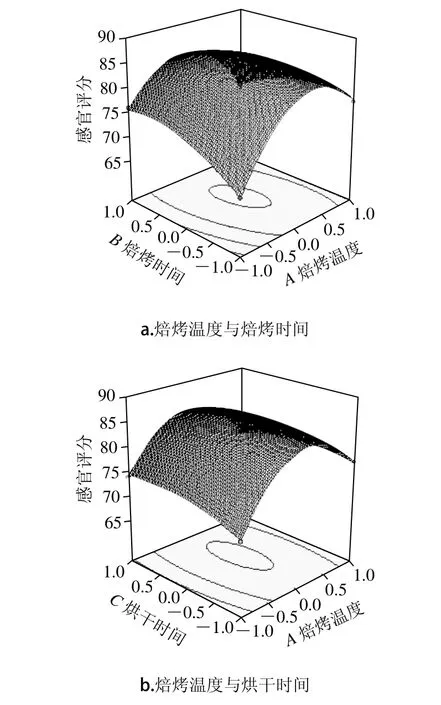
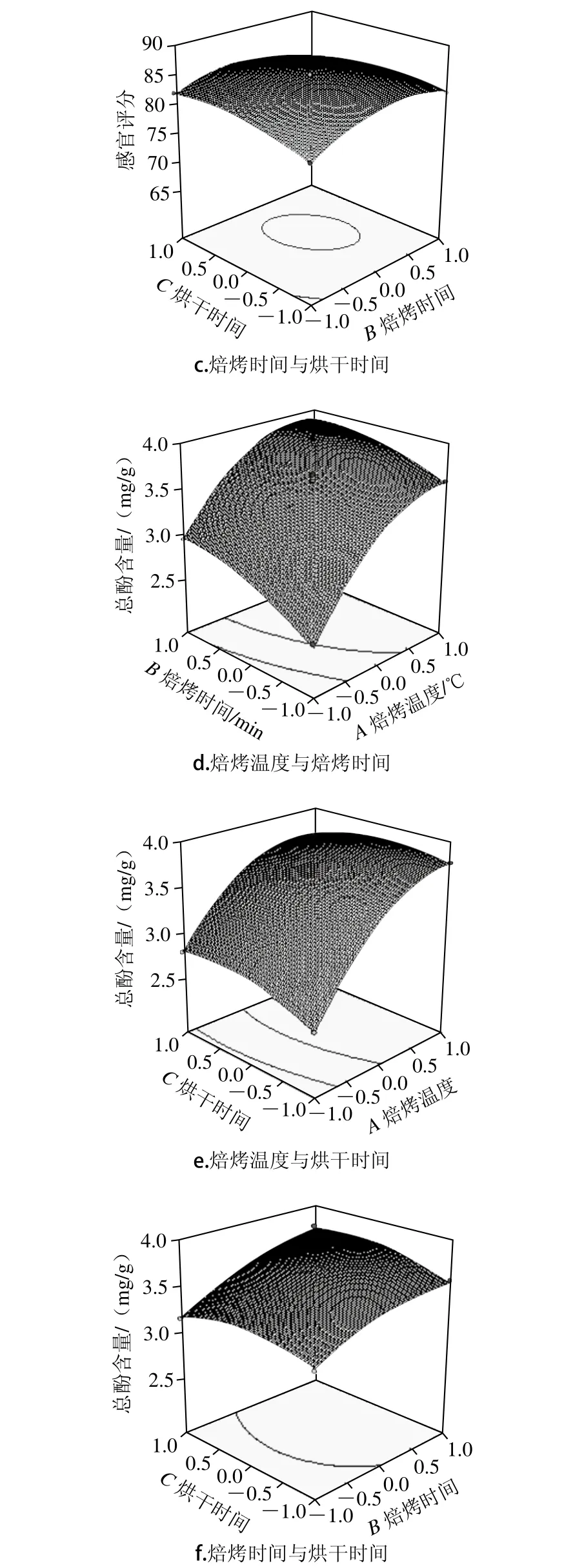
图1 各因素交互作用对藜麦茶感官评分和总酚含量影响的响应面图Fig. 1 Response surface plots showing the interactive effects of factors on sensory evaluation and total phenolic content of quinoa tea
2.4 总酚和总黄酮含量的测定结果
如图2所示,藜麦和藜麦茶的总酚含量和总黄酮含量有相似的变化趋势。经过茶汤浸制和焙烤,藜麦茶中游离态酚类含量增加了54%,游离态黄酮含量增加了16%。由于藜麦的水分质量分数为7.44%,藜麦茶的水分质量分数为8.71%,两者水分含量相差较小,干物质含量基本一致,故藜麦茶中酚类物质含量的提高与水分含量无关。藜麦的游离态酚类含量为2.302 mg/g,与Tang Yao等[6]研究的白藜麦游离态酚类含量相当,碱水解和酸水解结合态酚类具有较高的总酚含量表明藜麦的酚类化合物大部分以结合态形式存在。藜麦酸水解结合态酚类的总酚含量高达4.437 mg/g,是游离态总酚含量的1.9 倍,但并不代表其酚类物质含量高。Chen等[22]报道相比于游离态和碱水解结合态酚类,酸水解的结合态酚类对总酚含量的贡献更高,因为水层用HCl在85 ℃水解1 h,产生了非常高浓度的呋喃衍生物,可与Folin-Ciocalteu试剂反应并导致总酚含量的显著增加。

图2 藜麦和藜麦茶中游离态、2 种结合态酚类物质的总酚(A)和总黄酮(B)含量Fig. 2 Total phenolic and flavonoids contents of free and bound phenolics in quinoa and quinoa tea
分析藜麦茶总酚含量增加的原因如下:1)热处理过程中部分细胞成分和细胞壁组分被降解释放结合的酚类化合物,或者结合态多酚在高温条件下降解,促进游离态多酚的释放[23-24];2)焙烤过程中发生美拉德反应和焦糖化反应,会干扰Folin-Ciocalteu法测定总酚含量,导致表观酚浓度上升[25];3)焙烤促使一些酚类物质的可提取性增加,如Abdel-Aal等[26]研究表明小麦经过焙烤可以释放酚酸及其衍生物,从而导致游离态酚类含量增加。同时茯砖茶汤浸入到藜麦中,茶汤一定程度上赋予了藜麦茶更高含量的游离态多酚。游离态黄酮含量增加的可能原因是:一方面热处理破坏细胞壁的完整性,促进黄酮类物质的暴露和结合型黄酮的分解;另一方面,热处理钝化氧化酶,防止黄酮类物质氧化损失[27]。目前对于谷物热处理后结合态酚类含量的变化研究较少,本研究发现藜麦经焙烤处理,藜麦茶的碱水解结合态酚类含量增加了12%,酸水解结合态酚类含量降低57%,结合态酚类含量总体呈下降趋势。Dewanto等[28]研究玉米在热处理后结合态酚类含量有所降低,与本研究的变化趋势一致。
2.5 高效液相色谱分析藜麦和藜麦茶中的酚类化合物
采用高效液相色谱对藜麦和藜麦茶中的酚类物质组成进行分析,综合Pellegrini[3]和Fischer[5]等对藜麦酚类物质组成的研究选取15 种多酚单体标准品,在波长280 nm检测条件下的液相色谱图如图3所示,所有酚酸质量浓度均为0.02 mg/mL。对比标品色谱图,藜麦和藜麦茶中的游离态、结合态酚类化合物含量分别如表8、9所示。

图3 15 种多酚标准品在280 nm波长处的色谱图Fig. 3 Chromatogram of 15 polyphenol standards detected at 280 nm

表8 藜麦和藜麦茶中游离态酚类化合物含量Table 8 Concentrations of free phenolics in quinoa and quinoa tea samples
没食子酸、对羟基苯甲酸、阿魏酸和异阿魏酸是藜麦中主要的酚酸类化合物,槲皮素和山柰酚是其主要的黄酮类化合物,并且大多数酚类化合物主要以结合态形式存在。
由表8可知,藜麦茶中的游离态总酚指数是藜麦的2.3 倍,但不同的酚类化合物热稳定有所差异。根据化学结构分析,酚酸主要分为羟基苯甲酸和羟基肉桂酸两大类[29]。经焙烤处理,羟基苯甲酸类中没食子酸、原儿茶酸、对羟基苯甲酸和香草酸含量均显著增加;羟基肉桂酸类中阿魏酸和异阿魏酸含量有所下降,而对香豆酸含量显著增加。黄酮醇类中芦丁、槲皮素、山柰酚含量急剧增加。黄烷醇类中表儿茶素和根皮苷含量有所上升。香兰素热稳定性差,经焙烤处理在藜麦茶中未检出。谷物中游离态酚酸热加工后的变化情况越来越受到人们的关注。本研究发现经焙烤加工,藜麦茶的游离态酚酸含量增加,一方面来源于藜麦本身,通过糖基化、酯化作用结合在藜麦基质中的酚类化合物可以通过焙烤释放[27];另一方面来源于茯砖茶汤,其含有丰富的没食子酸、原儿茶酸、香草酸、表儿茶素和对香豆酸。Rakic等[30]研究表明存在于天然谷粒提取物中的可水解单宁在高温下降解,导致非单宁酚类含量增加,尤其是没食子酸。Hithamani等[31]发现小米经焙烤处理后,游离态酚酸含量增加,其中对羟基苯甲酸、香草酸、芥子酸、阿魏酸、对香豆酸均有所增加,且这些酚酸的生物利用度有所提高。
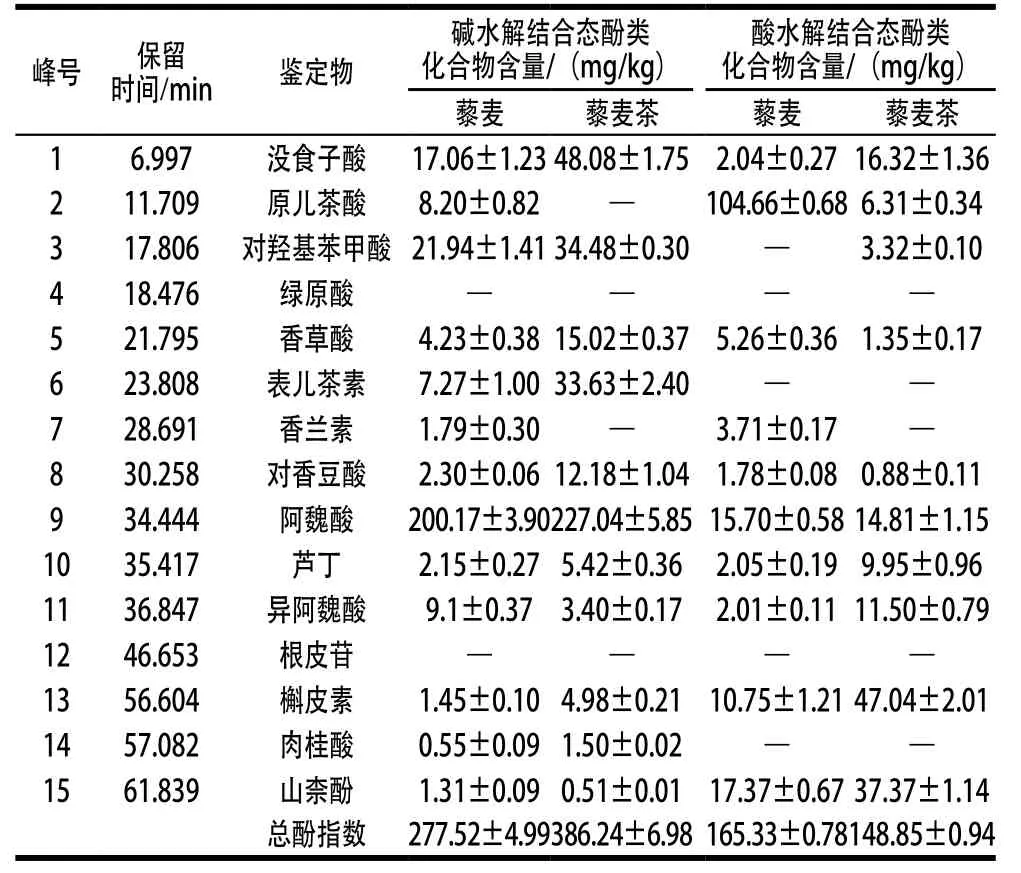
表9 藜麦和藜麦茶中结合态酚类化合物含量Table 9 Concentrations of bound phenolics in quinoa and quinoa tea samples
由表9可知,13 种酸、碱水解结合态酚类化合物已在游离态中被提取和鉴定。藜麦中结合态的原儿茶酸、对羟基苯甲酸、阿魏酸、槲皮素和山柰酚含量远高于游离态,表明这些酚类化合物大部分以结合态形式存在。经焙烤加工,羟基苯甲酸类中没食子酸、香草酸和对羟基苯甲酸含量有不同程度的增加,而原儿茶酸显著下降。羟基肉桂酸类中对香豆酸、阿魏酸和异阿魏酸有小幅增加。结合态酚酸含量的增加是由于细胞壁的破裂和细胞成分的分解导致结合态酚酸的释放[32]。Clifford[33]指出羟基肉桂酸中咖啡酸、对香豆酸、阿魏酸通常以结合态形式存在,经过热处理释放出来,这与本研究结果一致。黄酮醇类中芦丁、槲皮素和山柰酚含量显著增加。黄烷醇中表儿茶素含量增加,而根皮苷在结合态酚类化合物中未检出。
综上分析可知,藜麦中的羟基苯甲酸比羟基肉桂酸具有更高的热稳定性。Liazid等[34]研究表明酚酸的降解取决于苯环结构上的取代基(尤其是羟基和甲氧基)的数量和类型,因此藜麦中羟基肉桂酸的丙烯酸侧链上与苯环连接的羧基比羟基苯甲酸的羧基更容易脱羧。经茶汤浸制、焙烤处理,藜麦茶的游离态总酚指数和结合态总酚指数分别是藜麦的2.3 倍和1.2 倍。除香兰素、阿魏酸和异阿魏酸,藜麦茶中的12 种游离态酚类化合物含量均有所增加;对于结合态酚类化合物,除原儿茶酸、香兰素、根皮苷之外,其余均有不同程度的增加。
3 结 论
本研究采用Plackett-Burman试验、Box-Behnken试验设计和响应面分析,得出藜麦茶加工过程中影响其感官评分和总酚含量的3 个主要因素是焙烤温度、焙烤时间和烘干时间。响应面分析结果确定藜麦茶最优工艺条件为:烘干时间30 min、焙烤温度201 ℃、焙烤时间10 min。在此条件下加工的藜麦茶感官评分为86.32 分,总酚含量为3.73 mg/g。此外,本研究测定了藜麦和藜麦茶中不同形态的酚类化合物含量和黄酮含量,结果表明藜麦中的酚类化合物大部分以结合态形式存在。经焙烤加工,藜麦茶中的游离态酚类含量和黄酮含量分别增加了54%、16%。进一步采用高效液相色谱定性、定量分析藜麦和藜麦茶中的15 种酚类化合物,结果表明藜麦的酚类物质主要以酚酸为主,其中没食子酸和阿魏酸占藜麦游离态酚类化合物含量的46%。黄酮类化合物主要包括槲皮素和山柰酚。焙烤加工后藜麦茶的游离态总酚指数和结合态总酚指数分别是藜麦的2.3、1.2 倍,且大部分单体酚类化合物均有不同程度的增加。
