发酵对酸肉蛋白质结构的影响
2019-07-05段珍珍周才琼
常 荣,韦 诚,段珍珍,周才琼*
(西南大学食品科学学院,重庆市特色食品工程技术研究中心,重庆 400715)
肉制品在加工保藏中普遍发生蛋白质的氧化降解,促进肽键的断裂及疏水性氨基酸的暴露,导致蛋白质结构改变,增加风味物质结合位点,从而影响加工肉制品风味品质[1]。通常情况下,适度氧化水解有利于促进风味发展,而剧烈的降解会导致不良风味产生,严重的蛋白氧化聚集会使蛋白结构稳定性降低,导致产品品质下降[2]。
酸肉是一种以新鲜猪肉为原料,添加适量米粉发酵产酸后制成的一类流行于西南地区的地方特色美食。传统酸肉一般在发酵约20 d开始食用,并采用发酵方式保藏直至食用完毕,周期约半年。有关酸肉的研究多集中在湖南侗族酸肉发酵条件[3]、微生物区系[4]及风味形成[5]等;本团队在对渝黔地区酸肉发酵中微生物区系、风味品质等研究中,认为合适发酵时间在20~40 d[6-8];考虑酸肉以发酵方式保藏,微生物及产酸等持续作用,使酸肉成为一个动态体系,其中的蛋白质会发生持续的氧化降解,这些变化可能影响酸肉蛋白质的结构,进而影响酸肉品质。因此,研究酸肉蛋白质在长时间发酵中的结构变化可提供酸肉发酵保藏中蛋白质营养和风味变化可能的机制。
1 材料与方法
1.1 材料与试剂
新鲜猪背最长肌、湖北大米、食盐购自重庆北碚天生丽街永辉超市。大米炒至微黄,粉碎过20 目筛,备用。
尿素、磷酸二氢钾、磷酸氢二钠、三氯乙酸、氯化钾、溴酚蓝(bromophenol blue,BPB)、β-巯基乙醇(均为分析纯) 重庆骏伟生物科技有限公司;乙二胺四乙酸二钠(ethylene diamine tetraacetic acid,EDTA)、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三羟甲基氨基甲烷(Tris) 重庆市钛新化工有限公司;1-苯胺基-8-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 上海源叶生物科技有限公司。
1.2 仪器与设备
UV-2450紫外分光光度计 日本岛津公司;XHF-DY高速分散器 宁波新芝生物科技股有限公司;5810 R型台式冷冻高速离心机 德国Eppendorf公司;F-2500荧光分光光度计 日本日立公司;DXR2拉曼光谱仪器美国赛默飞公司。
1.3 方法
1.3.1 酸肉制备
猪肉洗净沥干,切成约3 cm×5 cm×0.5 cm薄片,猪肉、米粉和食盐按质量比85∶10∶5混匀,装坛,水密封,20~25 ℃发酵。于不同发酵时间(0、20、50、80、110、140、180 d)取样置-80 ℃贮藏,并在4 ℃解冻4 h后用于分析。
1.3.2 蛋白质的提取
1.3.2.1 肌浆蛋白的提取[9]
5 g绞碎样品,加入20 mL冰冷50 mmol/L Tris-HCl提取液(pH 8.3,含10 mmol/L EDTA)高速匀浆1 min,匀浆液在4 ℃、2 000×g离心10 min后纱布过滤,取上清液,用双缩脲法调整蛋白浓度后待分析。
1.3.2.2 肌原纤维蛋白的提取[10]
取5 g绞碎样品,加入25 mL缓冲液A(pH 7.0、20 mmol/L PBS,150 mmol/L NaCl,25 mmol/L KCl,3 mmol/L MgCl2,4 mmol/L EDTA,1 mmol/L PMSF),高速均质1 min(冰浴中进行),使用纱布过滤匀浆液除去结缔组织等杂质,滤过液4 ℃、4 000×g冷冻离心15 min,弃上清液,沉淀部分先用0.1 mol/L的NaCl洗涤2 次后,再用25 mL PBS(20 mmol/L,pH 6.0)洗涤2 次。最后将沉淀悬浮于含有0.6 mol/L NaCl的PBS(20 mmol/L,pH 6.0)中,离心,上清液为肌原纤维蛋白,采用双缩脲法测定蛋白含量。
1.3.3 蛋白质结构特性分析
1.3.3.1 肌浆蛋白表面疏水性测定
参考Cardamone等[11]的方法。以荧光强度为纵坐标,蛋白质浓度为横坐标作图,曲线初始斜率为蛋白的表面疏水性。
1.3.3.2 肌原纤维蛋白表面疏水性测定
参考Traore等[12]的方法。肌原纤维蛋白表面疏水性以其对BPB结合量表示,计算公式如下:
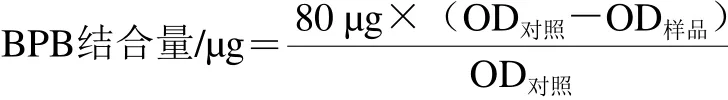
1.3.3.3 蛋白质分子间相互作用力测定[13]
溶液包括:0.6 mol/L KCl(S1);20 mmol/L Tris,pH 8.0(S2);20 mmol/L Tris,pH 8.0,包含1 g/100 mL SDS(S3);20 mmol/L Tris,pH 8.0,包含1 g/100 mL SDS和8 mol/L尿素(S4);20 mmol/L Tris,pH 8.0,包含1 g/100 mLSDS,8 mol/L尿素和2%(V/V)β-巯基乙醇(S5);0.5 mol/L NaOH(S6)。取2 g绞碎肉样(去除可见脂肪和筋膜),分别加入20 mL上述溶液,室温下磁力搅拌4 h,其中S5搅拌前先100 ℃水浴2 min。样品12 100×g离心30 min,吸取4 mL上清液至离心管中并加入1 mL 50%三氯乙酸溶液,3 ℃放置过夜,之后4 000×g离心20 min,沉淀用0.5 mol/L NaOH溶液溶解,采用双缩脲法测定溶解液蛋白含量。结果以各部分蛋白含量占S6蛋白含量的百分比表示。
1.3.3.4 内源荧光测定
参考Lobo等[14]的方法。激发波长283 nm或295 nm,激发和发射狭缝宽度均为2.5 nm,扫描速度1 500 nm/min,获取300~400 nm波长之间的发射光谱。
1.3.3.5 紫外吸收测定
参考任丽娜[15]方法并适当修改。将样品液用0.6 mol/L KCl溶液稀释至0.5 mg/L,以0.6 mol/L KCl溶液作为空白,波长扫描范围为220~320 nm,测定样品的紫外吸收及二阶导图谱,每个样品重复3 次。
1.3.3.6 拉曼光谱测定
参考Zając等[16]的方法。采用OMNIC软件对图谱进行基线校正、平滑等处理,Peakfit 4.12软件进行分峰拟合。
1.4 数据处理
采用SPSS 22.0软件对数据进行分析,Origin 8.6软件绘图。
2 结果与分析
2.1 酸肉发酵中蛋白分子间相互作用力变化

表1 蛋白质分子相互作用力在酸肉发酵中的变化Table 1 Changes in protein-protein interactions during sour pork fermentation
本实验采用5 种不同的溶剂规避不同的蛋白质相互作用力,其中KCl、SDS、尿素分别能够规避静电作用力、氢键、疏水作用力,而巯基乙醇则能够打破二硫键,因此蛋白质在S1、S3、S4、S5中的溶解量分别表示静电相互作用、氢键、疏水相互作用及二硫键对蛋白三级结构的贡献,结果见表1。发酵0 d时,S3>S4>S5>S1>S2,说明猪肉蛋白天然结构由氢键、疏水相互作用力、静电相互作用力及二硫键共同维系;从量的角度看,主要是氢键和疏水相互作用。发酵后这几种作用力对蛋白三维结构的贡献发生了改变。随发酵时间延长,蛋白质在S1和S2中的溶解度逐渐下降,180 d时,蛋白溶解度分别为发酵0 d时的24.96%和26.57%,可能是发酵产酸等诱发蛋白质天然结构改变,导致其发生变性聚集,进而引起蛋白盐溶性下降。S3在发酵中逐渐增加,50 d后保持稳定略降,推测蛋白分子间氢键在发酵中不断破坏又重新合成。S4和S5在发酵20 d快速增加后波动变化,均明显高于0 d的溶解度,说明经发酵后蛋白疏水相互作用明显增强,从而引起蛋白分子构象发生改变和蛋白聚集,此时,酸诱导蛋白的变性利于蛋白分子展开,使埋藏在分子内部的巯基外露被氧化成二硫键。另外,发酵20~80 d时S4>S5>S3,之后变为S5>S4>S3,表明二硫键在发酵80 d后的酸肉蛋白三维结构中起主导作用。S3~S5未呈规律性较强的变化,可能与发酵后形成非二硫共价键或参与了蛋白三维结构等有关[17]。这些改变对酸肉蛋白凝胶结构的形成和稳定性产生重要影响,可影响酸肉感官品质和营养特性。
2.2 酸肉发酵中蛋白表面疏水性的变化
随发酵时间延长,肌浆蛋白表面疏水性略增后快速下降(峰值为发酵20 d),这可能与发酵初始时(20 d)肌浆蛋白分子逐渐舒展,构象变得疏松和不稳定,使埋藏于非极性环境的蛋白分子内部的疏水基团外露到极性环境中有关。随发酵时间延长,疏水性氨基酸残基大量外露,引起蛋白分子间疏水作用增强,蛋白质发生疏水聚集,使其表面疏水性下降。肌原纤维蛋白表面疏水性随发酵进行快速下降后保持波动变化(图1),说明酸肉的肌原纤维蛋白分子大部分疏水性氨基酸残基主要被包埋在分子内部。谷值出现在发酵50 d时,这可能与发酵中pH值变化及蛋白质在酶作用下的降解有关[18]。
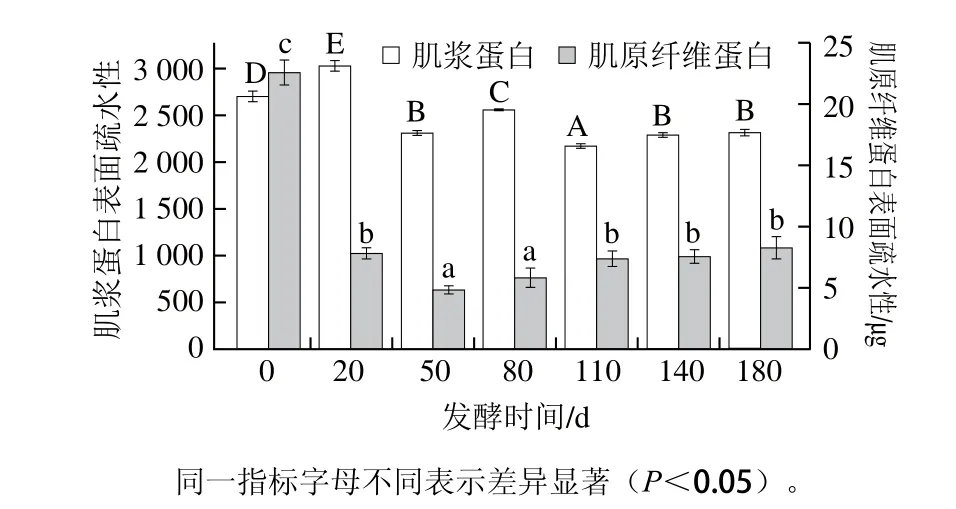
图1 肌浆蛋白和肌原纤维蛋白表面疏水性在发酵中的变化Fig. 1 Changes in surface hydrophobicity of sarcoplasmic proteins and myofibrillar proteins
2.3 酸肉发酵中蛋白紫外吸收的变化


图2 酸肉蛋白质的紫外吸收及其二阶导光谱图的变化Fig. 2 Changes in zero-order and the second-derivative UV spectra of sour pork proteins
发酵20 d后肌原纤维蛋白的紫外吸收图谱相对于发酵0 d差异明显(图2A1),说明发酵改变了酸肉蛋白的结构,特征峰出现波动变化主要与肌原纤维蛋白暴露的色氨酸等氨基酸残基总量有关。经对紫外吸收光谱进行二阶导运算,得肌原纤维蛋白紫外二阶导图谱(图2A2),显示发酵0 d时,284.5 nm和292 nm处有两个负吸收峰,其中284.5 nm处吸收峰归属酪氨酸和色氨酸的共同作用;发酵20 d时紫外二阶导光谱未发生红移或蓝移,发酵50 d后发生了小幅度红移并保持稳定,说明芳香族氨基酸残基向更加疏水的环境移动,平均疏水性增强。
不同发酵阶段肌浆蛋白紫外吸收谱图变化较大(图2B1),说明肌浆蛋白三级结构变化较剧烈。发酵0 d时,肌浆蛋白紫外二阶导图谱(图2B2)中285 nm和293 nm处有负吸收峰,发酵20 d后相对0 d时发生了约1~2.5 nm的蓝移,表明酪氨酸和色氨酸的微环境极性增加。
2.4 酸肉发酵中蛋白内源荧光光谱变化

图3 酸肉蛋白的内源荧光强度变化Fig. 3 Changes in intrinsic fluorescence intensity of sour pork proteins
如图3A所示,发酵20 d时酸肉的色氨酸荧光损失显著,随发酵时间延长色氨酸荧光强度略增后逐渐减弱,180 d时的荧光强度约为发酵0 d时的65.7%,说明在发酵过程中酸肉蛋白暴露的色氨酸残基逐渐减少;可能与蛋白变性舒展,暴露出更多疏水基团,蛋白质分子间相互作用力增强而发生疏水聚集,从而将更多色氨酸残基包埋于蛋白分子内部疏水性更强的环境中有关。色氨酸荧光损失被认为是氧化改变肉类蛋白的初级表达和引起蛋白质营养价值损失[19]。另外,发酵0 d蛋白的最大发射波长为341 nm,发酵50 d红移至345 nm,表明发酵中酸肉蛋白结构逐渐舒展,蛋白分子内部的色氨酸向极性更强的微环境暴露,这与通过UV测得的肌原纤维蛋白疏水性变化趋势不一致,原因与UV所测结果为色氨酸、酪氨酸等氨基酸残基的平均疏水性有关。有报道[20]指出当激发波长为290 nm以上时,可避免如酪氨酸等氨基酸残基对色氨酸荧光的干扰。为此,考察激发波长295 nm时酸肉蛋白内源性荧光的变化(图3B),在此激发波长下的色氨酸荧光强度变化趋势与激发波长283 nm类似。但295 nm激发产生的荧光强度较弱一些。
2.5 酸肉发酵中蛋白拉曼光谱变化
本实验采用拉曼光谱对酸肉进行原位检测,并结合报道的蛋白质拉曼光谱[16]进行比对,对酸肉蛋白肽键骨架和氨基酸侧链的拉曼谱带进行指认,结果见图4和表2。

图4 酸肉蛋白质拉曼光谱图(400~2 000 cm-1)Fig. 4 Raman spectra of sour pork proteins (400-2 000 cm-1)
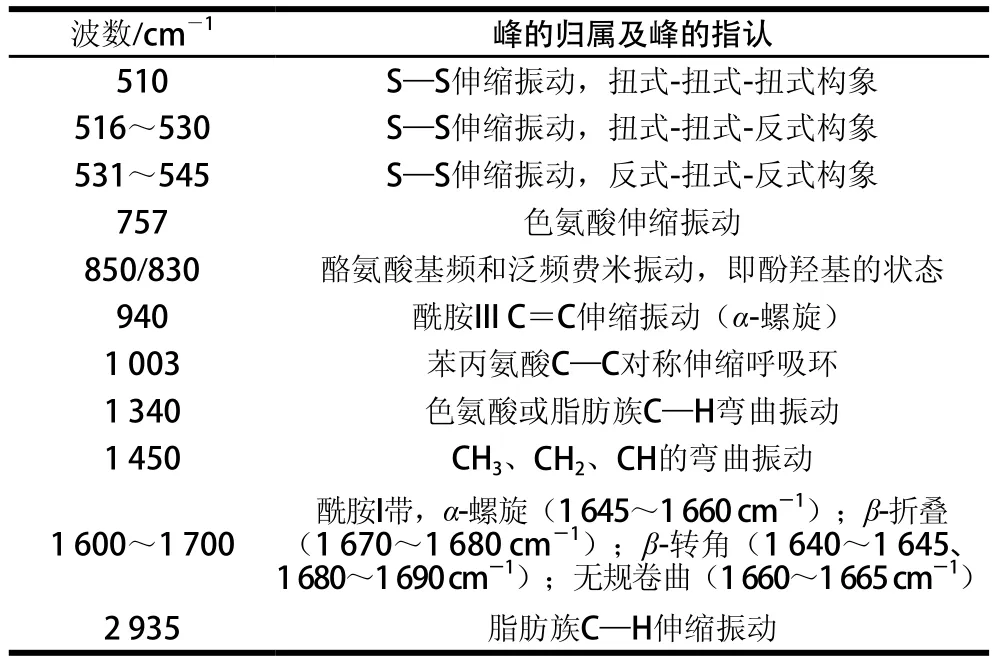
表2 酸肉蛋白质的拉曼特征峰归属及指认Table 2 Assignment of some bands in the Raman spectra of sour pork proteins
2.5.1 S—S伸缩振动变化
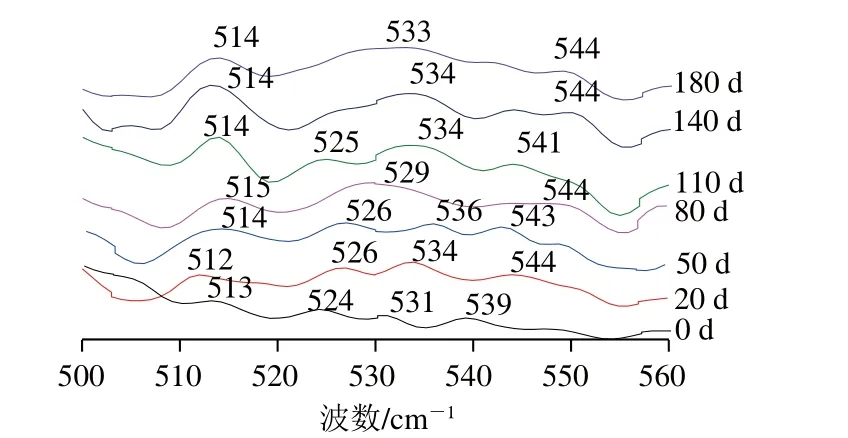
图5 酸肉蛋白质拉曼光谱图(400~2 000 cm-1)Fig. 5 Raman spectra of sour pork proteins (400-2 000 cm-1)
二硫键是稳定蛋白质三级结构的作用力,其构象在拉曼光谱中的吸收谱带为510~550 cm-1,其中515 cm-1附近特征峰为扭式-扭式-扭式构象,525 cm-1附近特征峰为扭式-扭式-反式构象,540 cm-1附近特征峰为反式-扭式-反式构象[21]。不同发酵时段酸肉均存在这三种构象(图5)。随发酵进行,各构象吸收峰均发生小幅波动变化,说明发酵在一定程度影响了蛋白质二硫键。发酵80 d后,525 cm-1附近的特征峰减弱甚至消失,而在529 cm-1或534 cm-1出现一个条带更宽的特征峰,说明原本的二硫键发生损失或扭式-扭式-反式构象的二硫键可能向反式-扭式-反式构象转变。
2.5.2 色氨酸残基微环境变化
757 cm-1附近谱带的伸缩振动可表征芳香族氨基酸中色氨酸残基的微环境变化,当蛋白分子中色氨酸向极性溶剂暴露时,相对峰强度会减弱。发酵20 d时757 cm-1处归一化强度由0 d的1.48下降至0.47并保持稳定(表3),说明经发酵后的酸肉蛋白大部分色氨酸残基在疏水相互作用下暴露到极性更强的环境中,并在一定时间内保持相对稳定状态;发酵110 d时峰强小幅回升,随后逐渐减弱,该变化趋势与蛋白荧光光谱检测趋势相似。
2.5.3 酪氨酸残基微环境变化
特征峰处于850 cm-1和830 cm-1处或邻近谱带可监测色氨酸残基周围的微环境及判断色氨酸残基被包埋程度[22]。由表3可知,发酵0 d时850 cm-1/830 cm-1峰强比为0.95,说明原料蛋白色氨酸残基主要为被包埋状态,有较强的氢键结合[23]。随发酵时间延长逐渐增加后在1.08~1.55间波动,表明色氨酸残基暴露于水溶液或极性环境中,或作为中到弱度氢键的接受体和供体。与Liu Ru等[21]报道鱼和猪肉在加工盐腌阶段,850 cm-1/830 cm-1峰强比呈增加趋势吻合。有报道单独酸化的肌原纤维蛋白色氨酸残基趋向于埋藏在肌球蛋白分子内部,而添加内源蛋白酶后色氨酸残基重新暴露到蛋白分子表面,并认为发酵中蛋白质先发生变性聚集,后发生内源性蛋白酶水解[24]。酸肉在发酵中可能也发生了类似变化。
2.5.4 CH3和CH2弯曲振动
1 450 cm-1附近的拉曼谱带由CH3和CH2的弯曲振动引起,可表征脂肪族氨基酸微环境变化,对疏水相互作用敏感[25]。由表3可知,1 450 cm-1峰强逐渐下降并波动变化,表明不同发酵时段脂肪族氨基酸疏水环境状态存在一定差异。
2.5.5 C—C键伸缩振动
890~1 060 cm-1拉曼谱带可表征C—C键伸缩振动变化,也可获取蛋白质二级结构α螺旋信息。如表3所示,940 cm-1处的归一化峰强度总体呈逐渐下降趋势,表明α-螺旋结构含量降低,但发酵110 d时峰强度相对其他发酵时段有所增强,可能是蛋白质进一步降解引起多肽骨架变化导致。940 cm-1处峰强度变化与曲线拟合计算α-螺旋含量变化趋势基本一致,也印证了发酵110 d时蛋白质可能发生了重组,与曹锦轩等[26]报道吻合。
2.5.6 脂肪族C—H的振动
2 800~3 000 cm-1拉曼光谱可反映脂肪族C—H的伸缩振动变化。如图6所示,发酵0 d酸肉在2 854 cm-1和2 931 cm-1处有两个明显强峰,前者由酰基和CH2对称性伸缩振动引起,后者由CH2和CH3不对称性伸缩振动引起。发酵20 d后这两个峰均向高波数偏移,分别移至2 880 cm-1和2 935 cm-1附近谱带,这可能与脂肪族氨基酸的暴露程度有关[27]。另外,2 935 cm-1处的归一化峰明显强于2 880 cm-1处,说明酸肉脂肪族氨基酸主要以CH2不对称性振动为主。总体上,2 935 cm-1处峰强逐渐减弱后逐渐增强,但各发酵时段峰强均低于发酵0 d时,这可能与发酵后蛋白疏水性增强有关[28]。
2.5.7 二级结构变化
蛋白质酰胺I带(1 600~1 700 cm-1)常用于研究蛋白质二级结构[29]。肉类蛋白用于表征蛋白二级结构酰胺I带的拉曼图谱通常集中在1 645~1 685 cm-1,包括α-螺旋、无规卷曲、β-折叠和β-转角,归属的拉曼谱带分别为1 650~1 658 cm-1、1 660~1 665 cm-1、1 665~1 680 cm-1和1 680 cm-1[30]。采用Peakfit 4.12软件对酸肉蛋白酰胺I带进行傅里叶去卷积结合曲线拟合以获取蛋白二级结构信息变化,得酸肉蛋白在不同发酵时段酰胺I带去卷积后的图谱(图7)。发酵0 d时主导峰位于1 655 cm-1处;20 d时1 654 cm-1主导峰的优势明显减弱;50 d时主导峰偏移至1 662 cm-1,说明α-螺旋逐渐展开;80 d时出现双主导峰(1 655 cm-1和1 662 cm-1),110 d后主导峰又重回1 655 cm-1,说明发酵80~110 d时段α-螺旋有可能重新生成;继续发酵,主导峰逐渐向高波长处移动,180 d时,1 663 cm-1和1 669 cm-1成了新的主导峰,说明无规卷曲结构或β-折叠有所增加。

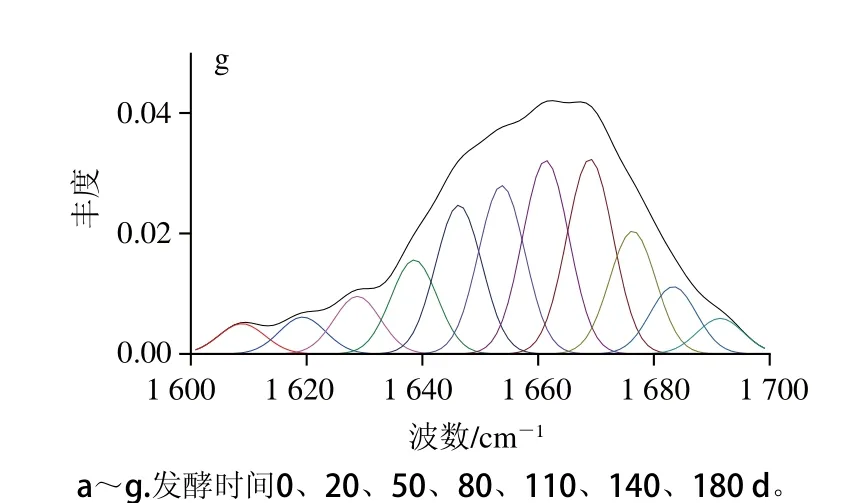
图7 发酵过程中酸肉蛋白质酰胺I带去卷积变化图谱Fig. 7 Deconvolved and curve fitted bands of amide I of sour pork proteins during fermentation

表4 发酵过程中酸肉蛋白二级结构相对含量的变化Table 4 Changes in the relative amounts of protein secondary structures in sour pork during fermentation
由表4可知,发酵0 d蛋白α-螺旋相对含量最高,无规卷曲最低。随发酵进行,α-螺旋和β-转角相对含量逐渐下降;β-折叠呈上升趋势,发酵140 d时超过α-螺旋成为二级结构中主体元素;无规卷曲变化趋势与α-螺旋变化基本相反。这可能是发酵使α-螺旋解旋生成β-折叠或无规卷曲以及β-转角和β-折叠相互转化,使α-螺旋、β-转角相对含量逐渐下降,β-折叠和无规卷曲相对含量上升。有报道[31]指出pH值从7.0降至5.0时,α-螺旋减少、β-折叠增多;NaCl添加量增加,猪肉糜蛋白α-螺旋、β-转角降低,而β-折叠和无规卷曲上升[32],这与本研究变化趋势相似。表明酸肉发酵中添加的食盐及发酵产酸均导致了蛋白质二级结构的变化。其中,发酵80~110 d时α-螺旋相对含量略有上升,可能在此时发生了结构重组,曲线拟合结果与去卷积结果基本吻合。引发重组的原因可能与蛋白降解或蛋白经一定程度酶解引起蛋白质结构、蛋白等电点和疏水性改变有关[33]。
3 结 论
酸肉发酵中优势微生物为乳酸菌,优势菌群主要是片球菌属(Pediococcus)和乳杆菌属(Lactobacillus)[6]。有报道指出乳酸菌可分泌胞外蛋白酶[34],加上乳酸菌产酸及发酵中添加盐的胁迫作用,酸肉蛋白质在长时间发酵中发生了一系列变化,进而影响酸肉的品质。
对酸肉蛋白进行相关三级结构分析发现,酸肉肌原纤维蛋白表面疏水性快速下降后呈较小幅度的下降趋势,且其色氨酸残基发生了荧光损失现象,说明经发酵后肌原纤维蛋白可能发生了疏水聚集。蛋白二级测定结果显示,α-螺旋、β-转角含量基本呈现下降趋势,β-折叠和无规卷曲的含量则基本上呈上升趋势,其中发酵110 d时酸肉蛋白二级结构可能发生了重排现象。蛋白分子间相互作用力结果显示,蛋白分子间相互作用力在发酵中变化显著,静电相互作用力逐渐减弱,而疏水作用力和二硫键明显增强并呈波动变化,是维持酸肉蛋白稳定性的主要作用力。这些结果表明,发酵后,可能在酸和盐的诱导蛋白变性作用下,酸肉蛋白疏水相互作用力显著增强,导致蛋白发生疏水聚集,将更多的疏水性包埋于蛋白分子内部,引起表明疏水性下降和蛋白荧光强度发生下降,而疏水作用力增强和二硫键的增加引起的蛋白聚集和交联,以及氢键作用力增强可能是引起α-螺旋相对含量减少,β-折叠相对含量增多的主要原因。
综上,采用发酵的方式保藏酸肉,会导致蛋白质二级结构、三级结构发生一系列变化,这些变化可从蛋白质结构水平解释发酵对酸肉品质的影响。
