药用植物箭叶淫羊藿EsMIXTA基因的克隆及其表达分析*
2019-07-05李明,孙伟
李 明,孙 伟
(1.北京中医药大学东直门医院药学部 北京 100070;2.中国中医科学院中药研究所 北京 100070)
1 前言
植物的表皮毛(trichomes)是植物叶片和其他器官的表面突起。植物的表皮毛通常被称为腺毛是植物重要的保护组织及次生代谢产物分泌的场所。腺毛可以通过分泌特定的物质从而对抗侵蚀者、微生物的侵扰。从形态学上可以把表皮毛划分为两类细胞分别是单细胞非腺性的,一类是多细胞的腺性的[1]。有些植物可能只具有一类腺毛类型,但大多数植物往往兼有两种腺毛类型。植物各个器官表皮分布着由角质层和疏水的蜡质层组成的化学物质,它们可以有效的增加植物的表皮机械力,同时由于不同组织间角质层和蜡质层的比例不一样,其各个器官的属性也就有着较大的区别。从通过分子生物学手段对模式植物拟南芥研究后发现,拟南芥中的glassy hair 6(glh6)和ATP-binding cassette G family member 11(abcg11)等基因也参与着表皮角质层和蜡质层的生物合成。从调控角度上讲,拟南芥的表皮毛发育同根毛发育具有相同的机制,大部分由MYB-bHLH-WD40转录复合体调控着表皮毛的形成和分化[2]。同时细胞内的离子通道、细胞骨架、微管和微丝的分布也在调控着表皮毛的发育。MYB转录因子是植物中成员庞大的基因家族之一[3,4]。在这其中R2R3类MYB基因则是整个MYB基因家族成员最多,这类蛋白拥有两个MYB repeat结构域,因为被命名为R2R3 MYB。R2R3 MYB基因家族成员在越来越多的物种有所报道,比如其中拟南芥中已发现超过198个MYB家族基因,而在棉花基因组中有200个MYB基因。功能研究表明,MYB类转录因子参与了植物次生代谢物质的调控、植物激素和环境因子应答,同时在植物器官发育角度上看MYB基因在植物细胞的分化、细胞周期调控以及叶片等器官形态建成起到重要的作用。其中的group 9类主要负责表皮细胞的形成和分化。这类基因最早是在金鱼草中报道的,它调控着金鱼草花瓣表皮柱状细胞的形成[5]。同时在金鱼草中也同时存在着MIXTA基因的旁系同源基因即MIXTA-LIKE 1、MIXTA-LIKE 2和MIXTA-LIKE 3,他们都在金鱼草花表皮细胞突起的形成过程中起到了关键性的作用,但是它们的功能并不冗余[6]。除了金鱼草外,MIXTA基因控制植物表皮发育的功能已经在大量植物中进行了克隆及功能验证,他们包括杨树、矮牵牛及树石斛等[7-9]。在拟南芥中AtMYB106和AtMYB16通过不同的方式调控着拟南芥表皮毛的发育,其中AtMYB106和APETALA2/ETHYLENERESPONSE FACTOR(AP2/ERF),WAXES INDUCER1/SHINE1一起调控着拟南芥的角质层形成,从而控制着拟南芥表皮毛的分布。最近通过群体遗传学及二代测序技术相结合生物信息学分析方法对猴面花得EMS突变体进行BSA(Bulk segregation analysis)群体分析后,也阐明了一个和蜜腺发育相关的MIXTA基因[10]。针对药用植物表皮毛发育研究直接关系到药用成分的合成以及分泌,通过对黄花蒿的表皮毛转录组数据库的深入研究,一个名为AaMIXTA1的R2,R3-MYB类的转录因子基因被成功克隆。通过超表达及RNAi实验证明,AaMIXTA1基因可以有效控制青蒿素的合成,这是由于其可以控制黄花蒿叶片表皮毛外表皮蜡质合成基因的表达。通过转基因实验发现超表达AaMIXTA基因的黄花蒿品系并未使黄花蒿的表皮毛形态发生异形改变,同时又提高了青蒿素的含量,这为转基因育种提供了更好的研究思路[11]。从基部真双子叶植物唐松草中克隆得到的MIXTA-like2基因可以使转基因烟草的表皮突起增加,验证了唐松草中MIXTA-like2基因的功能[12]。
淫羊藿为中国传统中草药之一,具有2000多年的悠久历史。《神农本草经》记载,淫羊藿有“主阴痿绝伤,茎中痛,利小便,益气力,强志”的功效。《日华子本草》则称淫羊藿“能治一切风冷劳气,补腰膝,强心力,丈夫绝阳不起,女子绝阴无子。筋骨挛急。四肢不任,老人昏耄,中年健忘”。它不仅具有补肾阳、强筋骨、祛风湿等功效,而且还兼有抗衰老、改善免疫功能、抑制肿瘤和抗骨质疏松等功效,其有效成份主要为黄酮醇苷类物质。针对淫羊藿所开展的调控研究已经在MYB类型的基因有所报道,比如EsMYBA1基因和EsAN2可以调控花青素的生成[13],EsMYBF1可以调控黄酮醇的形成[14],EsMYB9基因可以同时调控花青素和黄酮醇的形成[15]。
淫羊藿的花被从外至内分别称之为外萼片、内萼片和花瓣(距)。外萼片通常为紫色或绿色;外一对较小,卵状长圆形;内一对较大,卵形或阔卵形,有时具白色边。由于该属外萼片较小,早落,种间差别不大,一般不作为分种的依据。内萼片花瓣状,水平展开或略反折,呈三角形、卵形、宽卵形或披针形;花瓣的形态也比较多样化,呈瓣片状、具长距、具短距或囊状等。内萼片形态、花瓣(距)的形态及与二者的大小关系是最稳定的形态性状,在属下分组和分种中具有重要的意义。本项研究以药用植物箭叶淫羊藿作为研究对象,参考本草基因组的方法体系[16,17],通过同源克隆的研究策略成功地对控制表皮毛发育相关基因EsMIXTA进行克隆及表达分析,为以后通过基因工程改造箭叶淫羊藿表皮发育,提高次生代谢产物的合成提供理论依据。
2 材料与方法
2.1 实验材料与实验试剂
大肠杆菌(Escherich coli)DH5α菌株感受态细胞购买于全式金公司。Trizol RNA提取试剂及反转酶Superscript III购自于英伟创津公司(Invitrogen,China);琼脂糖凝胶试剂盒购自于天根公司(Tiangen,China);ExTaq酶、pMD19-T载体及荧光实时定量PCR试剂购自于购自于宝生物公司(Takara,Japan)。
2.2 RNA提取及cDNA第一条链合成
取箭叶淫羊藿的根、叶和花,在180-200℃烘烤过的研钵中用液氮将其充分研磨,迅速倒入无RNA酶的离心管中,待液氮挥发后,按1 mL试剂/100 mg材料的比例加入适量的Trizol反应试剂(Invitrogen公司),并按照Trizol试剂盒的说明书进行RNA的提取。基因3′端 获 得 的 cDNA 合 成 以 3′CDS:5′-AAGCAGTGGTATCAACGCAGAGTAC(T)30N-1N-3′为引物,而 5’端获得的cDNA合成初始则需以引物5′CDS:和SMART II A oligo 5′-AAGCAGTGGTATCAACGCAGAGTACGCGGG-3作为反转录引物,反转录过程参考Superscript III反转录酶说明书。
2.3 EsMIXTA基因的克隆
根据已有报道的唐松草中的MIXTA基因且简并引物作为正向引物[12],以 UPM1:5′-CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT-3′和 UPM2:5′-CTAATACGACTCACTATAGGGC-3′引物作为反向引物进行EsMIXTA基因的3′端克隆。反应体系:以2 μL的第一链cDNA为模板;2 μL正、反向引物(UPM)(10 μM);5 μL 10×PCR 缓冲液;2 μL dNTP(2mM);1 U ExTaq DNA聚合酶;用无菌去离子水将体系补至50 μL。PCR反应条件:94℃变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸1 min,10个循环;每个循环减一度。94℃变性30 s,48℃退火30 s,72℃延伸1 min,25个循环;72℃延伸10 min。结果检测:取PCR产物5 μL,电泳检测,切胶回收,连接载体转化大肠杆菌,挑取阳性克隆进行测序。在获得正确的EsMIXTA基因的3′端后,以该序列作为候选序列,设计基因5′端的反向引物。EsMIXTA基因5′端的获得;反应体系同3′端基因的获得,正向引物为UPM(10 μM);反向引物为基因特异性引物。对EsMIXTA基因5′端及3′端进行分析后设计全长引物EsMIXTAFULF:ATGGGTCGATCACCGTGTGAT和EsMIXTAFULR:CAGGAGAACGGGAGGGAGAA。
2.4 连接产物的转化
从-80℃超低温冰箱中取出感受态细胞,放在冰上,加入5 μL连接产物,混匀,冰浴30 min。将含有感受态细胞和连接产物的离心管置于42℃恒温水浴锅中,热激60 s,不要摇晃。然后,立即冰浴2 min。加入750 μL LB培养基,混匀,置于37℃摇床上,约150 rpm,培养45-60 min。4000 rpm,离心5 min。在含氨苄青霉素的 LB 平板上涂上 X-Gal(20mg·mL)40 μL,晾干。从离心后的离心管中吸去500 μL上清后,用剩余的上清液将菌体混匀,并加入IPTG(200mg/ml)20μl,涂于LB平板上。将平板于37℃培养12-16h。
2.5 EsMIXTA基因的表达模式
以箭叶淫羊藿根、叶、萼片、花瓣及雄蕊雌蕊混合材料为研究对象,用Trizol试剂盒提取总RNA,然后用PrimeScript RT reagent Kit(Takara,Japan)进行,第一链cDNA的反转录。在进行PCR反应前,将第一链cDNA稀释10倍作为模板。然后利用SYBR®Premix Ex TaqTM II(Takara,Japan)反应试剂盒,在型号为ABI7500的实时定量PCR仪上以引物EsMIXTRTF:5′-TAACGGAGCAGTCGAAAAGTGA-3′EsMIXTR:5′-CGGTGTCTCCACTACCGTCTG-3′来完成反应,并根据双标准曲线法利用ABI7500软件(基因有限公司)分析所获得的数据并计算样品中目的基因浓度。本实验所用的PCR反应体系为20 μL,共设置3个重复,反应条件为40个循环,95°5 s、60°34 s。
2.6 系统发育树的构建
序列经过EMBL网站MUSCLE在线软件进行比对,之后再通过Modeltest进行最大似然法参数选择计算,最终运用MEGA 5.0中进行最大似然树(Maximum Likelihood)的构建,自举检验(bootstrapvalue)为1000次。
2.7 花萼片和花瓣表面的扫描电镜观察
收集箭叶淫羊藿花萼片和花瓣立即进行固定和处理材料,其中固定液为FAA或者戊二醛。将固定至少24小时以上的材料,经不同浓度乙醇梯度脱水后转入95%乙醇中,过夜。脱水:将剥出的材料转入无水乙醇中,脱水20 min。此后,将材料相继转入75%乙醇+25%乙酸异戊酯;50%乙醇+50%乙酸异戊酯;25%乙醇+75%乙酸异戊酯;100%乙酸异戊酯中,每级20 min。二氧化碳临界点干燥。将干燥好的原基材料在解剖镜下用双面胶粘在金属台上。在离子溅射仪上对粘好的金属台进行喷金、镀膜。扫描电镜下观察照相。
3 结果与分析
3.1 箭叶淫羊藿EsMIXTA基因的克隆与序列分析
经克隆后测序获得EsMIXTA基因的全长,经过ORF search预测其开放阅读框长度为1163bp。经过对EsMIXTA基因所编码蛋白进行Blastp的比对后发现,EsMIXTA蛋白和唐松草Thalictrum thalictroide MIXTA基因MYBML2蛋白具有最大的相似度。通过对EsMIXTA蛋白与已有的MIXTA蛋白进行比对后发现EsMIXTA蛋白具有典型的R2 R3-MYB蛋白的结构域,即N端含有典型的结构域R2结构域和R3结构域,并拥有subgroup9的专属结构域(图1)。在对MIXTA基因通过核苷酸序列进行系统发育树重建后发现,EsMIXTA基因与唐松草中的MIXTA基因亲缘关系较近(表1,图2),由于唐松草属和淫羊藿属都隶属于毛茛目,所以其基因的亲缘关系较近符合进化生物学观点。
3.2 EsMIXTA基因在不同组织中的表达分析
实时定量PCR的结果显示EsMIXTA基因在箭叶淫羊藿的根、叶及其花器官中均有一定的表达,其中根中EsMIXTA基因的相对表达最高,其次是叶片,相比根部和叶片,在花器官中该基因的表达明显低(图3)。

图1 箭叶淫羊藿MIXTA基因编码蛋白氨基酸与其他植物同源基因比对
表1 MIXTA类基因系统发育树数据
通过对箭叶淫羊藿的花瓣状萼片和花瓣的上下轴面进行观察,我们可以观察到花萼片的上轴面具有明显的凸起(图4a),而花瓣的上轴面凸起并不明显(图4b)。从下轴面来看,花萼片的下轴面呈现出不规则的条纹状突起(图4c),而花瓣的下轴面则与上轴面形态类似即矩形微突起(图4d)。

图2 通过ML(最大似然)算法对MIXTA类基因进行系统发育树重建
4 讨论
在本项研究中,我们通过反向遗传学的手段在中药箭叶淫羊藿中克隆得到了一个MYB基因,通过蛋白序列比对发现,它含有保守氨基酸序列R2和R3两个区域。同时该基因所编码的蛋白质拥有特殊性的subgroup9类MYB特有的保守氨基酸基序,从而可以认定该基因属于subgroup9类型的R2R3 MYB基因。从植物分子系统学角度看箭叶淫羊藿中的MIXTA基因和唐松草MIXTA基因聚成一支,它们都是basal core eudicot(基部真双子叶类型)物种,所以从进化角度上讲,EsMIXTA基因为TtMIXTA基因的直系同源基因。。
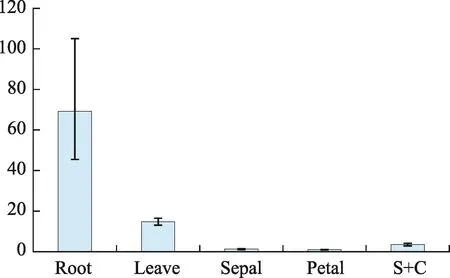
图3 EsMIXTA基因在不同器官中的表达模式

图4 箭叶淫羊藿萼片和花瓣上下轴面微形态。
从形态学角度来观察,箭叶淫羊藿的萼片上表面表现出不规则的突起状态,这一形态特征明显大于花瓣上表面的细胞形态。由于箭叶淫羊藿的萼片呈现出大、且花瓣状的形态,而花瓣则呈现出囊状的形态。这一类淫羊藿明显不同于像巫山淫羊藿等长距类型,我们认为箭叶淫羊藿中的萼片可能起到了招引传粉者的关键作用,当然这个假设需要得到繁殖生物学的证据。从我们的表达数据中可以发现EsMIXTA基因在箭叶淫羊藿的各个器官中都有所表达,这一结果和之前报道过的金鱼草[6]、矮牵牛[7]和唐松草[12]的结果类似,这表明EsMIXTA基因很有可能调控着细胞突起这一形态特点,使得箭叶淫羊藿的萼片呈现出花瓣状的形态。同时我们发现EsMIXTA基因在根中的表达量高,这可能和根毛形成有着密切的联系。深入的研究需要通过本物种的转基因试验或者异源表达去验证EsMIXTA基因在箭叶淫羊藿中的功能。
