美洲大蠊提取液对大鼠难愈合创面TGF-β1/Smads通路调控机制的研究*
2019-07-05曾娟妮耿越飞沈咏梅何永恒
曾娟妮,刘 筱,耿越飞,沈咏梅,何永恒**
(1.湖南中医药大学第二附属医院 长沙 410000;2.湖南中医药大学 长沙 410208;3.成都高新好医生第一医院 成都 610202)
有研究表明[1-3],Smads通路(Smads route)是TGF-β 1调节成纤维细胞合成ECM及凋亡的细胞内主要信号转导通路,是新近发现的TGF-β受体复合物下游一类非常重要的信号传导分子家族。Smad3介导的信号途径在体内抑制创伤愈合;Smad7[4]蛋白属于抑制型Smad家族成员,能降低TGF-β1的生物学效应,减少成纤维细胞的增殖,减少瘢痕形成。相关研究表明组织创伤愈合与肉芽组织的形成有很大关联,新的肉芽组织对创口的闭合有很大促进作用[5]。笔者前期将美洲大蠊提取液外用于肛管难愈合创面,取得满意疗效[6]。通过PCR实验研究发现美洲大蠊提取液能提高难愈合创面中VEGF的表达而加速创面的修复[7]。免疫组化实验研究表明美洲大蠊提取液能提高大鼠难愈合创面中TGF-β的表达,从而促进创面愈合[8]。但美洲大蠊提取液促进创面愈合的机制仍不清楚。本实验旨在观察创面肉芽组织中TGF-β1和Smad3、Smad7及其磷酸化的表达,从分子水平探讨该药促进创面愈合的作用及机制。
1 材料与方法
1.1 实验动物
SPF级Wistar大鼠(SPF Wistar Rat)60只,雄性,2月龄,体质量200-250 g,由湖南景莱克景达实验动物有限公司提供(动物许可证号:SCXK(湘)2013-0005,动物合格证编号NO.43004700015135)。
1.2 药品与试剂
贝复济15 mL·瓶-1(珠海亿胜生物制药有限公司,国药准字S10980075);美洲大蠊提取液100 mL·瓶-1(商品名:康复新液,四川好医生攀西药业有限责任公司,国药准字Z51021834)。RIPA蛋白裂解液、Bradford蛋白浓度测定试剂盒、超敏化学放光显色试剂盒(江苏碧云天);彩色预染蛋白marker(Fermentas);5X SDSPAGE loading buffer、羊抗鼠二抗、羊抗兔二抗(vazyme)。
1.3 实验仪器
电泳仪、垂直板电泳槽、水平电转槽、水平摇床(北京六一仪器厂);恒温摇床金坛);超纯水仪(millipore公司);紫外可见分光光度计(上海spectrum公司);台式高速冷冻离心机(Thermo);压片夹(koda);扫描仪(日本Canon)。
1.4 方法
1.4.1 造模与分组
将60只雄性Wistar大鼠采用随机数字表法分为急性全层皮肤缺损组(空白组)、模型组、贝复济对照组(对照组)、美洲大蠊提取液实验组(实验组),每组15只。采用全层皮肤缺损+激素法制成大鼠慢性难愈合创面模型[9],用20%乌拉坦(5 mL·kg-1)腹腔注射麻醉大鼠后,在其背中部脊柱两侧旁开1 cm,距肩胛骨以下2 cm用外科方法作两条深达筋膜、直径为18 mm的全层皮肤缺损开放性创面;模型组、对照组、实验组造模后即刻皮下注射醋酸氢化可的松(6 mg·100 g-1)。
1.4.2 换药及取材
空白组与模型组外敷层0.9%氯化钠溶液(0.2 mL·cm-2)纱布;对照组用贝复济(60 μ·cm-2)浸透的单层纱布外敷于创面;实验组以美洲大蠊提取液(0.2 mL·cm-2)浸透后的单层纱布外敷于创面。然后在创面上加盖两层消毒干纱布,用胶布“丰”字形固定,每日定时换药2次。各组在药物干预3天、8天、15天、20天后随机取3只大鼠造模区深达真皮全层的创面组织备试管固定液中待用,所有大鼠在20 d取材后统一处死。
1.4.3 免疫组化测定
将固定的肉芽组织标本进行脱水,再浸蜡,然后包埋,最后切片。取4 μm石蜡切片,进行脱蜡脱水后,用PBS洗涤,每次3 min,共3次;然后3%H2O2:室温下20 min,PBS洗涤,每次3 min,共3次;再将切片浸入0.01 mol·L-1pH 6.0柠檬酸盐缓冲液,微波炉(98℃)进行抗原修复2次,每次10 min,然后取出在室温下自然冷却后滴加一抗,放4℃冰箱过夜;PBS洗涤3次,每次3 min,滴加Envision试剂,在37℃下30 min,PBS洗涤3次,每次3 min,用0.04%DAB+0.03%H2O2显色8 min后用苏木素衬染、盐酸乙醇蓝化2 s进行流水洗,最后微波蓝化后用树脂封片。检测目标以胞浆出现棕黄色或棕褐色颗粒者判定为阳性细胞,以PBS缓冲液代替一抗作为阴性对照。
1.4.4 Western blot检测(Western Blot Test)
将所取组织块置于1-2 mL匀浆器中球状部位,用干净的剪刀将组织块尽量剪碎,加400 μL单去污剂裂解液裂(含PMSF)于匀浆器中,进行匀浆,然后置于冰上,30 min后用移液器将裂解液移至1.5 mL离心管中,然后在4℃下12000 rpm离心5 min,取上清分装于0.5 mL离心管中并置于-20℃保存,考马亮蓝染色测定样品浓度并调整各上样量至50 μg,加入2×加样缓冲液,煮沸3 min后取上样。在制备好的8%的SDS、PAGE凝胶上行垂直电泳分离。NC膜电转移转印迹。以含5%脱脂奶粉rIBS—T溶液(10 mmol/1。'l'ris-CI,100 retool/L NaCl+0.1%Tween 20)封闭,而后分别加入羊抗大鼠Smad3和Smad7多克隆抗体(1∶500稀释),再以辣根过氧化物酶(HRPO)偶联兔抗羊lgG抗体(I∶1 000稀释)孵育,以上步骤间用TBS—T常温下充分洗膜。最后用ECL系统感光显像。
1.4.5 统计学方法
使用SPSS23.0统计软件,数据以x±s表示,满足方差齐性检验,采用单因素方差分析,多重比较采用LSD法,若方差不齐,采用秩和检验。
2 结果
2.1 免疫组化结果
2.1.1 TGF-β1结果
空白组、实验组3-8天逐渐上升,8-20天逐渐下降,8天表达最高;模型组、对照组3-20 d无明显规律性。3天,空白组较模型组(P=0<0.01)、对照组(P=0.018<0.05)表达高,与实验组无差异(P=0.076>0.05),8天、15天、20天,高于模型组(P=0.011< 0.05,P=0.037<0.05,P=0.005<0.05),与对照组(P=0.206 > 0.05,P=0.361> 0.05,P=0.511 > 0.05)、实验组无差异(P=0.597>0.05,P=0.409>0.05,P=0.280 > 0.05);3 d、8 d、15 d、20 d,实验组较模型组(P=0.006< 0.01,P=0.005< 0.01,P=0.010< 0.05,P=0.001<0.01)表达高,与对照组无差异(P=0.376>0.05,P=0.090 > 0.05,P=0.103 > 0.05,P=0.102 >0.05)(表1,图1)。
表1 TGF-β1表达水平(平均比值TGF-β1/actin,
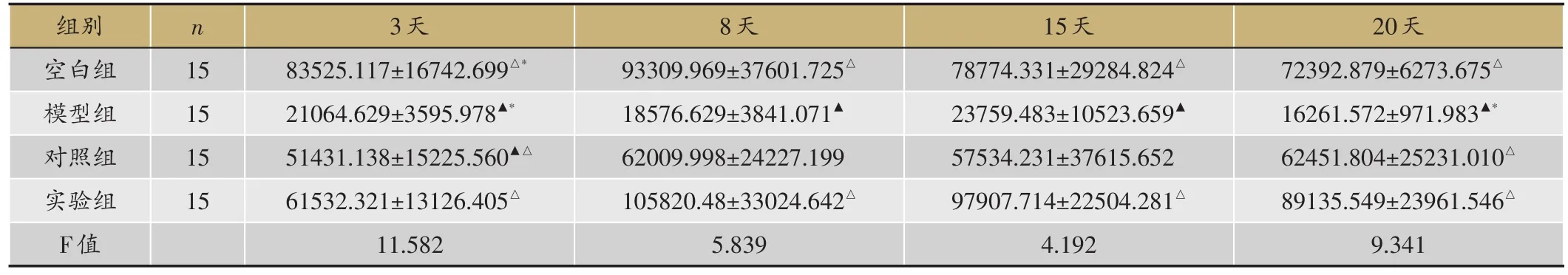
表1 TGF-β1表达水平(平均比值TGF-β1/actin,
▲:P < 0.05,与空白组;△:P < 0.05,与模型组;*:P < 0.05,与对照组。
20天72392.879±6273.675△16261.572±971.983▲*62451.804±25231.010△89135.549±23961.546△9.341组别空白组模型组对照组实验组F值n 15 15 15 15 3天83525.117±16742.699△*21064.629±3595.978▲*51431.138±15225.560▲△61532.321±13126.405△11.582 8天93309.969±37601.725△18576.629±3841.071▲62009.998±24227.199 105820.48±33024.642△5.839 15天78774.331±29284.824△23759.483±10523.659▲57534.231±37615.652 97907.714±22504.281△4.192
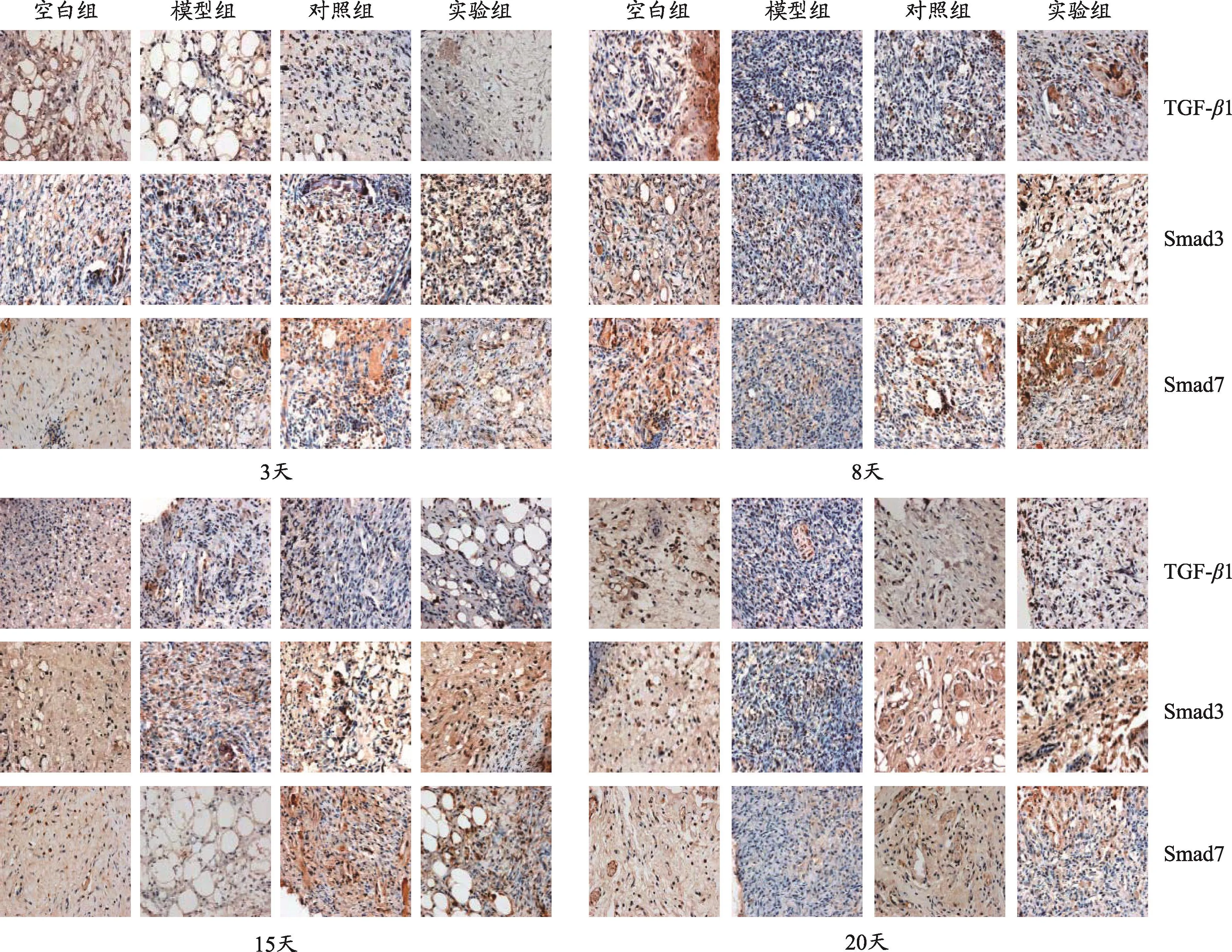
图1 4组TGF-β1、Smad3、Smad7免疫组化图
2.1.2 Smad3结果
空白组、模型组3-20天逐渐上升,对照组、实验组逐渐下降。3天、8天,空白组与模型组(P=0.090>0.05,P=0.124> 0.05)、对照组(P=0.127> 0.05,P=0.936>0.05)、实验组(P=0.131>0.05,P=0.470>0.05)比较均无差异,15天、20天,较模型组(P=0.016<0.05,P=0.000<0.05)表达低,与对照组(P=0.573>0.05,P=0.394>0.05)、实验组无差异(P=0.807>0.05,P=0.131>0.05)。3天,实验组与模型组(P=0.810>0.05)、对照组(P=0.985>0.05)无差异,8天、15天,较模型组(P=0.038<0.05,P=0.024<0.05)表达低,与对照组(P=0.425> 0.05,P=0.747>0.05)无差异,20天,较模型组(P=0.000< 0.05)、对照组(P=0.032<0.05)均表达低(表2,图1)。
2.1.3 Smad7结果
空白组、对照组、实验组3-20d逐渐下降,模型组逐渐上升。3天、8天、15天、20天,空白组较模型组(P=0.006< 0.05,P=0.003< 0.05,P=0.000< 0.05,P=0.034<0.05)表达低,与对照组(P=0.384>0.05,P=0.883 > 0.05,P=0.230 > 0.05,P=0.939 > 0.05)、实验组(P=0.351>0.05,P=0.819>0.05,P=0.134>0.05,P=0.906>0.05)无差异,实验组均显著低于模型组(P=0.001< 0.05,P=0.002< 0.05,P=0.000<0.05,P=0.028<0.05),与对照组(P=0.947>0.05,P=0.934> 0.05,P=0.722> 0.05,P=0.845> 0.05)无差异(表3,图1)。
表2 Smad3表达情况(平均值Smad3/actin,
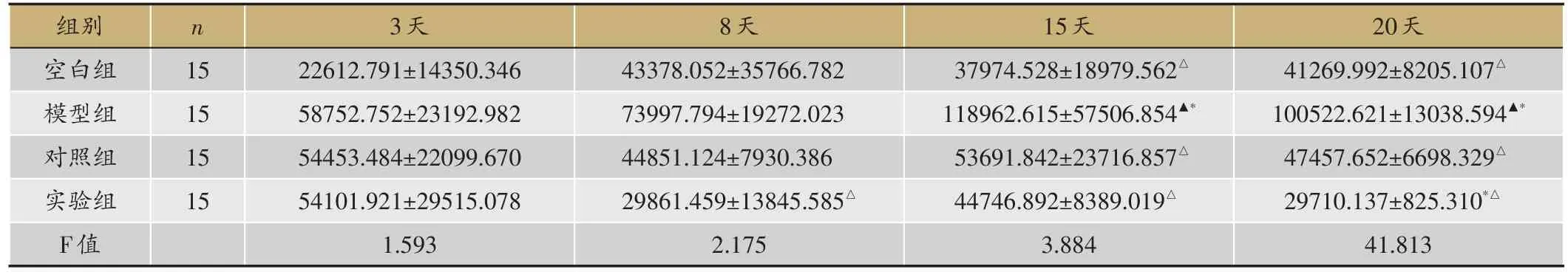
表2 Smad3表达情况(平均值Smad3/actin,
▲:P < 0.05,与空白组;△:P < 0.05,与模型组;*:P < 0.05,与对照组。
20天41269.992±8205.107△100522.621±13038.594▲*47457.652±6698.329△29710.137±825.310*△41.813组别空白组模型组对照组实验组F值n 15 15 15 15 3天22612.791±14350.346 58752.752±23192.982 54453.484±22099.670 54101.921±29515.078 1.593 8天43378.052±35766.782 73997.794±19272.023 44851.124±7930.386 29861.459±13845.585△2.175 15天37974.528±18979.562△118962.615±57506.854▲*53691.842±23716.857△44746.892±8389.019△3.884
表3 Smad7表达情况(平均值Smad7/actin,
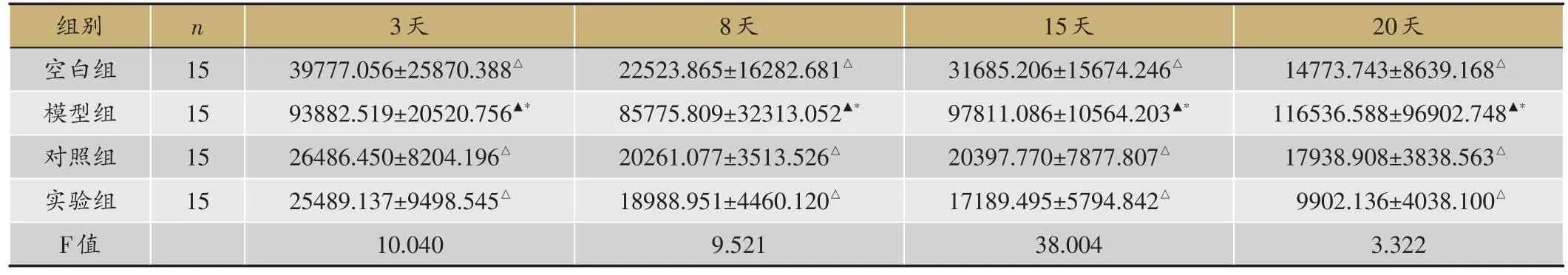
表3 Smad7表达情况(平均值Smad7/actin,
▲:P < 0.05,与空白组;△:P < 0.05,与模型组;*:P < 0.05,与对照组。
20天14773.743±8639.168△116536.588±96902.748▲*17938.908±3838.563△9902.136±4038.100△3.322组别空白组模型组对照组实验组F值n 15 15 15 15 3天39777.056±25870.388△93882.519±20520.756▲*26486.450±8204.196△25489.137±9498.545△10.040 8天22523.865±16282.681△85775.809±32313.052▲*20261.077±3513.526△18988.951±4460.120△9.521 15天31685.206±15674.246△97811.086±10564.203▲*20397.770±7877.807△17189.495±5794.842△38.004
表4 TGF-β1表达水平(平均比值TGF-β1/actin,x
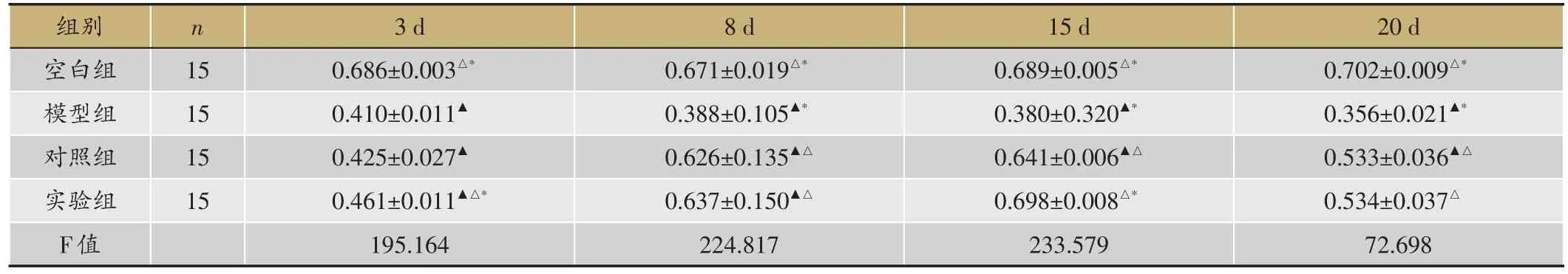
表4 TGF-β1表达水平(平均比值TGF-β1/actin,x
▲:P < 0.05,与空白组;△:P < 0.05,与模型组;*:P < 0.05,与对照组。
20 d 0.702±0.009△*0.356±0.021▲*0.533±0.036▲△0.534±0.037△72.698组别空白组模型组对照组实验组F值n 15 15 15 15 3 d 0.686±0.003△*0.410±0.011▲0.425±0.027▲0.461±0.011▲△*195.164 8 d 0.671±0.019△*0.388±0.105▲*0.626±0.135▲△0.637±0.150▲△224.817 15 d 0.689±0.005△*0.380±0.320▲*0.641±0.006▲△0.698±0.008△*233.579
2.2 Western blot结果
2.2.1 TGF-β1结果
TGF-β1表达水平比较,空白组3-20天逐渐上升,模型组逐渐下降,对照组与实验组3-15天逐渐上升,15-20天逐渐下降;空白组3天、8天、15天、20天较其他三组表达高(P<0.05);实验组3天、15天,较模型组(P=0.005<0.05,P=0.000<0.05)、对照组(P=0.027< 0.05,P=0.003< 0.05)表达高,8天、20天,较模型组(P=0<0.01,P=0<0.01)表达水平高,与对照组无差异(P=0.409> 0.05,P=0.967> 0.05)(表4,图2,图3)。
2.2.2 Smad3结果
Smad3的表达水平比较,3-20天均逐渐升高。空白组3天、15天,与模型组(P=0.095>0.05,P=0.060>0.05)、对照组(P=0.102>0.05,P=0.171>0.05)、实验组(P=0.818>0.05,P=0.773>0.05)无差异,8天,较模型组(P=0.011<0.05)、对照组(P=0.024<0.05)表达低,与实验组无差异(P=0.305>0.05),20天,较模型组(P=0.043< 0.05)表达低,与对照组(P=0.075>0.05)、实验组(P=0.499>0.05)无差异;实验组3天、8天、15天、20天,与模型组(P=0.137 > 0.05,P=0.059 > 0.05,P=0.096 > 0.05,P=0.129>0.05)、对照组(P=0.147>0.05,P=0.131>0.05,P=0.262> 0.05,P=0.217> 0.05)均无统计学意义(表5,图2,图3)。
表5 Smad3表达水平(平均值Smad3/actin,x)
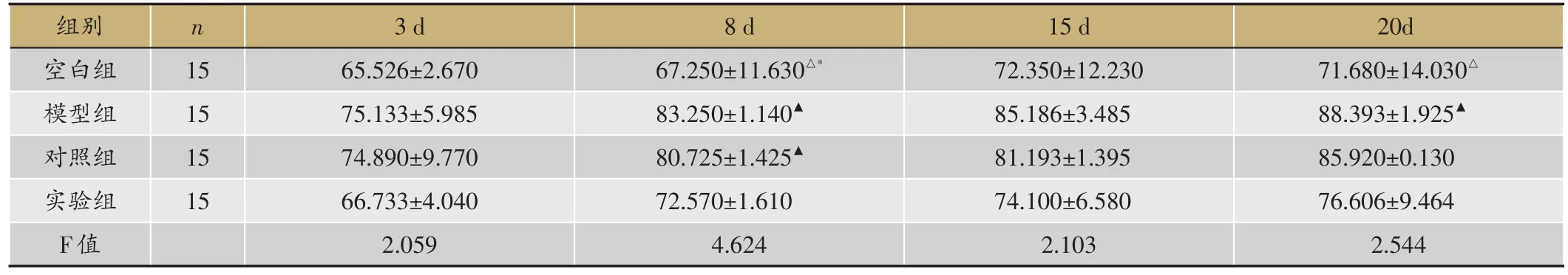
表5 Smad3表达水平(平均值Smad3/actin,x)
▲:P < 0.05,与空白组;△:P < 0.05,与模型组;*:P < 0.05,与对照组。
20d 71.680±14.030△88.393±1.925▲85.920±0.130 76.606±9.464 2.544组别空白组模型组对照组实验组F值n 15 15 15 15 3 d 65.526±2.670 75.133±5.985 74.890±9.770 66.733±4.040 2.059 8 d 67.250±11.630△*83.250±1.140▲80.725±1.425▲72.570±1.610 4.624 15 d 72.350±12.230 85.186±3.485 81.193±1.395 74.100±6.580 2.103
表6 Smad7表达水平(平均值Smad7/actin,
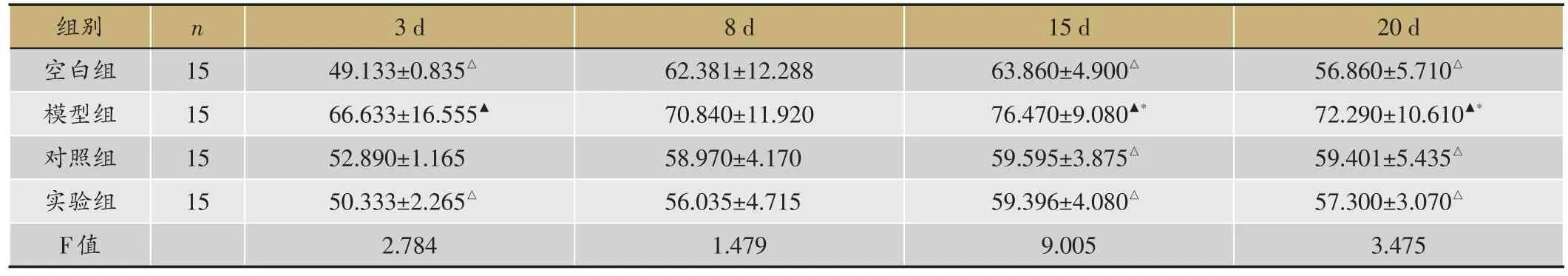
表6 Smad7表达水平(平均值Smad7/actin,
▲:P < 0.05,与空白组;△:P < 0.05,与模型组;*:P < 0.05,与对照组。
20 d 56.860±5.710△72.290±10.610▲*59.401±5.435△57.300±3.070△3.475组别空白组模型组对照组实验组F值n 15 15 15 15 3 d 49.133±0.835△66.633±16.555▲52.890±1.165 50.333±2.265△2.784 8 d 62.381±12.288 70.840±11.920 58.970±4.170 56.035±4.715 1.479 15 d 63.860±4.900△76.470±9.080▲*59.595±3.875△59.396±4.080△9.005
2.2.3 Smad7结果
Smad7的表达水平比较,3-15天逐渐上升,15-20天逐渐降低。空白组3天、15天、20天,较模型组(P=0.034 < 0.05,P=0.002 < 0.05,P=0.024 < 0.05)表达低,与对照组(P=0.598>0.05,P=0.584>0.05,P=0.659>0.05)、实验组(P=0.865>0.05,P=0.282>0.05,P=0.939> 0.05)无差异,8天,比模型组(P=0.289<0.05)、对照组(P=0.659<0.05)表达低,与实验组无差异(P=0.419>0.05);3天、8天,实验组与模型组(P=0.044>0.05,P=0.082>0.05)、对照组(P=0.719> 0.05,P=0.704> 0.05)比较无差异,15天、20天,比模型组(P=0.007<0.05,P=0.027<0.05)表达低,与对照组(P=0.575>0.05,P=0.714>0.05)无差异(表6,图2,图3)。
2.2.4 psmad3结果
psmad3表达水平比较,空白组3-15天逐渐降低,模型组逐渐升高,对照组、实验组3-8天逐渐升高,8-20天逐渐降低。空白组3天、15天、20天,较模型组(P=0.005 < 0.05,P=0.000 < 0.05,P=0.000 < 0.05)表达低,与对照组(P=0.145>0.05,P=0.478>0.05,P=0.355>0.05)、实验组(P=0.391>0.05,P=0.498> 0.05,P=0.950>0.05)无差异,8天,与模型组(P=0.098>0.05)、对照组(P=0.458>0.05)、实验组均无差异(P=0.231> 0.05);实验组3天、15天、20天,较模型组(P=0.001<0.05,P=0.000<0.05,P=0.000<0.05)表达低,与对照组(P=0.500>0.05,P=0.184>0.05,P=0.325>0.05)无差异,8天,与模型组(P=0.583>0.05)、对照组(P=0.618>0.05)均无差异(表7,图2,图3)。
表7 psmad3表达水平(平均比值psmad3/actin,
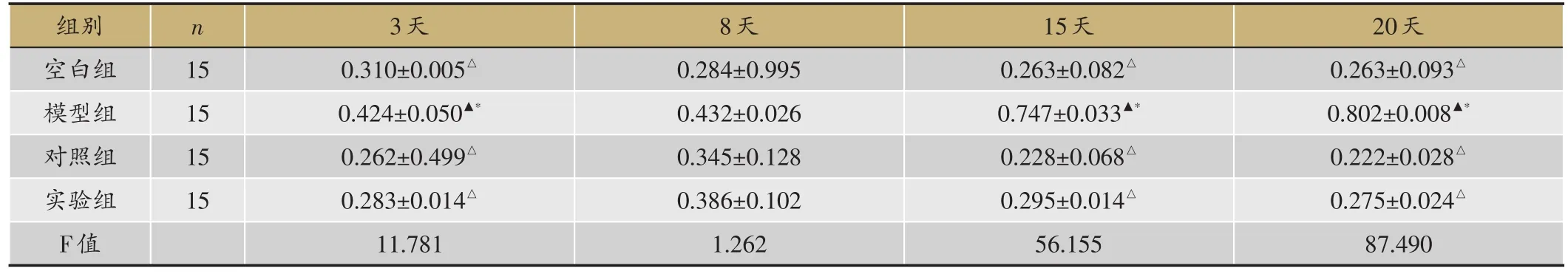
表7 psmad3表达水平(平均比值psmad3/actin,
▲:P < 0.05,与空白组;△:P < 0.05,与模型组;*:P < 0.05,与对照组。
20天0.263±0.093△0.802±0.008▲*0.222±0.028△0.275±0.024△87.490组别空白组模型组对照组实验组F值n 15 15 15 15 3天0.310±0.005△0.424±0.050▲*0.262±0.499△0.283±0.014△11.781 8天0.284±0.995 0.432±0.026 0.345±0.128 0.386±0.102 1.262 15天0.263±0.082△0.747±0.033▲*0.228±0.068△0.295±0.014△56.155
2.2.5 psmad7结果
psmad7表达水平比较,空白组3-8天逐渐降低,8-20天逐渐升高,模型组3-20天逐渐升高,对照组、实验组3-20天逐渐降低。空白组3天、8天、20天,较模型组(P=0.007<0.05,P=0.009<0.05,P=0.000<0.05)表达低,与对照组(P=0.062>0.05,P=0.070>0.05,P=0.246> 0.05)、实验组(P=0.186> 0.05,P=0.077> 0.05,P=0.141>0.05)无差异,15天,比模型组(P=0.000<0.05)、对照组(P=0.003<0.05)、实验组(P=0.004<0.05)表达低;3天、8天,实验组与模型组(P=0.066>0.05,P=0.200>0.05)、对照组(P=0.493>0.05,P=0.955>0.05)比较无差异,15天、20天,较模型组(P=0.000<0.05,P=0.000<0.05)表达低,与对照组(P=0.915>0.05,P=0.711>0.05)无差异(表8,图2,图3)。
3 讨论
难愈合创面是指创面在各种内外因素作用下不能通过正常的愈合进程达到解剖和功能上的完整,从而进入一种病理性炎症反应状态,最终导致经久难愈[10]。
现代药理研究证明美洲大蠊提取液能促进肉芽组织生长,促进血管增生,加速坏死组织脱落,迅速修复各类溃疡及创伤创面;抗感染、消除炎性水肿,提高机体免疫功能;外用可快速激活局部免疫细胞,缩短创面愈合时间[11,12]。贝复济是一种碱性成纤维化细胞生长因子[13],其在血管生成的过程中有很大作用。
表8 psmad7表达水平(平均比值psmad7/actin
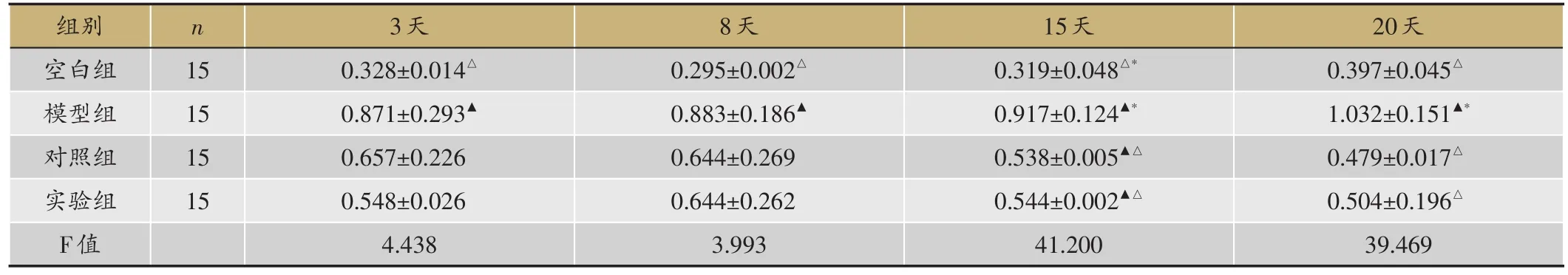
表8 psmad7表达水平(平均比值psmad7/actin
▲:P < 0.05,与空白组;△:P < 0.05,与模型组;*:P < 0.05,与对照组。
20天0.397±0.045△1.032±0.151▲*0.479±0.017△0.504±0.196△39.469组别空白组模型组对照组实验组F值n 15 15 15 15 3天0.328±0.014△0.871±0.293▲0.657±0.226 0.548±0.026 4.438 8天0.295±0.002△0.883±0.186▲0.644±0.269 0.644±0.262 3.993 15天0.319±0.048△*0.917±0.124▲*0.538±0.005▲△0.544±0.002▲△41.200
创伤后TGF-β参与了皮肤愈合的炎症期、肉芽组织形成期和瘢痕形成期全过程。TGF-β对单核细胞、中性粒细胞具有很强的趣化作用,引起炎症细胞的局部募集,分泌细胞生长因子等促进创面愈合;TGF-β还能趋化并作用于成纤维细胞,刺激多种基质蛋白如纤维粘连蛋白和胶原基因的转录。并可通过调节蛋白酶的表达抑制基质降解;刺激成纤维细胞转化为肌成纤维细胞,促进创口收缩。Smad是转化生长因子β(TGF-β)胞内信号转导通路中的重要组成部分,它可以将TGF-β信号直接由细胞膜通过TβRⅠ、TβRⅡ受体结合形成的复合物,使其自身被磷酸化,并通过诱导结合形成的复合物转运至细胞核内。当细胞受到TGF-β刺激时,Smads与β-微管蛋白分离,Smad2或Smad3就会与SARA蛋白结合,被呈递给TGF-β受体复合物而被活化[14,15]。内源性的Smad7表达受TGF-β诱导,也可由作用于内皮细胞的液体剪切力诱导表达[16]。苏丽婷等[17]研究发现Smad7蛋白有抑制TGF-β信号转导的作用,Smad7属于抑制型Smad,可以通过干扰Smad磷酸化[18],影响TGF-β超家族信号通路的传导。
本研究结果显示,两种实验方法均表现为空白组创面愈合速度最快,模型组愈合缓慢,表明慢性难愈合创面的愈合速度明显低于一般的创面。免疫组化发现实验组与模型组TGF-β1、Smad7的表达比较有统计学意义(P<0.05),Smad3的表达结果显示实验组与模型组比较,3天无明显差异(P >0.05),8天、15天、20天有统计学意义(P<0.05)。Western blot实验显示TGF-β 1、Smad7、psmad3的表达,实验组与模型组比较有统计学意义(P<0.05);各组间Smad3的表达比较均无统计学意义(P>0.05),psmad7的表达结果显示,实验组与模型组比较,3-8天无统计学意义(P>0.05),15-20天有统计学意义(P<0.05)。美洲大蠊提取液能通过降低Smad7的表达,减少Smad7的自身磷酸化来提高TGF-β1的表达,从而促进创面愈合;Smad3结果显示3-20天均逐渐上升,各组间比较均无统计学意义(P>0.05),psmad3的表达结果发现空白组3-15天逐渐降低,模型组逐渐升高,对照组、实验组3-8天逐渐升高,8-20天逐渐降低,实验组与模型组比较有统计学意义(P<0.05),表明美洲大蠊提取液下调Smad3的现象不显著,但能引起Smad3的磷酸化。
综上所述,本次研究结果提示美洲大蠊提取液下调Smad3的现象不显著,而能有效降低Smad7的表达,减少Smad7的自身磷酸化,从而减弱Smad7对TGF-β1信号转导的抑制,提高TGF-β1的表达而促进创面愈合。进一步证实了运用美洲大蠊提取液后,慢性难愈合创面与一般创面的愈合速度差异不明显,为中医外治法提供了新的方法和思路。
