百合地黄汤对失眠模型大鼠行为学及不同脑区单胺类神经递质的影响*
2019-07-05郑竹宏赵仁云丁玉婷孙玉杰李剑豪杨雨薇孙毅坤
郑竹宏,赵仁云,丁玉婷,张 娜,孙玉杰,李剑豪,杨雨薇,孙毅坤
(北京中医药大学中药学院 北京 102488)
失眠是一种最常见的睡眠障碍性疾病,已经成为十分普遍的现象[1]。失眠对人们的生活造成了严重困扰,也会诱导抑郁症、高血压和糖尿病等疾病的发生,严重者将导致死亡[2]。目前,用于治疗失眠的药物主要包括苯二氮卓类、非苯二氮卓类药物、抗抑郁药、抗组胺药等,但具有反弹性失眠、成瘾、戒断等严重的副作用[3]。
百合地黄汤始载于《金匮要略》,由百合7枚和生地黄汁1升组成。原书云:“百合病者,百脉一宗,悉致其病也。意欲食复不能食,常默然。欲卧不能卧,
欲行不能行,饮食或有美时,或有不用闻食臭时,如寒无寒,如热无热,口苦,小便赤,诸药不能治,得药则剧吐利,如有神灵者,身形如和,其脉微数”[4]。
百合病与现代医学上的失眠比较相似。临床上用百合地黄汤或其加减方治疗失眠也取得了很好的疗效[5-8]。但百合地黄汤治疗失眠的作用机制研究较少,笔者通过研究百合地黄汤对失眠模型大鼠行为学、睡眠以及不同脑区中单胺类神经递质的影响,探讨其治疗失眠的作用机制。
1 材料与方法
1.1 实验动物
SD雄性大鼠(200±20 g),购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)-2011-0004。大鼠饲养于SPF级环境中,温度和湿度保持恒定,光照12 h黑白循环,自由进食、饮水。
1.2 药物与试剂
百合(产地江苏,批号:160926003)、生地黄(产地河南,批号:160503005)均购于北京康源祥瑞医药科技有限公司,多巴胺(DA,批号:100070-201507)购于中国食品药品检定研究院,5-羟色胺(5-HT,批号:BO1022DA14)、对氯苯丙氨酸(PCPA,批号:S42561)均购于上海源叶生物科技有限公司,地西泮(批号:国药准字H11020898)购于北京益民药业有限公司,戊巴比妥钠(批号WS20060401)购于国药集团化学试剂有限公司。百合、地黄2:1,用12倍量50%乙醇溶液浸泡60min,回流提取90 min,提取2次,合并滤液,干燥,浸膏用水复溶,分别配制成含生药量为4 g·mL-1和1 g·mL-1的百合地黄汤溶液,备用。
1.3 实验仪器
WT型电子天平(杭州万特衡器有限公司),万分之一天平(赛多利斯科学仪器(北京)有限公司),GTR10-2型高速冷冻离心机(北京时代北利离心机有限公司),DW-HL538型-86℃冰箱(中科美菱),匀浆机(北京市科学器材公司),Alliance 2695高效液相色谱仪,ECD 2465电化学检测器。
1.4 造模与分组
SD雄性大鼠适应性喂养7天后,于每天早晨8:00腹腔注射PCPA混悬液(0.4 g·kg-1),连续2天。动物出现昼夜节律消失,白天也活动不停,表明模型复制成功。取造模成功大鼠32只,随机分成模型组、地西泮组和百合地黄汤高、低剂量组,另取未造模大鼠8只作为正常对照组。
1.5 给药方法
参考相关文献[9,10],并通过预实验确定百合地黄汤高、低剂量组大鼠分别灌胃给予28 g·kg-1、7g·kg-1百合地黄汤溶液;地西泮组大鼠灌胃给予0.92 mg·kg-1地西泮溶液[11-13];空白组与模型组大鼠分别给予等量生理盐水,连续给药7天。
1.6 观察指标
1.6.1 旷场实验
于第6天给药30 min后,大鼠在木箱中适应1 min,记录各组大鼠3 min内横跨格子数、站立次数、中央格停留时间、修饰次数以及粪便数。两次实验之间,清洗场箱内壁及底面。
1.6.2 翻正反射实验
于末次给药30 min后,各组大鼠均腹腔注射戊巴比妥钠(40 mg·kg-1)。观察并记录大鼠睡眠潜伏期及睡眠持续时间,翻正反射消失为发生睡眠,翻正反射恢复为觉醒。
1.6.3 单胺类神经递质含量
(1)样本采集
于末次给药24 h后,各组大鼠断头处死,冰浴上快速取出脑组织,迅速分离大鼠脑干、皮层和海马组织,置-80℃冰箱中保存,备用。
(2)蛋白沉淀剂的制备
取乙二胺四乙酸二钠0.0113 g、亚硫酸钠0.0062 g,高氯酸858µL,置于100 mL量瓶中,稀释至刻度,即得蛋白沉淀剂。4℃、避光保存,备用。
(3)大鼠脑干、皮层和海马匀浆样本制备
精密称取大鼠脑干、皮层、海马样品0.1g,置于2mL离心管中,加入3倍量蛋白沉淀剂,冰浴条件下匀浆,静置30 min,4℃、12000 r·min-1离心15 min,取上清,即得。
(4)对照品储备液的配制
精密称取DA和5-HT对照品各5 mg,分别置于5 mL量瓶中,用蛋白沉淀剂稀释至刻度,摇匀,制得浓度为1 mg·mL-1的对照品储备液。临用前用蛋白沉淀剂稀释,配制成DA浓度分别为0.03、0.06、0.12、0.18、0.24、0.48、0.96 μg·mL-1,5-HT浓度分别为0.025、0.05、0.10、0.15、0.20、0.40、0.80 μg·mL-1的系列混合对照品溶液。
(5)色谱条件
色谱柱为Atlantis C18色谱柱(2.1×150 mm,3 μm),流动相为甲醇和缓冲盐溶液,其中缓冲盐包括50 mmol·L-1柠檬酸-乙酸钠,pH 3.5,内含1 mmol·L-1B8离子对试剂,1.8 mmol·L-1二正丁胺,0.3 mmol·L-1乙二胺四乙酸二钠。甲醇与缓冲盐的比例为4:96,检测电压为+0.75 V,柱温37 ℃,流速0.2 mL·min-1。
1.7 统计学分析
采用SPSS 17.0统计软件进行分析处理,各项指标结果采用±s表示,采用单因素方差分析,P<0.05为有统计学意义。
2 结果
2.1 对大鼠体质量的影响
于末次腹腔注射PCPA 24 h后,计算大鼠体质量增长值,与空白组相比,其余各组大鼠体质量显著降低(P<0.01),在一定程度上表明成功复制失眠模型。于末次给药24 h后,计算大鼠体质量增长值,与模型组相比,地西泮组和百合地黄汤高剂量组大鼠体质量明显升高(P < 0.05)(表1)。
2.2 对大鼠旷场行为评分的影响
与空白组相比,模型组大鼠得分明显降低(P<0.05),模型组大鼠的中央格停留时间、修饰次数和粪便颗粒明显升高(P<0.05),表明模型组大鼠比较紧张,在一定程度上反映成功复制失眠模型。与模型组相比,各治疗组大鼠得分有上升趋势,地西泮组和百合地黄汤高、低剂量组大鼠的中央格停留时间、修饰次数和粪便颗粒数明显降低(P<0.05),各给药组可以缓解大鼠的紧张程度,具有镇静催眠的作用(表2)。
2.3 对大鼠睡眠时间的影响
与空白组相比,模型组大鼠睡眠潜伏期明显延长(P<0.05),在一定程度上表明成功复制失眠模型。与模型组相比,地西泮组、百合地黄汤高、低剂量组大鼠睡眠潜伏期明显缩短(P<0.05),百合地黄汤高、低剂量组大鼠的睡眠持续时间明显延长(P<0.05),可直观反映给药组大鼠的睡眠有所改善(表3)。
2.4 方法学考察结果
2.4.1 专属性试验
取含0.3 mmol·L-1乙二胺四乙酸二钠,0.5 mmol·L-1亚硫酸钠的0.1mol·L-1高氯酸溶液,进样5μL,作为阴性对照。取浓度为1 μg·mL-1的混合对照品溶液,进样5 μL。取样品溶液,进样5 μL(图1)。
2.4.2 检测限和定量限试验
分别取浓度为1 μg·mL-1的DA和5-HT对照品溶液,用蛋白沉淀剂进行稀释,检测限S/N≥3,定量限S/N≥10。DA的检测限和定量限分别为0.025 ng、0.075 ng;5-HT的检测限和定量限分别为0.07 ng、0.1175 ng。
但省医院并不满足于此。在分管领导何斌副院长支持下,医院维保服务规范化招标采购继续融入信息化思维,全院采购一体化智能管控系统,即将全链条构建完成并上线使用。
2.4.3 线性关系考察
取不同浓度的混合对照品溶液,分别进样5 μL。以质量浓度(X)为横坐标、标准物质的峰面积(Y)为纵坐标进行回归分析。DA回归方程为
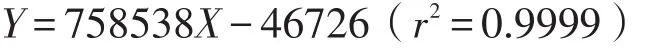
线性范围为0.15-4.8 ng;5-HT回归方程为
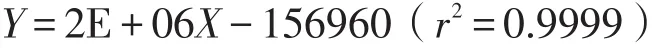
线性范围为0.125-4.00 ng。
2.4.4 稳定性试验
将对照品溶液和样品溶液在4℃条件下放置0 h、2 h、4 h、8 h、12 h、24 h测定,计算RSD%;对照品溶液的RSD%在1.12%-2.50%之间,样品溶液的RSD%在3.51%-5.47%之间,对照品溶液和样品溶液稳定性均良好。
2.4.5 精密度试验
分别配制高、中、低浓度的混合对照品溶液,重复进样6次,测定并计算RSD%,高、中、低浓度标准品溶液的日内精密度在0.26-0.98%之间,日间精密度在2.18-5.33%之间,日内精密度和日间精密度均良好。
表1 大鼠在造模后与给药后体的变化,n=8)
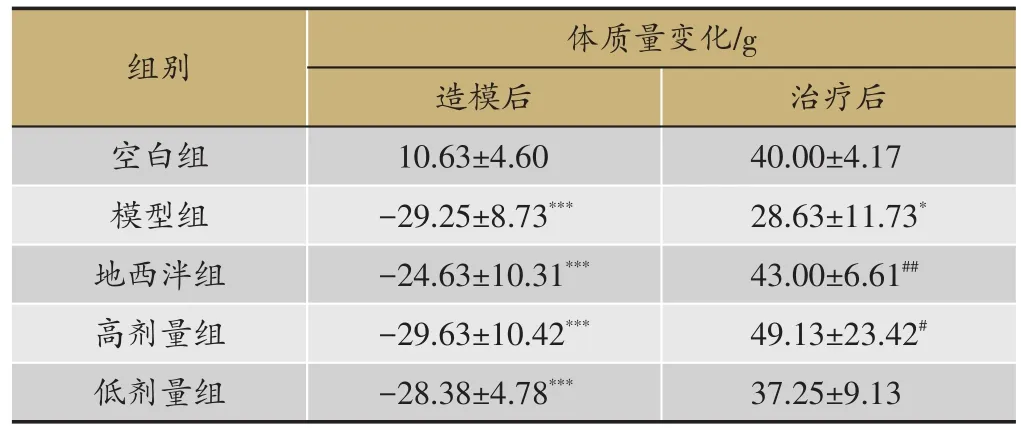
表1 大鼠在造模后与给药后体的变化,n=8)
注:与空白组比较,*P<0.05,***P<0.001;与模型组比较,#P<0.05,##P<0.01。
治疗后40.00±4.17 28.63±11.73*43.00±6.61##49.13±23.42#37.25±9.13组别空白组模型组地西泮组高剂量组低剂量组体质量变化/g造模后10.63±4.60-29.25±8.73***-24.63±10.31***-29.63±10.42***-28.38±4.78***
表2 旷场实验得分,n=8)
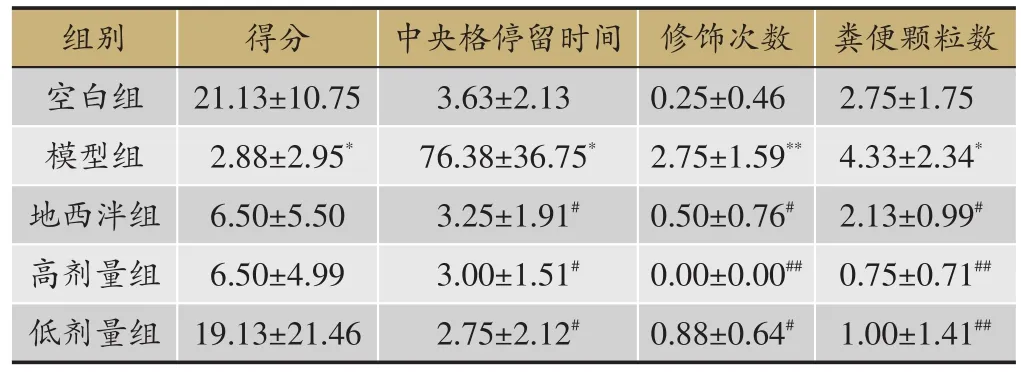
表2 旷场实验得分,n=8)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
粪便颗粒数2.75±1.75 4.33±2.34*2.13±0.99#0.75±0.71##1.00±1.41##组别空白组模型组地西泮组高剂量组低剂量组得分21.13±10.75 2.88±2.95*6.50±5.50 6.50±4.99 19.13±21.46中央格停留时间3.63±2.13 76.38±36.75*3.25±1.91#3.00±1.51#2.75±2.12#修饰次数0.25±0.46 2.75±1.59**0.50±0.76#0.00±0.00##0.88±0.64#
表3 地西泮与百合地黄汤对失眠大鼠睡眠的影响n=8)
表3 地西泮与百合地黄汤对失眠大鼠睡眠的影响n=8)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01,###P<0.001。
睡眠时间/min 52.25±6.69 65.75±19.47 65.75±12.76 113.71±23.78#94.25±24.92#组别空白组模型组地西泮组高剂量组低剂量组睡眠潜伏期/s 637.50±143.20 885.00±280.97*352.50±117.56###385.74±106.37##570.00±207.51#
图1 A:阴性对照 B:混合对照品 C:样品
表4 加样回收率结果
表5 各组大脑皮层中DA和5-HT的含量(s,n=8)
表5 各组大脑皮层中DA和5-HT的含量(s,n=8)
注:与空白组比较,***P<0.001;与模型组比较,##P<0.01,###P <0.001。
5-HT/(ng·g-1)172.10±20.26 87.86±15.76***124.95±22.77##90.66±11.70 140.74±19.82###组别空白组模型组地西泮组高剂量组低剂量组DA/(ng·g-1)427.59±112.26 904.66±260.20***930.05±148.78 166.37±80.61###78.65±25.17###
表6 各组大鼠脑干中DA和5-HT的含量(s,n=8)
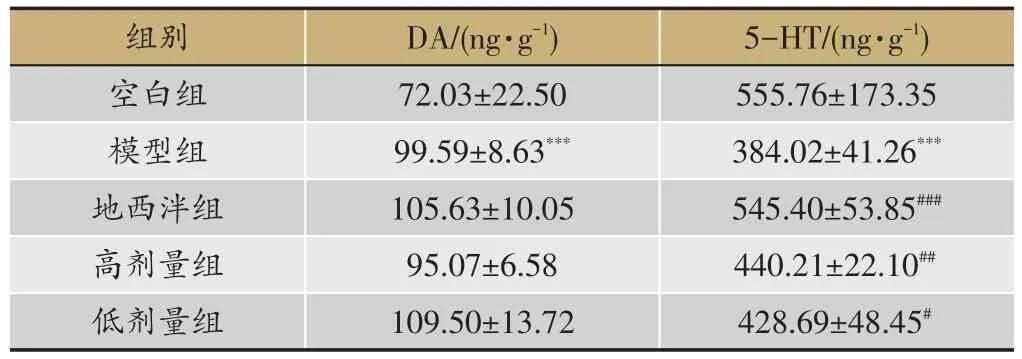
表6 各组大鼠脑干中DA和5-HT的含量(s,n=8)
注:与空白组比较,***P <0.001;与模型组比较,#P <0.05,##P <0.01,###P<0.001。
5-HT/(ng·g-1)555.76±173.35 384.02±41.26***545.40±53.85###440.21±22.10##428.69±48.45#组别空白组模型组地西泮组高剂量组低剂量组DA/(ng·g-1)72.03±22.50 99.59±8.63***105.63±10.05 95.07±6.58 109.50±13.72
表7 各组大鼠海马中DA和5-HT的含量s,n=8)
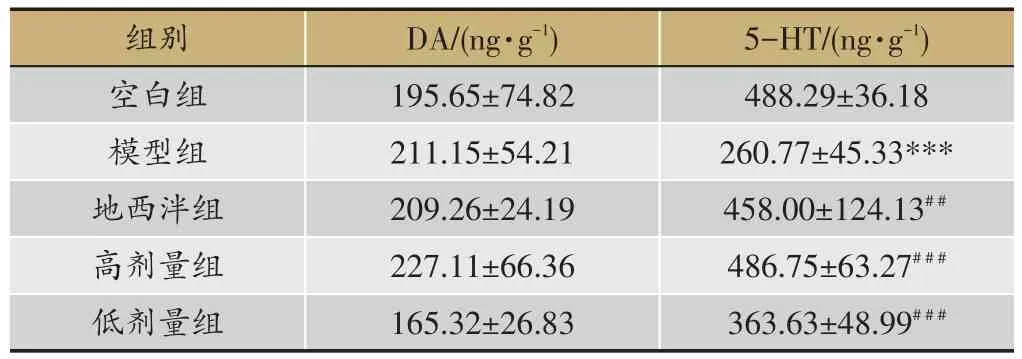
表7 各组大鼠海马中DA和5-HT的含量s,n=8)
注:与空白组比较,***P<0.001;与模型组比较,##P<0.01,###P <0.001。
5-HT/(ng·g-1)488.29±36.18 260.77±45.33***458.00±124.13##486.75±63.27###363.63±48.99###组别空白组模型组地西泮组高剂量组低剂量组DA/(ng·g-1)195.65±74.82 211.15±54.21 209.26±24.19 227.11±66.36 165.32±26.83
2.4.6 回收率试验
取样品9份,分别加入高、中、低3种浓度的对照品溶液,再按样品处理方法操作,平行测定3份样品,计算平均回收率(表4)。高、中、低浓度样品的平均回收率在94.39-108.36%之间,回收率良好。
2.5 各组大鼠皮层中DA和5-HT的含量
与空白组比较,模型组大鼠皮层中DA含量显著升高(P<0.01),5-HT含量显著降低(P<0.01)。与模型组比较,百合地黄汤高、低剂量组大鼠皮层中DA含量显著降低(P<0.01),地西泮组和百合地黄汤低剂量组大鼠皮层中5-HT含量显著升高(P<0.01)(表5)。
2.6 各组大鼠脑干中DA和5-HT的含量
与空白组比较,模型组大鼠脑干中DA含量显著升高(P<0.01),5-HT含量显著降低(P<0.01)。与模型组比较,各给药组大鼠脑干中DA含量无明显变化,地西泮组和百合地黄汤高、低剂量组大鼠脑干中5-HT含量明显升高(P<0.05)(表6)。
2.7 各组大鼠海马中DA和5-HT的含量
与空白组比较,模型组大鼠海马中DA含量无明显变化(P>0.05),5-HT含量显著降低(P<0.01)。与模型组比较,地西泮组和百合地黄汤高、低剂量组大鼠海马中5-HT含量显著升高(P<0.01)(表7)。
3 讨论
目前,治疗失眠的实验研究主要从动物行为学和单胺类神经递质等方面入手[14]。单胺类神经递质对于睡眠的调节具有至关重要的作用[15],大鼠皮层、脑干和海马中都含有与睡眠密切相关的单胺类神经递质[16]。研究表明5-HT是一种促进睡眠的神经递质[17,18],主要分布于大脑皮层和神经突触[19],PCPA是5-HT的合成酶抑制剂,据文献报道[20],大鼠腹腔注射PCPA可明显抑制大鼠脑内5-HT的合成,致使睡眠昼夜节律消失,近乎达到完全失眠;DA是一种兴奋性递质,浓度升高可导致失眠[21]。本实验主要针对百合地黄汤对失眠模型大鼠行为学、睡眠时间以及不同脑区单胺类神经递质含量的影响进行了研究。
本实验采用腹腔注射PCPA复制失眠模型,以翻正反射实验、旷场实验和大鼠体质量变化为指标以确定造模成功与否。模型组大鼠与空白组大鼠相比较,体质量、旷场得分、中央格停留时间、修饰次数、粪便颗粒数以及睡眠潜伏期等指标的变化,均在一定程度上反映成功复制失眠模型。各治疗组大鼠的中央格停留时间、修饰次数和粪便颗粒数均明显降低,表明百合地黄汤可以改善大鼠行为学。各治疗组大鼠睡眠潜伏期缩短,且百合地黄汤组大鼠的睡眠持续时间延长,表明百合地黄汤可以缩短睡眠潜伏期并延长睡眠持续时间,且效果优于地西泮组。百合地黄汤组大鼠皮层中DA含量明显降低,在一定程度上反映百合地黄汤可能通过调节DA含量治疗失眠;地西泮组和百合地黄汤低剂量组大鼠皮层、脑干和海马中5-HT含量均明显升高,百合地黄汤高剂量组大鼠脑干和海马中5-HT含量升高,表明百合地黄汤可能通过调节5-HT,达到治疗失眠的目的。
实验结果表明,百合地黄汤溶液治疗失眠的疗效确切,且优于地西泮,推测可能与百合地黄汤通过多途径、多靶点治疗失眠有关。各治疗组对大鼠皮层中5-HT含量的调节作用最为明显,与相关文献研究结果一致。百合地黄汤能够改善失眠模型大鼠行为学和睡眠,推测百合地黄汤对DA和5-HT的调节作用可能是其治疗失眠的作用机制。已有研究表明[22,23],百合中总皂苷及薯蓣皂苷、地黄中多糖及梓醇等成分均具有镇静催眠的作用,但其作用机制尚不清楚,有待进一步研究。
