红花寄生对尿酸钠诱导急性痛风性关节炎大鼠的干预作用*
2019-07-05杨兴鑫彭小骥胡海波董金材梁小燕熊献琪何旭东
杨兴鑫,彭小骥,胡海波,董金材,顾 雯,梁 丽,梁小燕,熊献琪,何旭东,俞 捷**
(1.云南中医药大学中药学院 昆明 650500;2.昆明市代谢性疾病中医药防治重点实验室昆明 650500;3.赣南医学院药学院 赣州 341000)
痛风(Gout)是由于嘌呤代谢紊乱和(或)尿酸排泄障碍所致的一组临床症候群,表现为反复发作的关节炎、痛风石(Tophi)形成和关节畸形,严重者可致骨关节病变和关节活动障碍与畸形[1]。多与现代人饮食无度、酗酒、高嘌呤饮食、家族遗传史、肥胖、创伤、手术及一些药物的诱发有关。
目前常用于治疗急性痛风性关节炎的化学药主要有非甾体类抗炎药(NSAIDs)、秋水仙碱、糖皮质激素等,其中秋水仙碱是治疗急性发作的传统药物,其不良反应较多,主要是胃肠道反应;间歇期和慢性期则采用抑制尿酸生成药、促尿酸排泄药(如丙磺舒、苯溴马隆、苯磺唑酮)等[2-4]。虽然这些化学药品能有效控制痛风性关节炎及产生降尿酸作用,但均存在毒副作用较大,不良反应多,易复发,价格昂贵或不宜长期服用等缺点。
中药及天然药物具有疗效确切、毒副作用低,及多组分、多靶点综合作用特点,是药物发现的重要源泉,可从中药及天然药物资源中开发安全高效的治疗痛风的药物。目前发现复方四妙散、二妙丸等经典复方,以及萆薢、牛膝、土茯苓、秦艽、虎杖、大黄等单味中药均具有良好的痛风治疗作用[5]。
红花寄生为桑寄生科植物红花寄生Scurrula parasitica Lour.的带叶茎枝,在我国南部省区分布,常寄生于余甘、石榴、柚、山茶、夹竹桃等植物树上,有补肝肾、祛风湿、强筋骨之功效[6]。民间用于治疗风湿、胃痛、关节痛、高血压、坐骨神经痛、腰痛、胎动不安、产后乳少等[6],在我国云南西双版纳州当地居民还用于治疗痛风相关症状。
然而,迄今为止,红花寄生对治疗痛风的相关药理作用仍未见报道。本文采用尿酸钠诱导损伤的急性痛风性关节炎模型大鼠探究其药理作用,为寻找用于痛风防治的新型中药以及云南特有民族药物的研究开发提供科学依据。
1 动物、材料、试剂及仪器
1.1 实验动物
SPF级健康雄性SD大鼠,体重量180±20 g,购自昆明医科大学实验动物中心(合格证号:SCXK(滇)k2015-0002);实验大鼠饲料购自昆明医科大学实验动物中心,(合格证号:SCXK(滇)k2015-0003)。该实验经云南中医学院动物实验中心伦理委员会审查合格(R-0620170010)。实验前,所有大鼠适应性喂养1周,在适应性饲养期间,动物自由取食,自由饮水。饲养室内保持安静,室内温度维持在23-25℃,湿度55-75%,日光灯照明,每天24 h中保持12 h照明12 h黑暗。
1.2 试剂与材料
红花寄生样品采自云南西双版纳州勐海县,样品经赣南医学院胡海波老师鉴定为桑寄生科植物红花寄生Scurrula parasitica L.,凭证标本保存于昆明市代谢性疾病中医药防治重点实验室;苯溴马隆购自江苏省昆山龙灯瑞迪制药有限公司(国药准字J20130141,规格:50 mg·片-1);微晶型尿酸钠(MSU)购自Sigma公司;吐温-20(Tween-20)购自Biosharp科技有限公司;大鼠白细胞介素-1β(IL-1β)、肿瘤坏死因子α(TNF-α)测定试剂盒购自联科生物技术有限公司;白细胞介素-8(IL-8)、黄嘌呤氧化酶(XOD)测定试剂盒购自南京建成生物工程研究所;尿酸(UA)测定试剂盒购自中生北控生物科技股份有限公司;实验用水由Milli-Q超纯水系统(美国Millipore公司)制备;其余试剂均为分析纯。
1.3 主要仪器
T-5000型电子天平(d=0.1 g;常熟双杰测试仪器厂);BS-224电子天平(d=0.00001 g,北京赛尔利斯仪器系统有限公司);超声波清洗机(14-1275;宁波新芝生物科技股份有限公司);N-1100型旋转蒸发仪(上海爱朗仪器有限公司);FD5-3型冷冻干燥机(美国金西盟国际集团);TGL-16BS台式微量离心机(上海安亭科学仪器厂);HR/16M高速冷冻离心机(湖南赫西仪器装备有限公司);UV-1800PC型紫外可见分光光度计(上海翱艺仪器有限公司);Infinite M200 Pro多功能酶标仪(瑞士Tecan公司)。
2 实验方法
2.1 红花寄生提取物制备
将烘干(50℃)后的红花寄生药材粉碎,取粉末适量,加8倍量蒸馏水浸泡30 min,煎煮30 min(以煮沸时开始计算),过滤,收集滤液;残渣再加水煮沸30 min,过滤,收集滤液;残渣再加10倍量80%乙醇加热回流60 min,过滤,收集滤液;合并3次滤液,减压回收溶剂(50℃);所得浸膏置于-80℃冰箱中结冰后,转移至冻干机中,冷冻干燥得冻干粉。将冻干粉研碎,混匀,置于干燥器中保存备用。
2.2 痛风动物模型复制及给药
2.2.1 分组与给药
36只大鼠随机分6组,分别为对照组、模型组、阳性药组、红花寄生(高、中、低剂量)组,每组6只;对照组及模型组给予等体积蒸馏水,阳性药组给予苯溴马隆4.2 mg·kg-1,红花寄生高、中、低剂量组分别给予4.0 g·kg-1、2.0 g·kg-1、1.0 g·kg-1红花寄生提取物;其中红花寄生高、中、低剂量组连续灌胃给药10天,阳性药组苯溴马隆连续灌胃给药2天,每天灌胃给药1次,灌胃体积为10 mL·kg-1。
2.2.2 造模
末次给药1 h后,将模型组、阳性药组及红花寄生低、中、高剂量组按照Mc Carty DJ经典方法开始造模[7]:即用酒精局部消毒,将1 mL灭菌注射针于受试大鼠右侧踝关节背侧从45°方向插入胫骨肌腱内侧,将0.05 mL尿酸钠溶液(取0.5 g MSU,充分研细,加入9 mL生理盐水和1 mL吐温-80,加热搅拌溶解即得)注入到踝关节腔造模,正常对照组注射0.05 mL无菌生理盐水。
2.3 相关指标检测
2.3.1 裸关节肿胀度测定
每组大鼠分别于造模后0、2、4、8、12、24、48、72、96 h,采用傅线法测量右侧踝关节同一部位周长,每只测3次,取平均值。
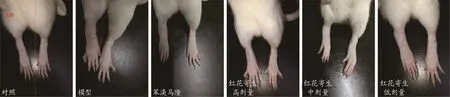
图1 注射MSU 24 h后各组大鼠踝关节及足趾
表1 红花寄生提取物对急性痛风性关节炎大鼠踝关节周长的影响
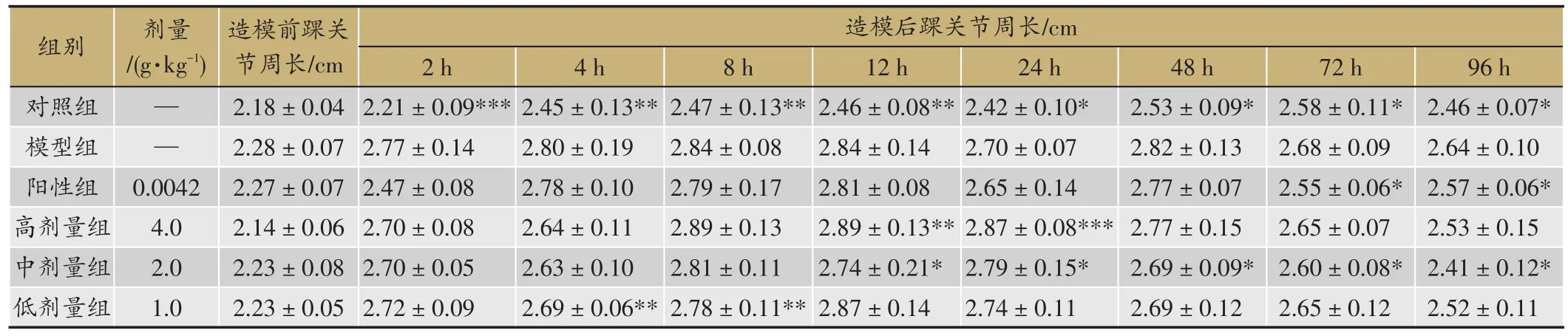
表1 红花寄生提取物对急性痛风性关节炎大鼠踝关节周长的影响
注:与模型组比较,*P <0.05,**P <0.01,***P <0.001。
造模后踝关节周长/cm剂量/(g·kg-1)——0.0042 4.0 2.0 1.0组别对照组模型组阳性组高剂量组中剂量组低剂量组造模前踝关节周长/cm 2.18±0.04 2.28±0.07 2.27±0.07 2.14±0.06 2.23±0.08 2.23±0.05 2 h 2.21±0.09***2.77±0.14 2.47±0.08 2.70±0.08 2.70±0.05 2.72±0.09 4 h 2.45±0.13**2.80±0.19 2.78±0.10 2.64±0.11 2.63±0.10 2.69±0.06**8 h 2.47±0.13**2.84±0.08 2.79±0.17 2.89±0.13 2.81±0.11 2.78±0.11**12 h 2.46±0.08**2.84±0.14 2.81±0.08 2.89±0.13**2.74±0.21*2.87±0.14 96 h 2.46±0.07*2.64±0.10 2.57±0.06*2.53±0.15 2.41±0.12*2.52±0.11 24 h 2.42±0.10*2.70±0.07 2.65±0.14 2.87±0.08***2.79±0.15*2.74±0.11 48 h 2.53±0.09*2.82±0.13 2.77±0.07 2.77±0.15 2.69±0.09*2.69±0.12 72 h 2.58±0.11*2.68±0.09 2.55±0.06*2.65±0.07 2.60±0.08*2.65±0.12
2.3.2 血样分析
于造模后96 h,用3.5%水合氯醛(0.1 mL·10 g-1)将大鼠麻醉解剖后,肝门静脉取血4-5 mL,于4000 r·min-1,常温离心10 min,分离出血清,按各试剂盒说明书操作,绘制标准曲线,测定血清中IL-1β、IL-8、TNF-α、XOD及UA水平。
2.4 数据统计处理
3 实验结果
3.1 红花寄生提取物对急性痛风性关节炎大鼠踝关节肿胀度的影响
如图1所示,在踝关节腔及足趾皮下注射MSU造模24 h后,与对照组相比,模型组大鼠踝关节及足趾出现显著红肿和功能障碍(不能正常行走);给予苯溴马隆后,红肿和功能障碍明显减轻,虽与对照组大鼠左侧踝关节相比仍有些肿胀,但整体趋近于对照组;同苯溴马隆一样,给予红花寄生提取物后,红肿和功能障碍均有一定程度减轻,虽与对照组大鼠左侧踝关节比较仍有肿胀,但趋近于对照组,尤以中剂量组改善作用明显。结果表明,红花寄生提取物可有效减轻MSU造成的大鼠踝关节及足趾红肿,并能改善功能障碍。
寄生茶提取物对急性痛风性关节炎大鼠踝关节周长的影响(表1),与正常对照组相比,模型组大鼠注射MSU后2 h,关节及足趾开始出现红肿和功能障碍,发生率为100%,踝关节周长显著增加(P<0.05,P<0.01,P < 0.001),8-48 h达高峰期,在48 h后开始逐步消退。与模型组比较,苯溴马隆组在72 h后可显著降低大鼠踝关节周长(P<0.05);红花寄生高、中、低剂量组在4-96 h的不同时间段均能不同程度降低降低大鼠踝关节周长(P<0.05,P<0.01,P<0.001)。结果表明,红花寄生提取物可有效降低大鼠踝关节肿胀程度。
3.2 红花寄生提取物对急性痛风性关节炎大鼠血清IL-1β、IL-8、TNF-α含量的影响(表2)
与正常对照组相比,大鼠造模后血清中IL-1β、IL-8和TNF-α含量均有明显升高(P<0.05,P<0.01,P<0.001),提示MSU导致炎症因子释放,炎症发生。与模型组相比,红花寄生中剂量组和苯溴马隆组能显著降低血清中IL-1β、IL-8、TNF-α含量(P <0.05,P <0.01,P<0.001)。结果表明,红花寄生提取物可抑制MSU导致的炎症反应而缓解痛风性关节炎。
3.3 红花寄生提取物对痛风性关节炎大鼠血清尿酸、黄嘌呤氧化酶的影响(表3)
经MSU溶液注射后,模型组大鼠血UA浓度显著升高(P<0.001),且模型组大鼠XOD活性明显增加(P<0.01),提示大鼠体内嘌呤及尿酸代谢紊乱。与模型组比较,红花寄生高、低剂量组和阳性药组均能明显降低血UA水平(P <0.05,P <0.01),红花寄生高、中、低剂量组和阳性药组均能降低XOD活性(P<0.05,P<0.01)。结果表明,红花寄生提取物可有效降低XOD活性及血清UA含量而缓解痛风性关节炎。
表2 红花寄生提取物对急性痛风性关节炎大鼠血清中IL-1β、IL-8、TNF-α含量的影响(,n=6)
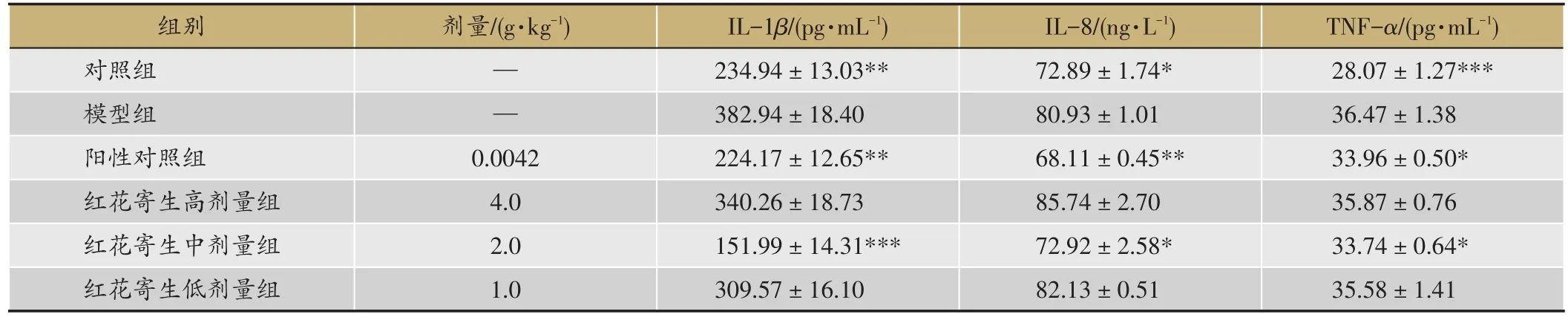
表2 红花寄生提取物对急性痛风性关节炎大鼠血清中IL-1β、IL-8、TNF-α含量的影响(,n=6)
注:与模型组比较,*P<0.05,**P<0.01,***P <0.001。
TNF-α/(pg·mL-1)28.07±1.27***36.47±1.38 33.96±0.50*35.87±0.76 33.74±0.64*35.58±1.41组别对照组模型组阳性对照组红花寄生高剂量组红花寄生中剂量组红花寄生低剂量组剂量/(g·kg-1)— —0.0042 4.0 2.0 1.0 IL-1β/(pg·mL-1)234.94±13.03**382.94±18.40 224.17±12.65**340.26±18.73 151.99±14.31***309.57±16.10 IL-8/(ng·L-1)72.89±1.74*80.93±1.01 68.11±0.45**85.74±2.70 72.92±2.58*82.13±0.51
表3 红花寄生提取物对大鼠急性痛风性关节炎大鼠血清中UA、XOD的影响(s,n=6)
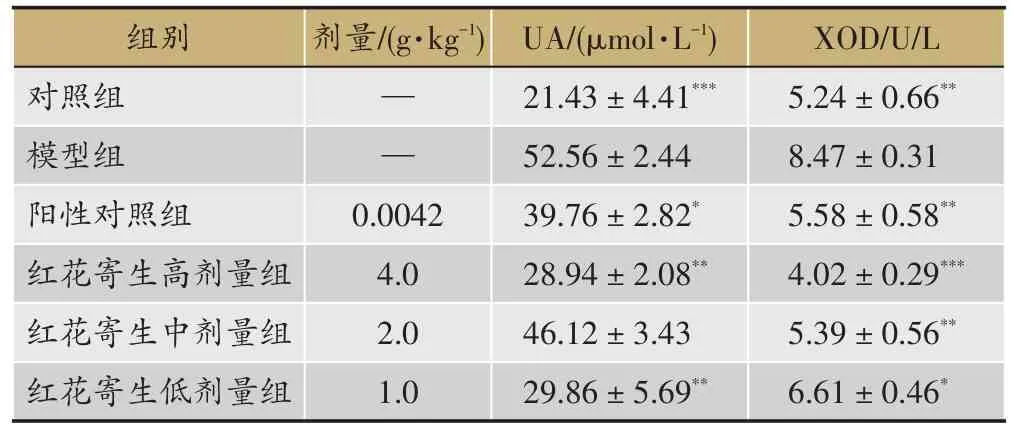
表3 红花寄生提取物对大鼠急性痛风性关节炎大鼠血清中UA、XOD的影响(s,n=6)
注:与模型组比较,P<0.05,**P<0.01,***P<0.001。
XOD/U/L 5.24±0.66**8.47±0.31 5.58±0.58**4.02±0.29***5.39±0.56**6.61±0.46*组别对照组模型组阳性对照组红花寄生高剂量组红花寄生中剂量组红花寄生低剂量组剂量/(g·kg-1)— —0.0042 4.0 2.0 1.0 UA/(μmol·L-1)21.43±4.41***52.56±2.44 39.76±2.82*28.94±2.08**46.12±3.43 29.86±5.69**
4 讨论
痛风是MSU由沉积在关节周围而引起的一种炎症,临床以关节剧痛伴肿胀发热暗红为主要表现。MSU注射踝关节腔后可致大量炎性细胞浸润,受试关节周径明显增大,肿胀严重,正常行走步态明显改变[8]。因此,本文采用MSU诱导急性痛风性关节炎大鼠模型(Mc Carty DJ经典造模方法),并以苯溴马隆为阳性药(可抑制肾小管对尿酸的再吸收而降低血中尿酸,进而缓解急性痛风性关节炎[9])探讨红花寄生提取物对急性痛风性关节炎的干预作用。研究表明,小鼠雌雄动物之间血清UA正常值差异较大[10],故本文仅选用雄鼠。
痛风最典型的临床症状是突发性足趾关节的红、肿、剧烈疼痛等一系列急性关节炎表现[11,12]。本文研究发现,在踝关节腔内注射MSU后,大鼠踝关节肿胀程度显著增加,而红花寄生提取物高、中、低剂量组能在不同时段不同程度抑制其大鼠踝关节肿胀(P<0.05,P<0.01,P<0.001),说明红花寄生可有效缓解急性痛风性关节炎。
痛风性关节炎的核心是中性粒细胞介导的炎症,增强的中性粒细胞-内皮细胞黏连是急性痛风产生的本质,炎性细胞因子IL-1β、IL-8、TNF-α等在急性痛风性关节炎的免疫和病理过程中发挥重要作用[9]。研究表明,抗TNF-α能明显抑制内皮细胞的激活和中性粒细胞募集,从而抑制炎症反应,降低急性痛风性关节组织局部IL-1β、IL-8和TNF-α水平,可能终止炎性细胞因子的恶性循环[13]。本文研究发现,MSU可显著增加IL-1β、TNF-α及IL-8水平,而中剂量红花寄生提取物能显著降低这些炎症因子的水平(P<0.05,P<0.001),表明红花寄生可有效抑制MSU引发的炎症反应而缓解急性痛风性关节炎。
XOD是体内催化黄嘌呤、次黄嘌呤氧化生成尿酸的酶,而血UA升高是痛风的重要生化基础,二者均是痛风发生发展的体内重要标志物[14]。本研究表明,MSU显著升高XOD活力,且血UA也随之显著升高;而给予低、高剂量红花寄生提取物后,二者水平均显著降低(P <0.05,P <0.01,P<0.001),且其高剂量的效果优于苯溴马隆。说明红花寄生可有效抑制XOD活力,降低血UA而缓解MSU诱导的急性痛风性关节炎。
综上所述,红花寄生可缓解MSU诱导的大鼠急性痛风性关节炎相关症状。其机制可能与抑制炎症反应,抑制XOD活力及促进UA排泄有关。另外发现,本研究选取的红花寄生高、中、低三个剂量的药效指标与剂量没有成明显剂量依赖关系,这可能是由于天然药物中复杂的化学成分及复杂作用机制(多途径、多靶点及叠加等方式整合作用)导致的,且这种非线性特点亦存在其他天然产物中[15];也可能是本研究给药剂量没有在能体现剂量依赖关系的剂量范围内。本研究结果可为红花寄生临床应用、资源开发及创新药品/健康产品研发等提供科学依据,同时也为深入探讨红花寄生 缓解痛风的作用机制夯实基础。
