中药仙鹤草不同药用部位的体外药效学研究*
2019-07-05田露露包永睿李天娇刘金瑛孟宪生
田露露,包永睿,王 帅,李天娇,刘金瑛,孟宪生
(1.辽宁中医药大学药学院 大连 116600;2.辽宁省组分中药工程技术研究中心 大连 116600;3.辽宁省现代中药研究工程实验室 大连 116600;4.北京中医药大学 北京 100029)
仙鹤草为蔷薇科植物龙芽草Agrimonia pilosa Ledeb.的干燥地上部分,味苦、涩,性平,归肺、肝、脾经,有软坚散结、收敛止血、益气扶正的功效[1-3]。其药用部位演变过程为“根、根芽、全草、地上部分”,《别录》曰:“八月采根,曝干。”《本草图经》亦曰:“三月、八月采根,日干。”说明其用药部位是根,而《蜀本草·图经》则明确指出:“二月、三月采牙,日干”,说明仙鹤草的药用部位已从根而逐步精确到了根芽。到晋、唐时期,龙牙草的药用部位已从根芽扩大到全草,如《范汪方》用狼牙草茎叶熟捣,敷贴之,治金疮,兼能止血,古人充分认识到了仙鹤草各个部位的作用,择而用之,2015版药典载仙鹤草药用部位为干燥地上部分[1,4]。近年来,虽然关于仙鹤草抗肿瘤、抗氧化、抗凝血等活性的研究得到重视,但其不同部位的精准应用实验研究报道较少[5]。故本实验建立仙鹤草不同药用部位的指纹图谱并进行相似度评价,同时比较研究仙鹤草不同药用部位抗肿瘤、抗氧化、抗凝血作用,以期为仙鹤草药材不同药用部位的合理使用提供科学依据,为生药不同部位的精准应用奠定实验基础。
1 材料与方法
1.1 材料
人肝癌细胞株HepG2细胞、人胃癌细胞株HGC-27细胞、人结肠癌细胞株Caco-2细胞均由中国科学院上海生命科学研究院细胞库提供;昆明种小鼠购自辽宁长生生物技术有限公司(合格证号:SYXK(辽)2013-0009);仙鹤草药材(采自辽宁中医药大学百草园)辽宁中医药大学许亮教授鉴定为Agrimoniapilosa Ledeb.的干燥全草;2,2'-联氮-(3-乙基苯并噻唑-6-磺酸)二铵盐(ABTS+)、1,1-二苯基-2-三硝基苯肼(DPPH)均购自上海阿拉丁试剂有限公司;小鼠凝血酶原(PT)酶联免疫试剂盒购自上海朗顿生物技术有限公司;DMEM培养基、双抗、胎牛血清、胰酶、MTT购自美国Gibco公司。
1.2 仪器与设备
Agilent1100型快速高效液相色谱仪(美国Agilent公司);SpectraMaxPlus384光吸收酶标仪(美国MolecularDrvices公司)。
1.3 供试品溶液的制备及药液的配制
分别取仙鹤草根、茎、叶、花粉末(过3号筛)约5.0 g,置于圆底烧瓶中,加入75 mL50%的乙醇溶液,加热回流提取1 h,滤过,回收溶剂至干,供体外抗肿瘤、抗氧化、促凝血作用实验用,根、茎、叶、花的得率分别为11.0%、13.8%、27.6%、24.8%;同法制得仙鹤草根、茎、叶、花提取液,滤过,取续滤液摇匀过0.22 μm微孔滤膜,供HPLC分析实验用。
1.4 HPLC指纹图谱的建立及相似度评价
取2.1项供试品溶液,AgilentTC-C18(2)色谱柱(4.6 mm×250 mm,5 μm),流动相:0.3%甲酸水溶液(A)-乙腈(B),程序梯度洗脱0-35 min,5%-18%B;35-40 min,18%-18%B;40-55 min,18%-26%B;55-75 min,26%-40%B;75-80 min,40%-100%B,流速1.0 mL·min-1;柱温30℃;进样量10 μL;检测波长320 nm。分析检测,得到仙鹤草药材不同药用部位的指纹图谱。应用《中药色谱指纹图谱相似度评价系统2004A版》(国家药典委员会)软件,将实验结果导入软件生成对照图谱,进行相似度评价。
1.5 体外抗肿瘤药效评价
人肝癌细胞株HepG2细胞、人胃癌细胞株HGC-27细胞、人结肠癌细胞株Caco-2细胞均培养于含体积分数为10%胎牛血清的DMEM培养液中,取对数生长期的细胞接种于96孔培养板,继续培养24 h后,弃上清液,分别用0.1 g·mL-1、0.75 g·mL-1、0.50 g·mL-1、0.25 g·mL-1、0.10 g·mL-1(生药)的仙鹤草根、茎、叶、花含药培养液(0.1%DMSO助溶)刺激HepG2细胞、HGC-27细胞、Caco-2细胞24 h后,每孔加入5 mg·mL-1MTT溶液20 μL,4 h后弃上清液,加入150 μLDMSO,震荡溶解紫色结晶,酶标仪492 nm波长下测定吸光度(OD),计算细胞增值抑制率,并使用SPSS 17.0计算半数有效浓度(IC50)[6]。
1.6 体外抗氧化活性评价
1.6.1 DPPH法
参照文献[7],以Vc为阳性对照,在96孔板中分别加入100 μL 20.0 mg·mL-1、15.0 mg·mL-1、10.0 mg·mL-1、7.5 mg·mL-1、5.0 mg·mL-1(生药)的供试品溶液和100 μL DPPH(2×10-4mol·L-1)自由基工作液,振荡均匀,室温、避光静置30 min,测定溶液在517 nm处的吸光值,每组平行设3个复孔。按如下公式计算供试品的自由基清除率,并计算出IC50值。

Asample为供试品与DPPH反应液作用后的吸光度;Acontrol为溶剂50%乙醇与DPPH反应液作用后的吸光度。
1.6.2 ABTS法
参照文献[8],精密称取ABTS和K2S2O8适量,使用去离子水将其分别溶解并转入容量瓶中混合,定容使其终浓度分别为7.00和2.45 mmol·L-1,在室温、避光条件下反应12 h,得到ABTS储液。用前以PBS(pH7.4)稀释成在734 nm波长下吸光度为0.7±0.02的工作液。以Vc为阳性对照,在96孔板中分别加入2 μL 20 mg·mL-1、1.5 mg·mL-1、1.0 mg·mL-1、0.75 mg·mL-1、0.50 mg·mL-1(生药)的供试品溶液和180 μLABTS工作液,振荡均匀,室温、避光静置6 min,测定溶液在734 nm处的吸光值,每组平行设3个复孔。计算供试品的自由基清除率,并计算出IC50,ABTS自由基清除率的计算公式与DPPH法一致。
1.7 对凝血酶原(PT)的影响
昆明种小鼠60只(雄性,20-22 g),随机分为空白对照组,阳性组,仙鹤草根、茎、叶、花组,共6组,每组10只,置于通风条件下,自由饮水饮食。空白对照组灌胃给予生理盐水0.1 mL·10 g-1,仙鹤草根、茎、叶、花组以0.01 g生药·g-1灌胃,每日给药1次,连续3天,眼球取血0.45 mL置于肝素钠处理的离心管中,3000 r·min-1离心15 min,收集血浆。按试剂盒的要求进行凝血酶原(PT)的测定。
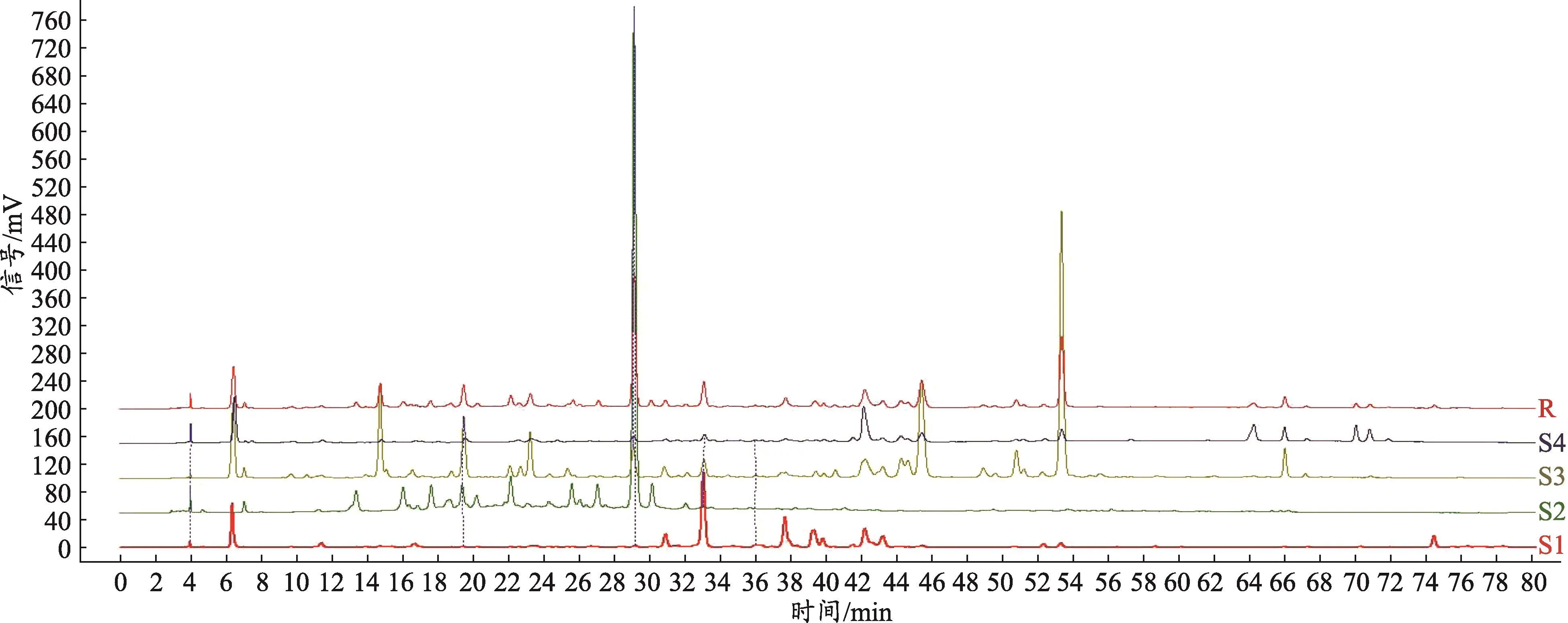
图1 仙鹤草不同药用部位指纹图谱(S1根,S2茎,S3叶,S4花,R软件生成对照指纹图谱)
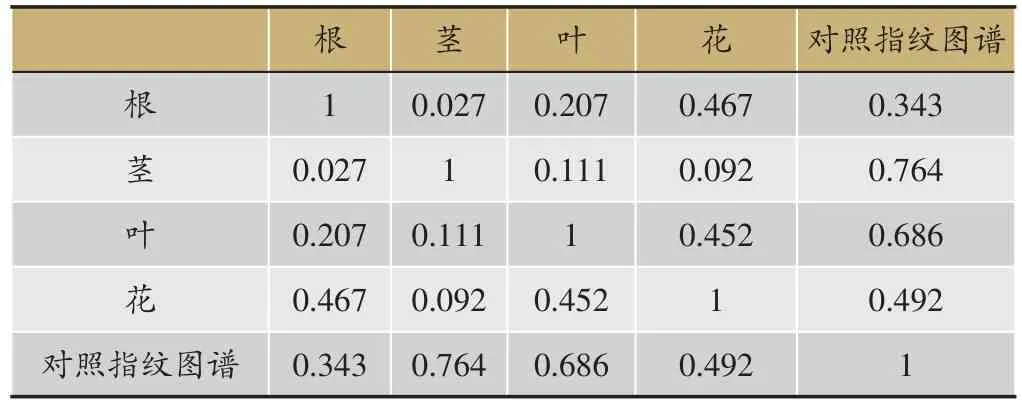
表1 指纹图谱相似度结果
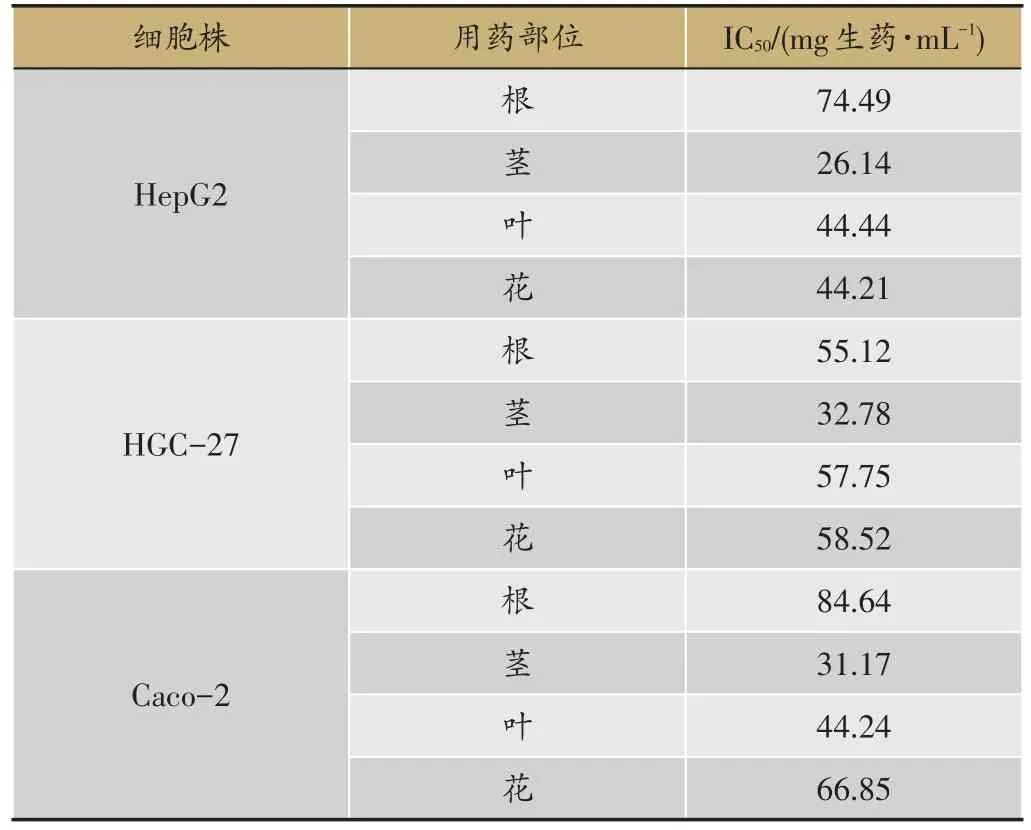
表2 仙鹤草不同用药部位对癌细胞株增殖的影响(n=3)
2 实验结果
2.1 仙鹤草药材不同药用部位指纹图谱及相似度计算结果
仙鹤草不同药用部位指纹图谱与对照图谱(图1),相似度计算结果(表1)。从指纹图谱峰面积及数量、相似度计算结果可以看出,仙鹤草不同药用部位的化学成分存在较大差异。
2.2 仙鹤草药材不同药用部位体外抗肿瘤药效结果
仙鹤草仙鹤草药材不同药用部位作用HepG2细胞、HGC-27细胞、Caco-2细胞24 h后,对细胞的增殖抑制作用结果(表1)。仙鹤草根、茎、叶、花对人肝癌细胞株HepG2细胞、人胃癌细胞株HGC-27细胞、人结肠癌细胞株Caco-2细胞有不同程度的增殖抑制作用,茎对三种癌细胞株的增殖抑制作用最强。
2.3 仙鹤草药材不同药用部位体外抗氧化活性结果
DPPH是属于极少在室温下稳定的自由基之一,DPPH有一个单电子,在517 nm有强的吸收。当自由基被清除时吸光度下降,同时颜色变浅黄。ABTS在适当的氧化剂作用下被氧化成墨绿色的ABTS+,当具有抗氧化活性的物质加入到预先形成的ABTS+溶液中后,在抗氧化物质的作用下ABTS+转变成ABTS,这时溶液会发生褪色,在734 nm处的吸光度会下降,褪色程度取决于样品的抗氧化活性和浓度,因此可以用于体外抗氧化活性的评价[9]。仙鹤草药材不同药用部位均显示较强体外抗氧化活性,叶、花清除DPPH、ABTS自由基的能力强于根、茎,结果(表3)。
2.4 仙鹤草药材不同药用部位对凝血酶原影响的结果
与空白组比较,仙鹤草根、茎、叶组小鼠凝血酶原水平明显降低(P<0.01),提示仙鹤草药材不同药用部位均对降低凝血酶原水平有作用。其中,仙鹤草茎组和仙鹤草叶组效果更明显。结果(图2)。
3 讨论
《神农本草经百种录》:“凡药之用……各以其所偏胜而即资之疗疾,故能补偏救弊,调和脏腑”,药物的不同药用部位偏胜不同,入药也存在差异,纵观历代本草,对不同药用部位性效的不同已有深入认识。《汤液本草》载:“凡根之在土者,中半以上,气脉之上行也,以生苗者为根;中半以下,气脉之下行也,入土以为梢。病在中焦与上焦者,用根;在下焦者,用梢。根升而梢降。大凡药根有上中下:人身半以上,天之阳也,用头;在中焦用身;在身半以下,地之阴也,用梢。述类象形者也。”《本草发挥》谓:“当知病在中焦用身,上焦用根,下焦用梢。”《本草蒙筌》称:“根梢各治,尤勿混淆。生苗向上者为根,气脉行上;入土垂下者为梢,气脉下行。中截为身,气脉中守。上焦病者用根,中焦病者用身,下焦病者用梢。盖根升梢降,中守不移故也[10]”。仙鹤草,首载于《神农本草经》,即古时所称的狼牙草,最早以根、根芽入药,名牙子,狼牙,后扩展至以全草入药,称狼芽草,2015版药典载仙鹤草药用部位为干燥地上部分,随着现代中药研究的不断深入,同一植物,不同的药用部位,由于性状特点不同或主要成分的积累分布差异,导致不同药用部位药理药效有一定差异[11-13]。因此,为了更好地利用仙鹤草药材的药用价值,有效开发药材资源,本实验对仙鹤草不同药用部位的指纹图谱进行研究并进行相似度评价,各药用部位指纹图谱的差异直观而明显,根和茎的色谱峰较为单一,色谱峰的数量与强度都少于花和茎,花和茎色谱图的指纹信息较为丰富,具有各自的特征性,又具备一定的相似性,提示仙鹤草不同药用部位的化学成分具有一定的差异性。
化学成分的不同导致不同药用部位药理效应有一定差异[14]。本研究体外抗肿瘤实验结果表明仙鹤草各药用部位均显示较强抗肿瘤、抗氧化药效、抗凝血作用,其中茎抗人肝癌细胞株HepG2细胞、人胃癌细胞株HGC-27细胞、人结肠癌细胞株Caco-2细胞增殖的作用强于其根、叶、花三个部位,叶、花清除DPPH、ABTS自由基的作用强于根、茎两个部位,茎、叶降低小鼠血浆凝血酶原水平作用强于根、花两个部位,表明中药药用部位的不同,与用药安全、疗效关系紧密。随着对仙鹤草的研究日益增多,抗肿瘤、抗氧化、镇痛抗炎、止血降压、抗疟杀虫等作用使其在临床上被广泛用于治疗肿瘤、糖尿病、出血、梅尼埃病及阴道滴虫病等病。同时因仙鹤草具有补虚扶正的药效,使其单方或复方对治疗内外妇儿科等疾病都有着较好的疗效,值得临床推广。药效的深入研究使得其安全有效性成为关键前提,然而,目前对仙鹤草的药用部位精准应用研究分析不够深入,今后宜开展仙鹤草系统规范的药用部位研究,观察其临床疗效,以期更好地指导临床合理用药[15]。
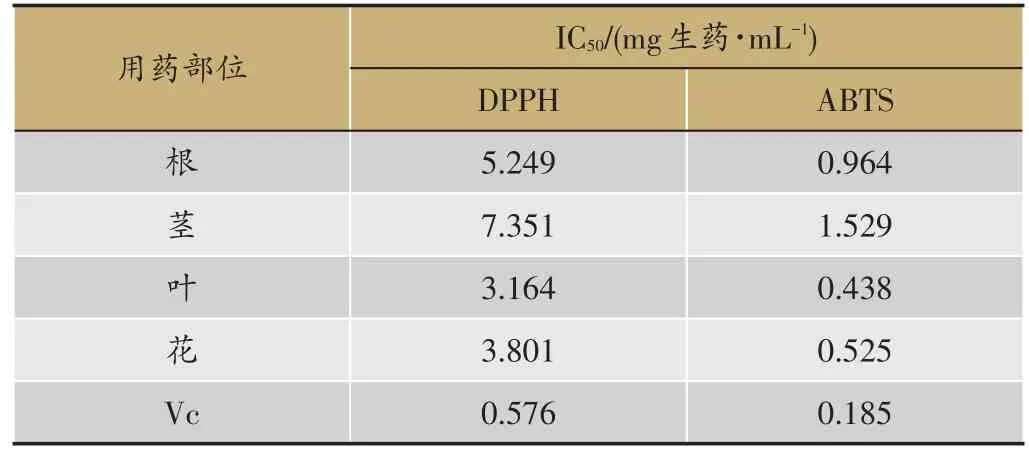
表3 仙鹤草不同用药部位清除DPPH、ABTS自由基结果(n=3)
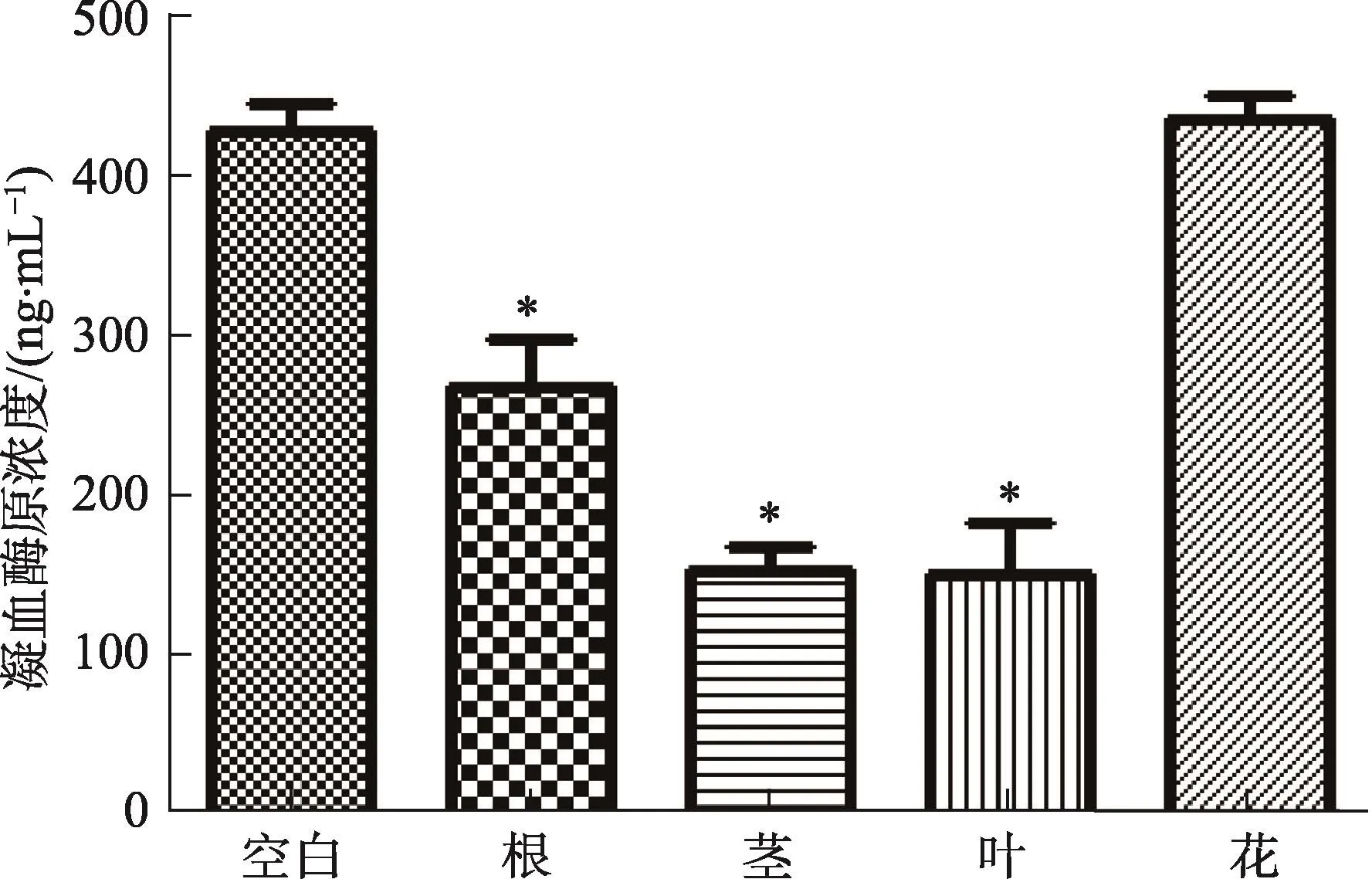
图2 仙鹤草不同药用部位对凝血酶原的影响(n=10,*与空白组比较P<0.01)
随着中药现代研究的不断深入,中药药用部位的疗效与成分也需得到进一步研究。本实验结果显示仙鹤草药材不同药用部位的化学成分存在一定差异,同时抗肿瘤、抗氧化、抗凝血药效实验结果显示治疗不同病症的最佳药用部位也有所不相同,提示生药治疗不同疾病药用部位不可一概而论,为仙鹤草药材的合理使用提供科学依据,为生药不同部位的精准应用奠定实验基础。
