车前草不同药用部位抗炎、抗肿瘤、抗氧化的活性研究*
2019-07-05崔琳琳包永睿李天娇刘金瑛孟宪生
崔琳琳,包永睿,2,3,王 帅,2,3,李天娇,2,3,刘金瑛,孟宪生,2,3**
(1.辽宁中医药大学药学院 辽宁 116600;2.辽宁省组分中药工程技术研究中心 辽宁 116600;3.辽宁省现代中药研究工程实验室 辽宁 116600;4.北京中医药大学 北京 100029)
车前草,又名车轮草、猪耳草,属车前科植物车前Plantago asiatica L.或平车前 Plantago depressa Willd.的干燥全草[1,2]。始载于《神农本草经》,列为上品。性寒、味甘,归肝、肾经,具有清热、利尿通淋、凉血解毒、祛痰的功效,常用于治疗痈肿疮毒、水肿尿少、痰热咳嗽等疾病[3-5]。研究发现,车前草中含有黄酮类、三萜类、多酚类、生物碱类等化学成分[6]。药理活性方面,车前草除有利尿通淋、止泻缓泻作用外,在抗炎、抗肿瘤、抗氧化等方面显示出潜在的药用价值[7-9]。随着近年车前草的价值被日益发掘,社会对其需求也越来越大。然而目前对于车前草的研究工作主要集中在资源调查、化学成分上,对药效的研究主要集中在利尿,止泻缓泻上,对车前草不同用药部位及其它药效研究却鲜有报道。本文旨在研究车前草不同药用部位抗炎、抗肿瘤、抗氧化活性差异,进一步明确车前草不同药用部位的合理使用,扩大车前草临床用药,更好地开发利用车前草资源提供理论依据。
1 材料与方法
1.1 仪器
Agilent1260高效液相色谱仪(安捷伦公司);HD2-BCN-1360B型生物洁净工作台(哈尔滨东联电子技术开发有限公司);SUNRISE酶标仪(瑞士TECAN公司);超低温冰箱-80℃(海尔公司);NKSY系列智能恒温水浴锅(常州诺基仪器有限公司);USAUTOFLOW型CO2培养箱(德国NUAIRE公司);AE31型倒置相差显微镜(Motic公司)。
1.2 试剂
胎牛血清(北京全式金生物技术有限公司);DMEM高糖培养基(美国GIBCO公司);二甲基亚砜(Sigma公司);胰蛋白酶、MTT(美国GIBCO公司);对氨基苯磺酸、抗坏血酸(天津市科密欧化学试剂有限公司);α-萘胺(国药集团化学试剂有限公祠);DPPH、ABTS(北京索莱宝科技有限公司);芦丁(批号:17120702)、毛蕊花糖苷(批号:16072904)、二氢槲皮素(批号:15060820)对照品均购自于成都普菲德生物技术有限公司,纯度均≥98%;乙腈为色谱纯(Merck公司);水为超纯水。
1.3 药材
车前草药材,取自辽宁中医药大学本草园,经辽宁中医药大学中药鉴定学教研室许亮教授鉴定为车前科植物平车前(Plantago depressa Willd.)的干燥全草。将车前药材分为车前根、车前叶、车前子及除去根、叶、子后的剩余部位,于阴凉处干燥。
1.4 细胞株
人肝癌细胞株HepG2、小鼠RAW264.7均购自齐氏(上海)生物科技有限公司。
1.5 指纹图谱的建立
1.5.1 色谱条件
色谱柱:AgilentPoroshellSB-C18(4.6 mm×100 mm,2.7 μm),填料:十八烷基硅烷键合硅胶;流动相:0.2%甲酸水(A)-乙腈(B),梯度洗脱(0-10 min,5%→20%B,10-45 min,20%→38%B,45-50 min,38→100%B),流速0.8 mL·mm-1,柱温为30℃,检测波长260 nm。
1.5.2 供试品溶液的制备
准确称取干燥后的车前不同部位药材粗粉5.0 g置于150 mL具塞锥形瓶中,加入15倍量50%乙醇回流提取1 h,放冷,过滤。取续滤液1 mL,进样前过0.22 μm微孔滤膜做供试品溶液,其余液体浓缩成浸膏,收集浸膏,计算出膏率(根:9.3%、叶:28.8%、子:34.5%剩余部位:12.9%)。
1.5.3 对照品溶液的制备
取芦丁、毛蕊花糖苷、二氢槲皮素对照品适量,加甲醇制成每1 mL约含0.2 mg的混合对照品溶液,即得。
1.6 细胞培养
人肝癌细胞HepG2、小鼠RAW264.7巨噬细胞经解冻复苏后,按本实验室细胞培养SOP常规培养,取对数生长期细胞进行实验。
1.7 体外药效学评价
1.7.1 抗炎活性测定
参照文献[10]方法,取培养2-3天、处于对数生长期、生长状态良好的RAW264.7细胞,经1xPBS清洗两次,每次3 mL,用刮刀刮取细胞,并用细胞培养液吹打混匀,于细胞计数板上计数,加培养液稀释至浓度为5×104个·mL-1,接种于96孔板中,每孔100 μL,继续培养12 h。精密称取车前草不同药用部位浸膏适量,加适量DMSO助溶,加培养液配制成不同浓度含药培养液(给药组浓度分别为0.04、0.06、0.08、0.1 g·mL-1生药量),弃掉旧培养液,添加不同浓度含药培养液,再添加100 μL LPS(终浓度为1μg·mL-1),混匀,继续培养24 h;取出96孔板,每孔吸取100 μL上清液转移至新96孔板中,加入等体积Griess试剂,反应10 min,酶标仪测定540 nm处吸光值。将旧96孔板中剩余培养液弃掉,每孔加100 μL MTT溶液(0.05μg·mL-1),置于37℃培养箱中培养1 h,小心吸去MTT溶液,每孔加入200 μL DMSO溶液,37℃恒温摇床振荡15 min,酶标仪测定550 nm处吸光值。以细胞活力>50%,NO抑制率≥50%,作为样品具有抗炎活性的筛选指标。
细胞活力(%)=样品OD550/对照OD550×100
NO抑制率(%)=对照OD540-样品OD540/对照OD540×100%
1.7.2 抗肿瘤活性测定
取培养2-3天、处于对数生长期、生长状态良好的肝癌细胞HepG2,经1xPBS清洗两次,每次3 mL,用1 mL胰蛋白酶(浓度为0.25%)消化,待细胞趋于变圆用培养液终止消化,并冲洗吹打细胞制成细胞悬液。于细胞计数板上计数,加培养液稀释至浓度为5×104个·mL-1,接种于96孔培养板,每孔100 μL,继续培养约12 h待细胞贴壁完全。精密称取车前草不同药用部位浸膏适量,加适量DMSO助溶,加培养液配制成不同浓度含药培养液(给药组浓度分别为0.02、0.04、0.06、0.08、0.1 g·mL-1生药量)。设加药试验孔、空白对照孔(加细胞,但不加药物),每组设5个复孔。继续培养,药物作用一定时间后,每孔避光加20 μL(5 mg·mL-1)MTT,继续于37℃培养箱中培养4 h后吸净孔内上清液,每孔加入150 μLDMSO,摇床振摇10 min,用酶标仪在492 nm处扫描,测定吸光值。
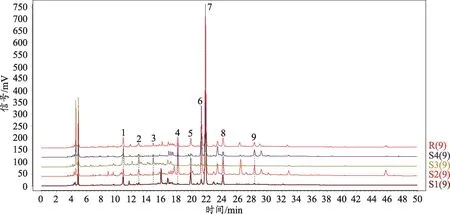
图1 车前不同药用部位指纹图谱叠加图
细胞抑制率=(1-A给药组/A空白组)×100%
1.7.3 抗氧化活性测定
(1)DPPH自由基清除能力
配置浓度为0.5 mmol·L-1的DPPH工作液。精密称取车前不同药用部位浸膏适量,加95%乙醇配制成生药浓度为10.0、8.0、6.0、4.0、2.0 mg·mL-1供试品溶液,取不同浓度供试品溶液和DPPH工作液各100 μL于96孔板中,每个浓度各取3个复孔,空白对照加95%乙醇。避光反应30 min后于酶标仪中选取517 nm波长测定吸光度A。以抗坏血酸作为阳性对照,清除率按如下公式计算:
清除率=(A0-A样)/A0×100%。A0为空白溶液,A样为样品溶液。
(2)ABTS自由基清除能力
配置浓度为 7.4 mmol·L-1的ABTS和2.6 mmol·L-1的K2S2O8。取适量ABTS和K2S2O8混匀,置于暗处室温条件下静置12-16 h得ABTS工作液。使用前用PBS稀释至吸光度值为0.7±0.02。精密称取车前不同药用部位浸膏适量,加95%乙醇配制成生药浓度为10.0、8.0、6.0、4.0、2.0 mg·mL-1供试品溶液。吸取ABTS工作液100 μL,供试品溶液50 μL,充分混匀,避光放置6 min,于734 nm波长下检测吸光度A,空白加95%乙醇。以抗坏血酸作为阳性对照,按1.7.3.1项下公式计算清除率。
1.8 统计学处理
采用SPSS17.0软件进行实验数据的统计分析,所得各组数据均采用(s)表示。多组数据组间的比较采用单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果与分析
2.1 车前不同药用部位指纹图谱及共有峰的建立
取车前不同药用部位样品,按“2.1.2项”下方法制备各供试品溶液,按“2.1.1项”下色谱条件进样,进行HPLC测定与分析,记录色谱图,应用《中药色谱指纹图谱相似度评价系统2004A版》(国家药典委员会)软件,将实验结果导入软件,设置S2为参照图谱,系统生成对照图谱R,进行相似度评价(图1)。得到车前草不同药用部位共有峰9个,保留时间分别为10.895,12.952,14.878,18.149,19.787,21.281,21.832,24.165,28.122 min。
2.2 共有峰指认及相似度评价
采用车前指纹图谱的色谱条件,根据保留时间并结合紫外吸收光谱全波长扫描等方法,通过与大量的对照品进行色谱比对,确定了车前草指纹图谱中9个共有峰中3个峰的归属:6号峰为芦丁,7号峰为毛蕊花糖苷,8号峰为二氢槲皮素。分别对车前根、叶、子、剩余部位的指纹图谱进行相似度计算。结果见表1,除车前子外,车前根、叶、剩余部位的相似度较高,都大于0.93。由于车前子三个已知成分含量远远少于其他各部位,且其他峰信息量也较少,因此车前子相似度对于其他入药部位有所差别;同时叶的峰信息量和其丰度都比其他各部位大,其相似度与根和子也有差别,说明车前药材各部位在具有一定的相似度的同时也存在部分差异。
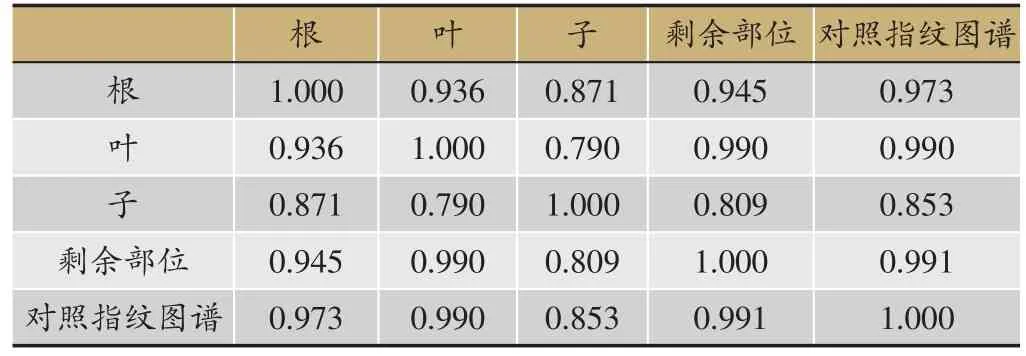
表1 车前草不同药用部位指纹图谱相似度评价结果
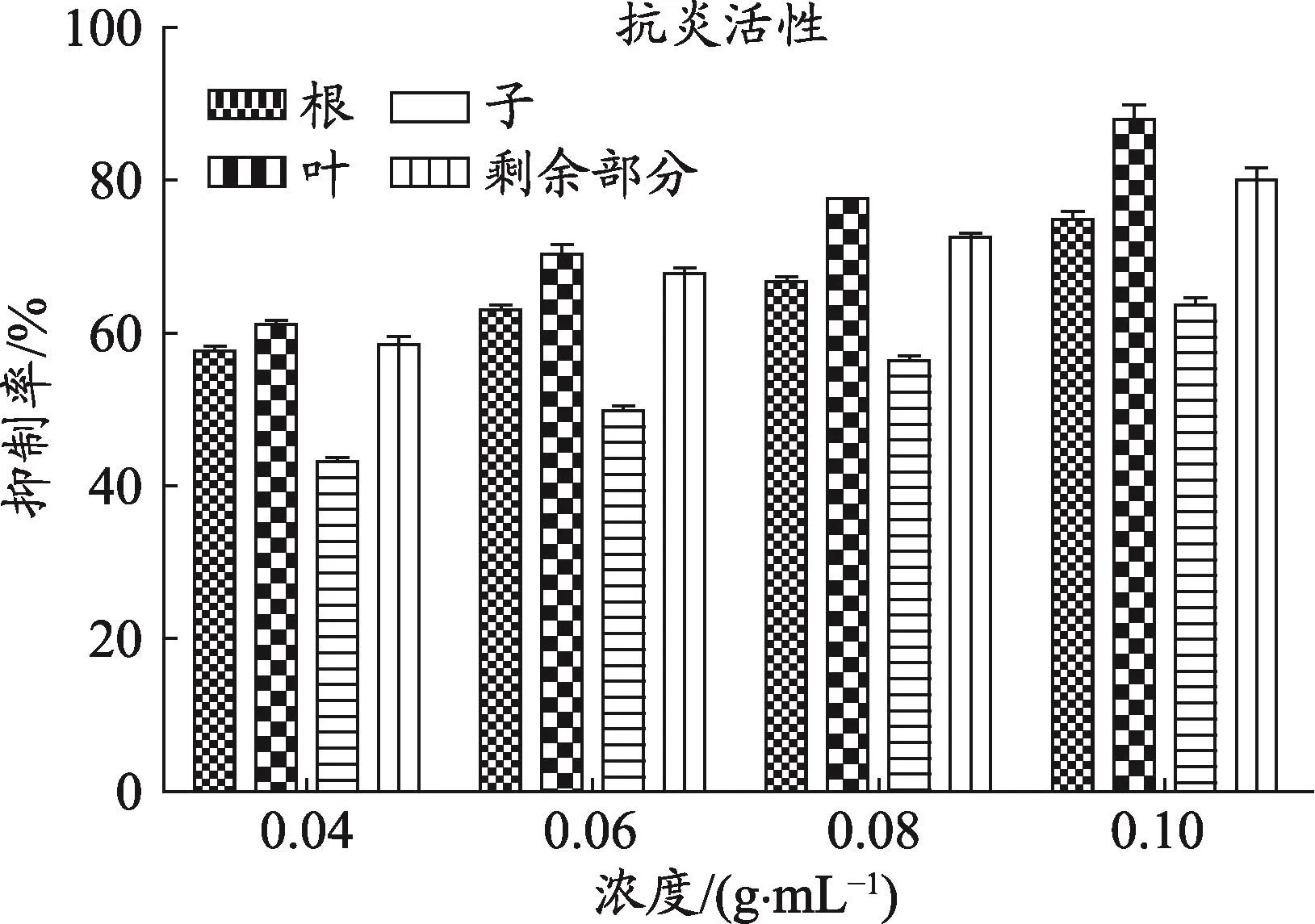
图2 车前草不同药用部位NO抑制率
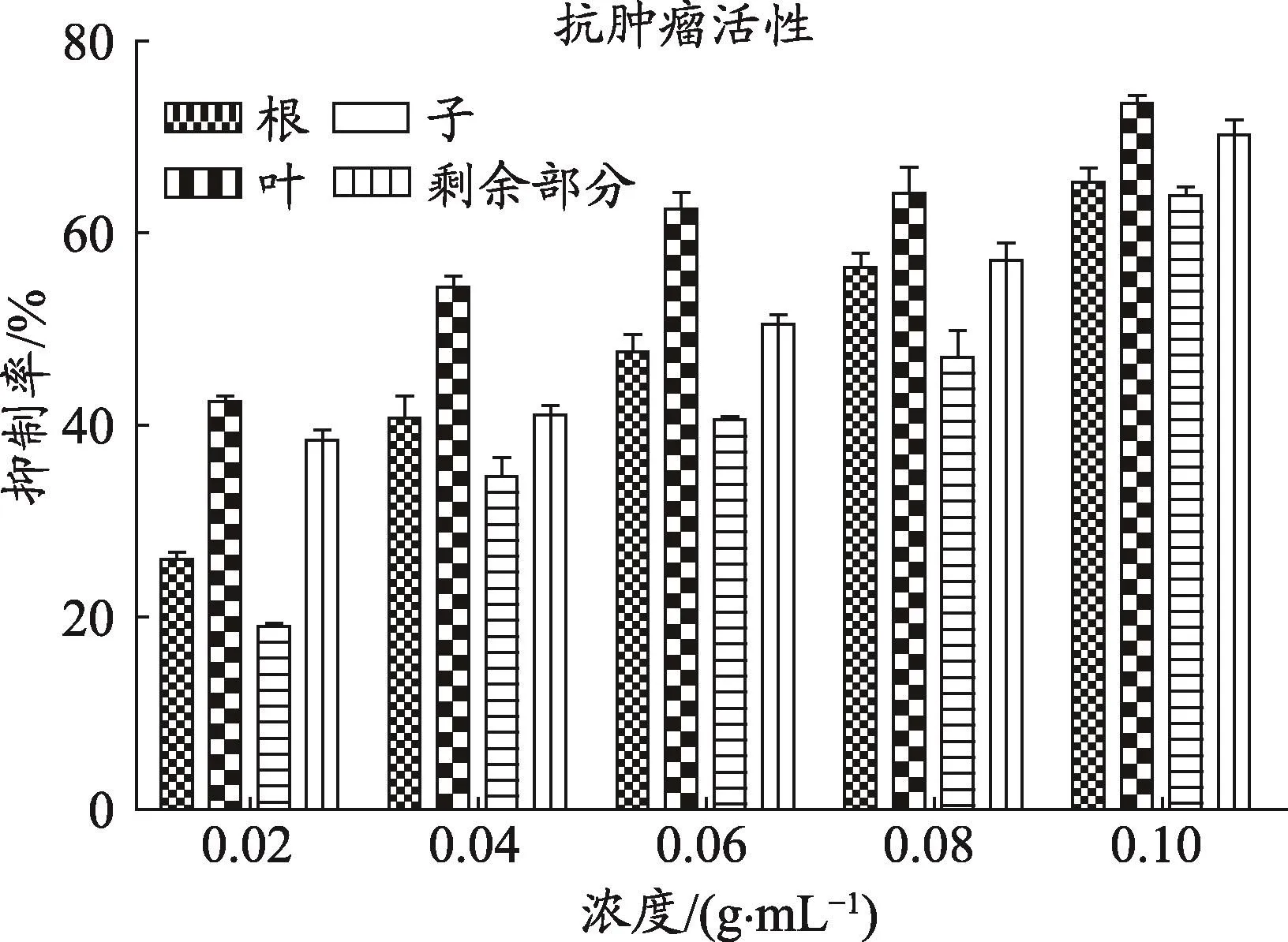
图3 车前草不同药用部位对肿瘤细胞抑制率
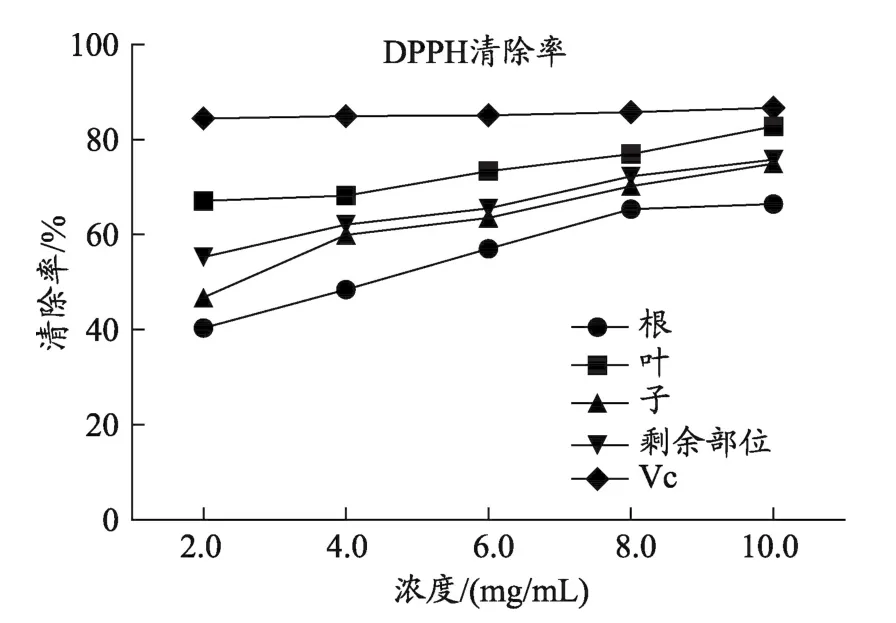
图4 车前草不同药用部位与Vc对DPPH自由基清除作用
2.3 抗炎活性
通过构建LPS诱导的RAW264.7细胞炎症模型,Griess试剂法测定细胞培养液中NO释放量,能直观反映炎症的发生,因此以评价NO分子的分泌量来筛选抗炎药物是一种普遍运用且简单可行的方法[11]。本研究结果显示,与正常对照相比,车前草不同药用部位在选定的浓度范围内(0.04-0.1 g·mL-1)对Raw 264.7细胞活力无显著影响,说明药物在选定的浓度范围内无细胞毒作用。NO抑制率随药物浓度的增加而增大,说明车前草不同药用部位均有较好的抗炎作用,其中车前叶的抗炎作用最强,其次为车前草剩余部位和车前根,车前子抗炎作用相对较弱(与空白组抑制率为零相比,各药用部位P均<0.05)(图2)。
2.4 抗肿瘤活性
车前草不同药用部位对HepG2肝肿瘤细胞均具有显著抑制作用,且随着给药浓度的增加,抗肿瘤作用增强。其中车前叶的抗肿瘤作用最强,其次为车前草剩余部位和车前根,车前子的抗肿瘤作用最弱。(与空白组抑制率为零相比,各药用部位P均<0.05)(图3)。
2.5 抗氧化活性
DPPH是一种稳定的自由基,当还原剂存在时,可显著清除其自由基,因此广泛用于评价天然的抗氧化活性[12]。ABTS+是一种含氮自由基,在结构中N原子上含有一对孤对电子,孤对电子与抗氧化剂结合使ABTS溶液颜色发生变化,如果所需要抗氧化剂的浓度越小,表明其清除能力越强[13]。阳性Vc对DPPH•自由基有清除作用,清除率与质量浓度存在一定的量效关系,呈一定线性,可见本方法是可靠的(图4)。车前不同部位醇提物在试验质量浓度范围内,均具有较强的DPPH清除能力,随质量浓度增加,清除率上升,清除率与质量浓度存在一定的量效关系。其中车前叶的清除DPPH能力最强,其次分别为车前草剩余部位、车前子,车前根抗氧化能力较弱(与Vc相比,各不同药用部位P<0.05)。同样的结果可见ABTS+自由基清除能力(图5)。
3 讨论
车前草有广泛的临床用途、药源丰富、廉价易得、具有很大的开发价值,逐渐引起国内外学者的重视。药典规定车前用药部位为车前科植物车前或平车前干燥全草或其干燥成熟种子,针对不同的疾病,合理应用不同的药用部位,增强中药临床疗效,精准用药,是现代中药研究的内容之一[14,15]。
本研究以车前根、叶、子以及车前草剩余部位为研究对象,采用指纹图谱技术从宏观角度对其整体信息进行了整合,建立了车前药材4个不同药用部位醇提物的指纹图谱,结果发现车前不同药用部位醇提物化学成分之间既有相关性,又有区别,各共有色谱峰的相对峰数量及面积有一定差异,即化学成分种类及含量均有差异。
对车前药材的不同药用部位进行了体外抗炎、抗肿瘤和抗氧化活性研究,药效学数据显示,在相同的作用时间以及药物浓度下,车前草的四个药用部位均有较好的药理活性,其中车前叶的抗炎、抗肿瘤及抗氧化活性均最高,表明车前叶具有很好的药理活性。车前草剩余部位和车前叶具有相似的成分及药理药效活性,但药效活性较车前叶低。车前根与车前子相比,车前子的抗炎和抗肿瘤活性较弱,但其抗氧化活性大于车前根。因此,车前草除有利尿缓泻作用外,其抗炎、抗肿瘤、抗氧化也有较好的药理活性。对于车前草不同药用部位药效活性差异以及具体发挥作用的成分及其作用机制还需进一步研究。
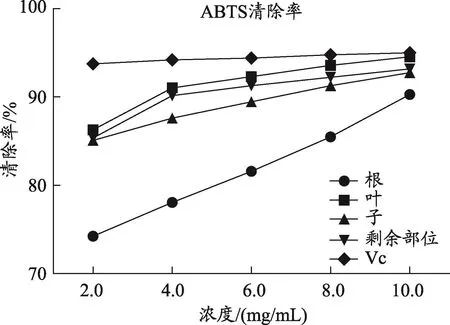
图5 车前草不同药用部位与Vc对ABTS自由基清除作用
本研究为进一步扩大车前药材的临床用药,不同药用部位的药效物质基础深入研究提供一定的数据依据,为中药材不同药用部位的合理使用提供研究方法,对车前的开发和应用以及车前药用部位资源的扩展及其进一步的开发应用具有重要的参考作用。
