1,25-(OH)2D3 对阿霉素肾病模型大鼠足细胞损伤及podocin表达缺失的影响
2019-07-04赵丹陈亚茹于曼丽马国英杨晓萍罗星
赵丹 陈亚茹 于曼丽 马国英 杨晓萍 罗星
(石河子大学医学院 1第一附属医院肾病科,新疆 石河子 832002;2生化教研室)
近年来,慢性肾脏病(CKD)发病率呈逐年上升趋势。肾脏作为人体重要的新陈代谢器官,其病理结构是导致肾脏功能逐渐丧失的因素,目前的治疗方法不足以避免这种疾病的发展〔1〕。研究表明,维生素D3缺乏可提高罹患肾病的风险,避免维生素D3缺乏和补充维生素 D3可能是一种既经济又安全的降低CKD 发病率,并提高其预后的方式〔2〕。维生素D是强效类固醇激素骨化三醇的前体,活化的维生素D3在促进钙磷吸收、防止血管钙化、维持宿主对病原体的防御等方面发挥重要作用〔3〕。维生素D受体(VDR)是核受体超家族成员,细胞膜上的VDR磷酸化后与视黄体受体(RXR)结合形成异二聚体,在细胞核内调节维生素D的活性并与维生素D元素(VDREs)结合,在目标基因区域里调节基因表达〔4〕。肾脏足细胞是活性维生素D3〔1,25-(OH)2D〕发挥作用的重要靶器官,在维持肾小球滤过膜的通透性方面发挥关键作用〔5〕。研究发现podocin为足细胞重要的标记物,是肾小球足细胞信号传递的重要分子蛋白〔6〕。足细胞裂孔膜蛋白(Nephrin)是足细胞主要的裂孔隔膜标记分子,其基因突变是导致肾小球裂孔隔膜蛋白表达异常从而产生蛋白尿的重要原因〔7〕。而关于podocin的研究相对较少,它在CKD中的作用及机制仍不明确。本次研究拟探讨1,25-(OH)2D3对阿霉素(ADR)肾病模型大鼠的治疗效果及对足细胞podocin定位、表达的影响。
1 材料与方法
1.1材料
1.1.1实验动物 90只体重180~220 g的SPF级雄性成熟 Sprague Dawley(SD)大鼠,由新疆医科大学动物中心提供。动物安置在石河子大学动物养殖中心,并维持1 w适应性喂养。
1.1.2主要药物和试剂 注射用盐酸ADR(深圳万乐药业有限公司);骨化三醇(上海罗氏制药有限公司);兔单抗 podocin (美国 abcam 公司);山羊抗兔二抗、PV-9000 通用型二步法检测试剂盒(北京中杉金桥有限责任公司);二氨基联苯胺(DAB)显色试剂盒 AR1022 (丹麦 DAKO 公司)。
1.2方法
1.2.1ADR肾病模型的建立 随机选择60只SD大鼠,单次尾静脉注射ADR(剂量为7.5 mg /kg)建立ADR肾病模型,注射2 w后测 24 h 尿蛋白定量,24 h 尿蛋白定量>30 mg提示ADR肾病模型建造成功。对照组予单次尾静脉注射等量的生理盐水。
1.2.2给药 ADR肾病模型建立成功后被随机分为ADR组、1,25-(OH)2D3治疗(治疗)组,每组30只。治疗组每日给予0.25 μg/kg 的 1,25-(OH)2D3灌胃,对照组与ADR组给予等量的花生油灌胃。于治疗第2、4、6、8、10周,各组分批次处死 6 只大鼠,处死前,代谢笼收集 24 h 尿量,肾脏组织剥离,-80°C 保存或4%多聚甲醛固定。
1.3相关检查
1.3.1一般状况 ①观察各组大鼠休息、活动、饮食、排泄等生活习性的变化;② 24 h 尿蛋白定量:各大鼠独立喂养于代谢笼中,收集 24 h 尿液,检测尿蛋白含量。
1.3.2大鼠肾脏病理观察 10%水合氯醛麻醉大鼠,行肾被膜快速剥离术,固定在10%的甲醛中,并嵌入石蜡,苏木素-伊红(HE)染色,光学显微镜观察,供肾组织病理学检测。
1.3.3免疫组织化学检测和半定量分析 固定的肾组织石蜡包埋,0.4 μm石蜡切片,脱蜡至水,枸橼酸缓冲液(pH6.0) 200 ml 高压抗原修复,冷却,3% 过氧化氢(H2O2)封闭10 min,磷酸盐缓冲液(PBS)洗 5 min、3 次,滴加抗podocin单克隆抗体(1∶500);4℃孵育过夜;次日早晨复温、浸洗,滴加反应增强液,PBS 洗 5 min、3次,滴加适量的增强酶标羊抗小鼠/兔 IgG 聚合物,DAB 显色、复染、中性树脂封片,光学显微镜观察 podocin 定位。每张切片中,随机选取5个肾小球视野,Image-pro Plus6.0处理,计算阳性积分吸光度,半定量分析蛋白表达。
1.3.4肾足细胞超微结构的观察 1 mm3的肾皮质组织先后固定在2.5%戊二醛和1%的锇酸中,然后过分级乙醇,环氧丙烷脱水,通过标准程序嵌入 Epon812,超薄切片被醋酸铀着色10 min,然后雷诺铅柠檬酸盐染色处理2 min,封片、镜检,观察肾足细胞超微结构。
1.3.5实时荧光定量PCR检测肾组织podocin mRNA水平 Trizol法提取肾皮质总RNA,逆转录成cDNA,实时荧光定量 PCR 检测肾组织 podocin mRNA水平。podocin上游引物 5′-GTGGCTTCTTGTCCTCTCCT-3′,下游引物 5′-TGTGATAGGTGTCCAGGCAG-3′,扩增产物片段为 185 bp;GAPDH 上游引物5′-ACAGCAACAGGGTGGTGGAC-3′,下游引物5′-TTTGAGGGTGCAGCGAACTT-3′,扩增产物片段253 bp。反应条件:50℃ 2 min,95℃ 10 min;95℃ 30 s;60℃ 30 s;共 40 个循环。绘制溶解曲线,最终数据以 2-△△Ct进行分析。
1.3.6Western印迹检测podocin蛋白的表达 取100 mg肾皮质组织,放射免疫沉淀法缓冲液(RIPA)提取总蛋白,二辛可酸(BCA)法测蛋白浓度,平衡浓度后每泳道 50 μg 进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),浓缩胶:83 V,30 min;分离胶:110 V,100 min;转膜:23 V,60 min;转膜完成后5%脱脂奶粉室温封闭2 h。podocin 兔单克隆抗体(1∶2 000)4℃摇床孵育过夜,次日晨TBST洗一抗,山羊抗兔(1∶5 000)室温 50 r/min孵育2 h,洗二抗后,电化学发光(ECL)试剂暗室曝光,Image Lab 系统处理图像。
1.4统计学处理 采用SPSS20.0软件。计量资料多组比较采用方差分析,组间两两比较采用 LSD-t检验。
2 结 果
2.1一般状况和24 h 尿蛋白定量 对照组大鼠状态佳,活泼好动,机灵灵敏,有较高的应激反应,毛色致密有光泽;ADR组大鼠出现精神、神经系统的改变:疲乏、怠倦少动、对外界刺激反应性较低,喜蜷卧,多饮、多尿,毛色无光泽,较散乱。与对照组比较,ADR组24 h尿蛋白定量明显增高,1,25-(OH)2D3治疗能降低蛋白尿(P<0.05),见表1。

表1 各组不同时间点 24 h 尿蛋白定量比较
与对照组比较:1)P<0.05;与ADR组比较:2)P<0.05;下表同
2.21,25-(OH)2D3对肾足细胞超微结构的影响 对照组足细胞结构完好,胞核形态良好,足突沿胞体指杵状向外延伸,相互交错;ADR组足细胞内有脂滴且呈现细胞空腔、细胞核畸形,基底膜呈节段性增厚、足突被压扁且融合;1,25-(OH)2D3治疗后,治疗组畸形细胞核有所修复,基底膜无增厚,足突融合减轻,足细胞数量增加。见图1。

图1 1,25-(OH)2D3对ADR肾病模型大鼠足细胞超微结构影响(醋酸铀染色,×10 000)
2.3肾组织病理学改变 肾脏 HE 染色结果显示:对照组肾小球形态完好,无肾小管结构病理改变。ADR组出现肾组织结构严重异常,第2周末,肾小球出现炎性细胞聚集,基底膜增厚,肾间质纤维化;第10周可见肾小球病理改变加重,纤维样坏死累及整个肾小球。1,25-(OH)2D3治疗后,治疗组肾小球病理损伤减轻,且第10周末肾小球形态较对照组无明显差异。见图2。
2.4免疫组织化学检测podocin的定位和表达 podocin 主要定位于细胞膜,且在毛细血管袢呈连续、线性排布;与对照组相比,各周末ADR组 podocin 阳性表达面积明显降低(P<0.05);1,25-(OH)2D3治疗后,治疗组podocin 的表达时间依赖性明显增强(P<0.05)。见表2,图 3。
2.51,25-(OH)2D3对ADR肾病模型大鼠肾组织podocin mRNA 表达的影响 对照组 podocin mRNA 表达量较高,与对照组相比,ADR组 podocin mRNA 的表达量显著降低(P<0.05);与ADR组相比,随着1,25-(OH)2D3疗程增加,大鼠肾组织 podocin mRNA 的表达有所升高(P<0.05)。见表3。
2.61,25-(OH)2D3对ADR肾病模型大鼠足细胞 podocin 蛋白表达的影响 对照组 podocin 蛋白表达较高,与对照组相比,ADR组podocin表达量显著降低(P<0.05);与ADR组比较,经1,25-(OH)2D3治疗后,治疗组肾小球足细胞 podocin 的表达显著上调,在第10周末,基本恢复至正常水平。见图4,表4。
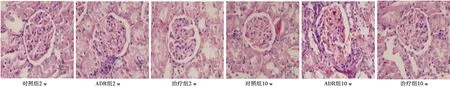
图2 治疗后不同时间点1,25-(OH)2D3 对ADR肾病模型大鼠肾组织病理学影响(HE,×400)

表2 各组治疗后不同时间点肾组织 podocin 蛋白半定量表达的比较

图3 治疗后不同时间点1,25-(OH)2D3对ADR肾病模型大鼠肾组织 podocin 蛋白表达的影响(IHC,×400)

表3 治疗后不同时间点1,25-(OH)2D3 对ADR肾病模型大鼠肾组织 podocin mRNA表达的影响
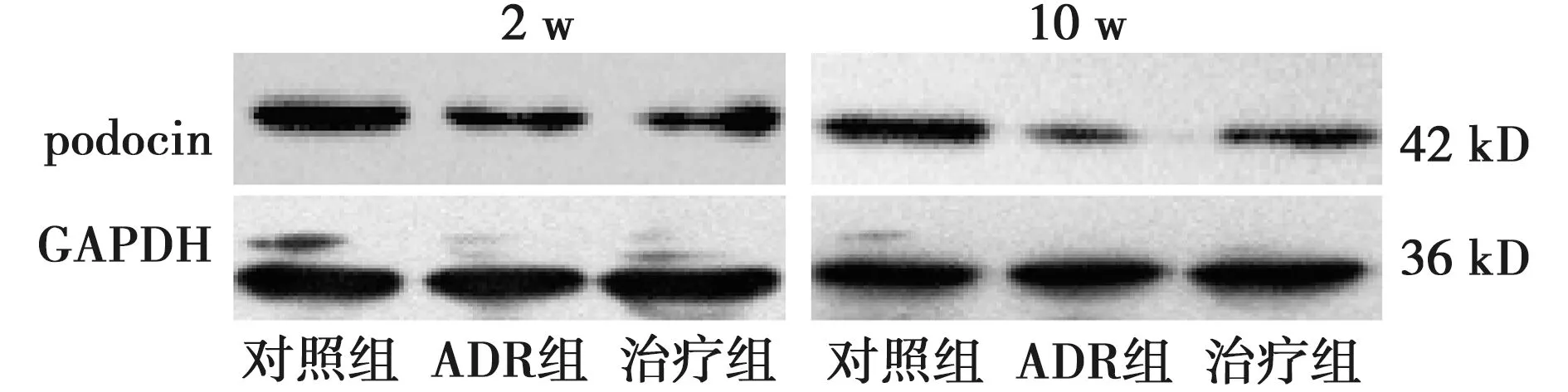
图4 治疗后不同时间点1,25-(OH)2D3 对ADR肾病模型大鼠肾组织 podocin 蛋白表达的影响

表4 治疗后不同时间点1,25-(OH)2D3 对ADR肾病模型大鼠肾组织 podocin 蛋白表达的影响
3 讨 论
CKD最终可进展为终末期肾病,需要长期肾替代治疗或肾移植,已经成为危及人类生命和健康的重要疾病之一。CKD的特征是出现肾单位减少、大量蛋白尿、肾功能损害等,这很大程度上归因于慢性肾小球肾炎、高血压、代谢综合征、糖尿病等危险因素〔8〕。ADR模型是目前模拟人类CKD的较为成熟的实验模型,这种模型的建立简便、成功率高,蛋白稳定(有报道可达 9 个月〔9〕),且药源充足。本实验通过一次性尾静脉注射ADR 7.5 mg/kg,也成功建立了ADR模型。
有活性的维生素 D3 缺乏是CKD蛋白尿的关键原因,早期补充1,25-(OH)2D3具有重要的肾脏保护作用〔10〕。大量蛋白尿与肾脏损伤密切相关,研究发现1,25-(OH)2D3能有效改善肾病理损伤,发挥肾小球保护作用,减少蛋白尿〔11〕。本研究结果提示,肾组织结构的损伤是加速CKD进程的关键,给予1,25-(OH)2D3能有效减缓慢性病程的发展。
围绕着毛细血管和鲍曼囊高度转化的肾小球足细胞,足部间相互交错,形成一个狭窄均匀的动态缝隙网络,维持足细胞结构和功能的稳定性,是肾小球滤过过程的最后环节〔12〕。近年来,关于肾脏的研究主要集中在 nephrin、CD相关蛋白2(CD2AP)、足细胞标志蛋白(WT)-1 等几个重要的分子〔13〕。podocin 是最新发现的足细胞特异性标记分子,在足突膜脂筏中发挥着脚手架的作用〔14〕。除了结构作用外,其在肾小球足细胞启动磷脂酰肌醇 3 激酶/蛋白激酶 B (PI3K/AKT)信号通路〔15〕。已有研究报道nephrin-CD2AP-podocin 复合体的形成,参与 PI3K/AKT 信号分子的传递,抑制足细胞凋亡,促进增殖,保护足细胞,改善蛋白尿〔16〕。本实验结果显示肾脏足细胞损伤是导致大量蛋白尿的关键,为后续临床治疗提供重要的靶标基础。
综上,肾脏损伤,尤其肾脏足细胞的损害,包括结构上足突融合及分子水平podocin 的缺失是导致蛋白尿的关键原因,而1,25-(OH)2D3在一定程度上能够修复肾足细胞的损伤,改善 podocin 蛋白表达的缺失,进而减少蛋白尿,发挥其重要的肾保护作用。而1,25-(OH)2D3通过哪条途径调节 podocin 表达、保护足细胞,有待进一步研究。
