NF-κB信号通路关键蛋白I-κBα的磷酸化与结直肠癌组织发生发展的关联性
2019-07-04陈昱江杨茂李腾仙
陈昱江 杨茂 李腾仙
(贵阳中医学院第一附属医院,贵州 贵阳 550001)
I-κB是核因子(NF)-κB的抑制蛋白,静息状态下,I-κB抑制NF-κB活化,当刺激因子刺激细胞时,I-κB蛋白磷酸化激活NF-κB〔1,2〕。NF-κB是一种可以介导免疫细胞增殖、分化和炎性因子产生的物质,NF-κB通路异常会导致慢性炎症、自身免疫性疾病和肿瘤的生长和转移〔3,4〕。结直肠癌的发生发展与NF-κB通路异常有密切联系。本研究针对I-κB蛋白磷酸化在炎症因子高表达的结直肠癌组织中的作用进行探讨。
1 资料和方法
1.1一般资料 选取2017年1月至2018年1月贵阳中医学院第一附属医院进行结直肠癌治疗的患者30例作为病例组,另选取2017年1月至2018年1月行肠镜活检且结直肠正常的患者30例作为对照组。病例组男21例,女9例,年龄40~70岁,平均年龄(59.33±8.45)岁,体重55~75 kg,平均体重(62.46±7.42)kg;对照组男20例,女10例,年龄40~70岁,平均年龄(58.25±8.74)岁,体重55~75 kg,平均体重(63.48±7.47)kg,病例组取癌组织、癌旁2 cm和距离癌组织10 cm以上的健康组织各1例。纳入标准:病例组经乙状结肠镜、纤维结肠镜检查、活体组织检查确诊为结直肠癌,对照组经乙状结肠镜、纤维结肠镜检查、活体组织检查确诊为结直肠正常。排除标准:有其他肿瘤疾病;患有严重心脏、肝脏、肾脏功能不全;依从性差。患者均签署知情同意书,研究过程符合人体伦理学原则,研究过程通过本院的伦理审查。两组患者基线资料比较,差异不具有统计学意义(P>0.05)。
1.2标本储存 血液标本采集后加入乙二胺四乙酸(EDTA)进行抗凝处理,并离心取上清,放入-80℃(Thermo)储存备用;所有组织标本在取出后立即置入液氮中(-198℃)进行保存。
1.3酶联免疫吸附试验(ELISA) 采用ELISA试剂盒(Sigma,美国)检测两组血清炎症因子白细胞介素(IL)-1、IL-6和肿瘤坏死因子(TNF)-α的表达量。
1.4RT-QPCR 组织RNA的抽提采用OMEGA总RNA试剂盒(R6834-02),并严格按着说明书进行操作。引物序列:IL-1 上游5′ CCACAGACCTTCCAGGAGAATG 3′,下游5′ GTGCAGTTCAGTGATCGTACAGG 3′;IL-6 上游5′AGACAGCCACTCACCTCTTCAG 3′,下游5′ TTCTGCCAGTGCCTCTTTGCTG 3′;TNF-α上游5′ CTCTTCTGCCTGCTGCACTTTG 3′,下游5′ ATGGGCTACAGGCTTGTCACTC 3′。Q-PCR操作过程和反应体系按照TaKaRa SYBR Premix Ex TaqTM(Tli RNaseH Plus),Bulk(RR420L)的说明书进行操作,结果采用2-△△Ct表示。
1.5Western印迹法 抽提组织蛋白后加入TaKaRa 1×结合缓冲液100℃ 3~5 min变性,存入-20℃进行保存,采用碧云天Bradford蛋白定量试剂盒进行蛋白定量后每个孔10 μl样品进行上样,以恒电压120 V进行电泳65 min,后以恒电流400 mA进行湿转70 min。 NF-κB和I-κB一抗和二抗均购于赛信通公司(CST),一抗稀释浓度1∶2 000,二抗稀释浓度1∶1 000,发光液为购买于碧云天的超敏电化学发光(ECL)试剂盒,1∶1等体积混合A、B液,进行化学发光,采用Image J软件进行灰度分析。
1.6统计学方法 采用SPSS22.0软件进行t检验、单因素方差分析、SNK-q检验、Pearson相关分析。
2 结 果
2.1两组血清IL-1、IL-6、TNF-α表达水平比较 病例组血清炎症因子IL-1、IL-6、TNF-α表达水平显著高于对照组(P<0.05),见表1。
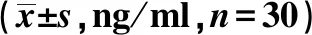
表1 两组血清IL-1、IL-6、TNF-α表达水平比较
2.2不同组织中炎症因子的表达 癌组织中IL-1、IL-6和TNF-α mRNA表达量显著高于癌旁组织和正常组织,且癌旁组织上述指标显著高于正常组织,差异具有统计学意义(P<0.05)。见表2。
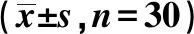
表2 不同组织中炎症因子的表达情况
与癌旁组织比较:1)P<0.001;与正常组织比较:2)P<0.001
2.3不同组织中TLR通路转录因子NF-κB和I-κB的表达 NF-κB和β-actin在癌组织、癌旁组织和正常组织中的表达灰度值相比,差异不具有统计学意义(P>0.05),但正常组织的I-κB蛋白表达量显著高于癌旁组织和癌组织,差异具有统计学意义(P<0.01),见表3。
2.4I-κB与不同组织中炎症因子表达的关联性 病例组中I-κB的表达与组织中炎症因子IL-1(r=-0.551,P=0.031)、IL-6(r=-0.658,P=0.004)和TNF-α(r=-0.947,P=0.000)表达呈显著负相关。
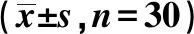
表3 不同组织中NF-κB和I-κB的表达灰度分析
与正常组织比较:1)P<0.001
3 讨 论
结肠直肠癌是消化系统常见的恶性肿瘤,好发于中年以上的男性,以40~70岁最为多见,主要临床表现为排便习惯改变、便血、局部腹痛等症状〔5〕。研究证实,I-κB基因表达缺失和NF-κB持续激活是该病发生的主要原因〔6〕。I-κB是NF-κB信号通路中重要的成员,参与NF-κB的激活与转录〔7〕。在静息状态下,I-κB和NF-κB杂二聚体以结合的形式存在于细胞质中,抑制NF-κB的活化,当各种刺激因子(如氧自由基、病毒蛋白、细胞因子等)级联信号迅速激活I-κB激酶(IKK)复合物,被激活的IKK磷酸化I-κB N端的32、36位丝氨酸,磷酸化(p)-I-κBα21、22位赖氨酸发生泛素化降解并脱离NF-κB,使NF-κB核定位信号区(NLS)暴露,促进NF-κB磷酸化、核转移和进入细胞核,介导特异性基因的转录表达〔8,9〕。此时NF-κB持续激活,介导结直肠癌细胞因子释放。本研究结果说明I-κB基因表达缺失使原本处于静息状态的NF-κB被持续激活,促进了机体免疫应答和炎性因子的产生。研究表明,炎性因子IL-1、IL-6、TNF-α水平上升能进一步促进NF-κB活化〔10〕,炎性因子IL-1、IL-6、TNF-α水平和NF-κB被激活起相互促进作用。随着NF-κB表达的升高,越来越多I-κB表达缺失,所以病例组中I-κB的表达与组织中炎症因子IL-1、IL-6和TNF-α水平在Pearson线性相关结果显示中呈负相关。
本研究结果说明炎性因子的表达水平和所处组织环境有关。研究表明,炎性反应和肿瘤之间存在密切联系,高达20%的肿瘤来源于慢性炎症反应和持续性感染〔11〕。在慢性炎性反应过程中,炎性细胞产生的炎性因子和细胞因子将激活NF-κB信号通路,增强癌前细胞的逃逸能力〔12〕。研究证实,肿瘤的生长依赖于肿瘤血管的生成,而NF-κB在肿瘤血管形成过程中可能也起到关键作用〔13,14〕。一项研究指出,许多血管生成因子,如转化生长因子(TGF)-β、TNF-α、IL-8等均含有NF-κB的特异性结合位点,表达受到NF-κB的调控〔15〕。mRNA携带着遗传信息,在蛋白质合成时充当模板,mRNA在癌组织中表达量最高,说明癌组织炎性因子IL-1、IL-6和TNF-α水平最高,也进一步说明癌组织中NF-κB被激活的数量最大,I-κB表达缺失最多,而正常组织中IL-1、IL-6和TNF-α的mRNA表达量最低,推测I-κB蛋白磷酸化在炎性因子高表达的结直肠癌中起到重要作用,I-κB表达下调是导致结直肠癌发病和炎性反应的主要原因。
目前关于细胞免疫和炎性疾病的发病机制尚不明确,临床用药多以非特异性抗炎药物和细胞毒性药物为主,如糖皮质激素、丙种球蛋白等。长期使用这些药物副作用较大,针对性治疗效果较差,给患者生存质量带来不利影响。本研究结果推测,I-κB表达缺失可能介导了结直肠癌中炎性因子的高表达,靶向调节I-κB具有潜在治疗前景。但靶向调节I-κB能否成为治疗结直肠癌患者炎性反应、抑制肿瘤生长转移的新方法,还有待进一步开展大量临床研究。
