脑梗死患者肠道屏障功能与神经功能缺损程度的相关性
2019-07-04李蒙蒙朱明肃李轩李红闪张唯王佩
李蒙蒙 朱明肃 李轩 李红闪 张唯 王佩
(1保定市第一中心医院神经内三科,河北 保定 071000;2承德医学院)
脑梗死以其高发病率、高致残率、高致死率危害人类的健康。近些年来,随着“肠道菌群-肠-脑轴”〔1〕的提出,使人们认识到脑与肠道之间可相互影响。肠道屏障是机体防御外部环境的基本防线之一,对保障机体内环境稳定有重要作用。肠道屏障功能受损会导致肠道通透性增加。Crapser等〔2〕研究发现,脑梗死小鼠模型肠道通透性增加,且在发病72 h与神经功能缺损严重程度呈正相关。目前脑与肠道之间的研究多为动物试验模型,而临床上关于脑梗死患者肠道屏障功能的研究较少,故该研究旨在探讨脑梗死患者肠道屏障功能是否受损及其与神经功能缺损程度的关系。
1 资料与方法
1.1一般资料 纳入130例在2017年12月1日至2018年7月1日期间就诊于保定市第一中心医院神经内科住院病房的脑梗死患者为脑卒中组。纳入标准:①符合《中国急性缺血性脑卒中诊治指南2014》制定的缺血性脑卒中诊断标准〔3〕;②首次患脑梗死或既往脑梗死病史未遗留明显后遗症者;③发病时间≤72 h;④年龄18~80岁。排除标准:①合并颅内出血或严重头部外伤的脑梗死患者;②合并急性或慢性感染性疾病、恶性肿瘤、严重自身免疫性疾病、严重精神疾病者;③合并心肺功能不全、肝肾功能障碍的患者;④临床资料不完整者。脑卒中组130例,其中男72例,女58例,年龄42~80岁,平均(61.92±9.98)岁。对照组为同期保定市第一中心医院体检健康者52例,其中男32例,女20例,年龄48~78岁,平均(55.31±7.34)岁。两组年龄、性别无统计学差异(均P>0.05)。本研究已通过保定市第一中心医院医学伦理委员会审批,入组研究对象均知情同意。
1.2二胺氧化酶(DAO)、D-乳酸(LAC)检测 对照组空腹时抽取3 ml静脉血,脑卒中组于入院次日清晨抽取3 ml空腹静脉血,应用高速离心机(3 000 r/min,离心半径7 cm)离心10 min。DAO、D-LAC试剂盒均购自上海海联生物科技有限公司(上海),均采用双抗体夹心酶联免疫吸附试验(ELISA)测定血中浓度。
1.3神经功能缺损程度评分表(NIHSS) 此评分系美国国立卫生院神经功能缺损程度评分标准,在 0~3或0~2分间进行评分,认为NIHSS评分越高,神经功能缺损程度越严重。其评测项目包括意识水平、意识水平指令或提问、上肢运动、下肢运动、是否面瘫、构音障碍、视野、凝视、语言、共济失调、感觉、忽视症等诸多方面。
1.4统计学方法 采用SPSS19.0软件进行χ2检验,t检验,Pearson 相关分析。
2 结 果
2.1两组试验指标间的比较 脑卒中组血DAO、D-LAC水平显著高于对照组(P<0.05)。见表1。
2.2脑卒中组DAO、D-LAC与NIHSS评分的相关性 脑卒中组DAO、D-LAC与NIHSS评分呈显著正相关(r=0.311,P=0.000;r=0.224,P=0.010)。
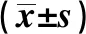
表1 两组组间血DAO、D-LAC指标的比较
3 讨 论
Wang等〔4〕总结肠道与脑之间的双向调剂系统可能涉及的通路有:①脑与肠道之间的神经解剖学通路;②神经内分泌(即下丘脑-垂体-肾上腺)轴通路;③肠道免疫系统(如肠道相关的T细胞亚群);④肠道菌群代谢系统(菌体成分或分泌的诸多活性因子);⑤肠道黏膜屏障和血脑屏障。这就为人们研究肠道与脑之间的联系提供了理论基础。
根据世界卫生组织的报告,脑血管意外是全球第二大死因和第三大致残原因,其中脑梗死占全部脑血管事件的70%~80%〔5〕。与胃肠道并发症相关的脑血管病患者往往效果不佳,可恶化神经功能甚至增加死亡率〔6〕。在临床上,对于脑梗死患者,神经内科医师很少去关注其肠道屏障功能。肠道屏障是机体防御外部环境的基本防线之一,对保障机体内环境稳定有重要作用。血DAO、D-LAC是反映肠道屏障功能的可靠指标〔7〕。DAO属于一种细胞内酶,一般存在于人类和所有哺乳动物肠黏膜上皮细胞的细胞质中,具有高度的生物活性。正常情况下,DAO在血中的含量很少,而当肠道黏膜屏障功能受损时,黏膜上皮细胞释放 DAO 增加,进入肠细胞间隙、血流,DAO大量入血而导致血中浓度增加,可较客观地反映肠道屏障功能〔8〕。D-LAC是肠道固有细菌的代谢产物,肠道屏障受损使肠道通透性增加,导致肠道细菌产生的D-LAC透过受损的肠黏膜屏障大量进入血液循环,循环中D-LAC水平明显升高,同时D-LAC在人体中几乎不被代谢,故是临床工作中检测患者肠道屏障功能的良好指标〔9〕。本研究结果显示脑梗死患者肠道屏障功能受损,肠道通透性增加,且其受损程度与脑梗死患者神经功能缺损评分呈正相关。这与Crapser等〔2〕动物试验研究结果类似。
脑梗死患者肠道屏障功能受损可能与下列因素有关:①脑梗死降低了肠黏膜紧密连接蛋白Occludin表达,进而导致紧密连接的破坏,损伤了肠道屏障,增加了肠道通透性〔10〕。②微小核糖核酸(miRNA)是一类小型非编码核糖核酸,参与机体的各种病理生理过程。mir-21-5p属于miRNA的其中一员,Wu等〔11〕研究发现miR-21-5p在脑梗死患者血清中水平显著升高。已经有研究发现mir-21-5p可通过上调表达鸟苷三磷酸腺苷二磷酸核糖基化因子(ARF)4,导致肠上皮通透性增加〔12〕。③Singh等〔13〕研究发现脑卒中可影响肠道菌群的构成。而肠道菌群失调时,机会致病菌可产生多种有害物质危害机体,如脂多糖。脂多糖是革兰阴性菌的细胞壁成分,又称内毒素,可通过介导Toll样受体(TLR)4/MyD88信号转导途径影响肠上皮紧密连接,上调肠道通透性〔14〕。④缺血性脑组织和活化的小胶质细胞释放损伤相关的分子模式(DAMPs) 和细胞因子,导致内皮细胞活化以表达黏附分子并从循环中募集炎症和免疫细胞至脑卒中损伤部位。同时,DAMPs和细胞因子的释放及迷走神经的激活诱导肠道运动障碍,肠道失调和肠道通透性增加等〔15〕。
Tascilar等〔16〕通过研究大脑中动脉脑梗死模型发现脑梗死后肠道菌群可移位至肠外器官(如肺)。肠道屏障功能受损为肠道微生物移位创造有利条件。肠道是主要的免疫器官,配备有最大的免疫细胞库,占整个免疫系统的70%以上,移位的肠道微生物会刺激肠道相关淋巴组织,刺激免疫细胞亚群分化,促进炎症反应的发生,最后加剧全身炎症反应和多器官功能障碍〔17,18〕的可能。同时,亦可促进免疫细胞从肠道迁移至脑梗死损伤部位,加剧局部损伤。这或许可为脑梗死患者肠道屏障功能受损程度与神经功能缺损程度呈正相关提供线索。
本研究提示脑梗死患者肠道屏障功能障碍。肠道屏障功能受损时肠道通透性增加,可促进菌群移位、毒素入血,加重机体炎症反应等,且肠道屏障功能障碍程度与神经功能缺损程度呈正相关。因此,对于脑梗死患者,神经内科医师在临床工作中积极关注其肠道屏障功能,尤其是重症脑梗死患者。对于脑梗死与肠道屏障功能的联系及与肠道的其他联系知之甚少,仍有待继续深入挖掘。
