外源性CC10基因表达对肝癌细胞增殖、凋亡、迁移和侵袭的影响
2019-07-01张怀波马荣龙张德景
张怀波,马荣龙,张德景
(河南省濮阳市油田总医院 普外三科,河南 濮阳 457001)
原发性肝癌是指发生于肝细胞内或者肝内胆管细胞的癌症,是我国常见的恶性肿瘤之一,病死率居全国恶性肿瘤第二位,其中绝大多数为肝细胞癌。治疗困难,极易复发[1-2]。Clara细胞分泌蛋白10(CC10)又名子宫珠蛋白,由固醇诱导产生,隶属分泌珠蛋白家族,具有多种生理功能,在抗炎和免疫调节等生理活动中发挥重要的作用[3-4]。CC10主要在与外部环境直接相通的人体器官上皮细胞中表达,包括鼻、舌下腺、支气管、肺和乳腺等[3,5-6]。研究表明,CC10是炎症和过敏反应的重要介质,是呼吸系统恶性肿瘤的早期标志物[7]。目前对CC10的研究多集中在乳腺及呼吸系统,在肝癌细胞中尚未见研究报道。细胞周期蛋白D1(Cyclin D1)是细胞周期素家族的关键成员之一,通过调节G1期正向调控细胞周期进展[8]。Cyclin D1的过表达可导致增殖失控,引发细胞癌变。研究发现,Cyclin D1过表达可能是肝癌发生的早期标志,在肿瘤分化中起重要作用,对肝癌的诊断及患者预后有重要的意义[9]。本研究用含CC10基因的重组质粒转染肝癌细胞HepG2,检测外源性CC10对肝癌细胞增殖、凋亡、迁移和侵袭的影响以及对Cyclin D1表达的影响,初步探索CC10对肝癌的作用机制。
1 材料和方法
1.1 材料
人正常肝细胞LO2和肝癌细胞HepG2、Hep3B购自ATCC公司;RPMI1640培养液购自GIBCO公司;胎牛血清购自浙江四季青生物科技有限公司;青霉素、链霉素、总蛋白提取试剂盒、胰蛋白酶购自北京索莱宝科技有限公司;转染试剂LipofectionTM购自InivoGene公司;pcDNA 3.1空载体质粒和反转录试剂盒购自Thermo公司;SYBR Premix Ex TaqTMII购自Takara公司;pcDNA 3.1-CC10质粒由本实验室构建并保存;TRIzol试剂购自Invitrogen公司;引物由北京六合华大基因科技有限公司合成;BCA蛋白浓度测定试剂盒、一步法TUNEL细胞凋亡检测试剂盒和HRP标记山羊抗兔抗体购自碧云天生物技术公司;鼠抗人CC10多抗、GAPDH单抗和HRP标记山羊抗鼠抗体购于Santa Cruz公司;兔抗大鼠Cyclin D1抗体购自北京博奥森生物科技有限公司;CCK-8试剂盒购自日本同仁化学研究所;Transwell小室购自Corning公司;Matrigel基质胶购自美国BD公司。
1.2 细胞培养与转染
细胞培养于RPMI 1640培养液中(10% FBS、100 U/mL青霉素和100 U/mL链霉素),培养箱设置成以下参数:37 ℃、5% CO2。每隔1~2 d传代1次,选对数生长期细胞进行试验。
将对数期、生长状态良好的HepG2细胞,接种于含RPMI 1640培养液的六孔板上(每孔2×105个细胞),于37 ℃、5% CO2条件下培养。待细胞密度为90%左右时,按照LipofectionTM说明书提示的操作步骤分别用4 μg pcDNA3.1空载体质粒(记为pcDNA 3.1组)和4 μg pcDNA 3.1-CC10质粒(记为pcDNA 3.1-CC10组)转染细胞,每个处理设置3个复孔。
1.3 细胞中CC10和Cyclin D1的表达检测
用TRIzol试剂提取人正常肝细胞LO2和肝癌细胞HepG2、Hep3B以及pcDNA 3.1组和pcDNA 3.1-CC10组(转染48 h)细胞总RNA,取1 μg RNA作为模板反转录合成cDNA。以此为模板进行qPCR反应。以GAPDH作为内参基因,分别检测CC10和Cyclin D1的相对表达量。CC10的上游引物序列为5’-GATCAAGACATGAGGGAGGCA-3’,下游引物序列为5’-CACAGTGAGCTTTGGGCTATTT-3’;GAPDH的上游引物序列为5’-CAGCGACACCCACTCCTC-3’,下游引物序列为5’-TGAGGTCCACCACCCTGT-3’;Cyclin D1的上游引物序列为5’-CTGGCCATGAA CTACCTGGA-3’,下游引物序列为5’-GTCACACTT GATCACTCTGG-3’。qPCR反应程序为:95 ℃ 5 min;58 ℃ 30 s,39个循环。扩增结束后,分析溶解曲线,利用2-△△Ct法分析数据。实验重复3次。
1.4 外源性CC10的表达检测
采用Western blotting法。转染48 h后,参照试剂盒说明书步骤提取细胞的总蛋白,并以BCA法对总蛋白定量。将蛋白样品上样至SDS-PAGE凝胶进行蛋白分离后,转膜。取PVDF膜于封闭液中封闭1 h。分别加入1:500倍稀释的CC10多抗、GAPDH单抗和Cyclin D1抗体于4 ℃孵育24 h。经封闭液洗涤后,加入1:5 000倍稀释的二抗于37 ℃孵育1 h。暗室内加入ECL化学发光剂显影后,凝胶成像系统扫描分析。
1.5 细胞活力检测
采用CCK-8法。分别于转染24、48和72 h后,弃培养液,用PBS清洗3次,再加入100 μL无血清RPMI1640培养液和10 μL CCK-8检测液,37 ℃避光孵育2 h,酶标仪检测各孔450 nm处的OD值。
1.6 细胞凋亡情况检测
采用一步法TUNEL细胞凋亡检测试剂盒。转染48 h后,弃培养液,PBS清洗1次、4%多聚甲醛固定1 h、0.1%的Triton X-100冰浴5 min、加入50 μL TUNEL检测液,37 ℃避光1 h,封片后立即在荧光显微镜(×100)下观察。随机选5个视野,对凋亡细胞(发绿色荧光)进行计数,取平均值,计算细胞凋亡率(%)=凋亡细胞数/视野下细胞总数×100%。
1.7 细胞迁移、侵袭能力检测
采用Transwell实验法。将转染48 h后两组细胞制成悬浮液。在Transwell小室的上室中加入300 μL由RPMI1640培养液稀释的细胞悬浮液(约1×105个细胞,0.1% FBS),下室中加入700 μL RPMI1640培养液(20% FBS),每组细胞设3个复孔。置于37 ℃、5% CO2培养箱24 h,用甲醇固定后,0.1%结晶紫于室温下染色20 min,倒置显微镜下随机选取6个视野(×200)对细胞进行计数后取平均值,是为迁移细胞数。
细胞侵袭能力检测需将40 μL稀释过的Matrigel基质胶(基质胶:无血清培养液=1:5)加入Transwell小室内,37 ℃孵育2 h。其余步骤与迁移实验相同。
1.8 统计学分析
2 结果
2.1 CC10在肝癌细胞HepG2、Hep3B中的表达
为了探究CC10在肝癌细胞中的作用,首先通过RT-qPCR检测了其在人正常肝细胞LO2和肝癌细胞HepG2、Hep3B中CC10 mRNA表达水平,结果如图1所示,与正常肝细胞相较,肝癌细胞HepG2、Hep3B中CC10 mRNA的表达量显著降低(P<0.05),且CC10 mRNA在HepG2中表达较低,故选择HepG2进行后续实验。
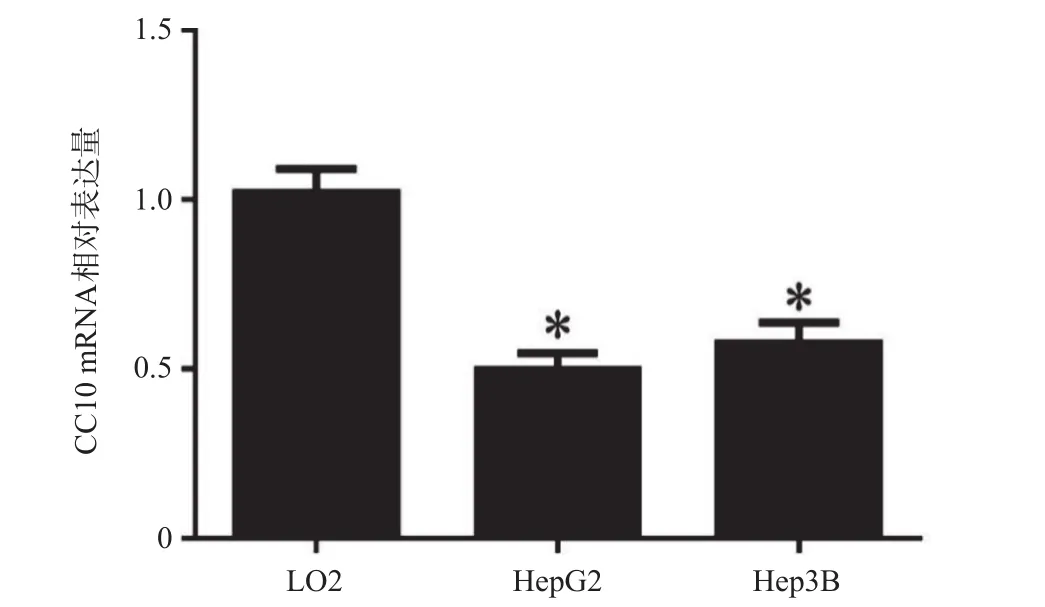
图1 CC10 mRNA在人正常肝细胞LO2和肝癌细胞HepG2、Hep3B中的表达情况
2.2 外源性CC10在HepG2细胞中的表达
为了检测外源CC10在HepG2细胞中的表达水平,转染48 h后,分别用RT-qPCR和Western blotting分析其mRNA和蛋白表达水平。结果显示,转染后,与pcDNA 3.1组相比,CC10表达水平明显升高(P<0.05),Western blotting的实验结果与RT-qPCR的结果一致(P<0.05),见图2。
2.3 外源性CC10对HepG2细胞增殖和凋亡的影响
为了检测外源性CC10对HepG2细胞增殖、凋亡水平的影响,分别用CCK-8法和TUNEL法检测转染后HepG2细胞的活力和凋亡率。结果如图3所示,与pcDNA 3.1组相比,pcDNA 3.1-CC10组细胞活力随着转染时间的增加而降低(P<0.05);转染48 h后,凋亡率明显升高(P<0.05)。这说明外源性CC10抑制HepG2细胞增殖、促进凋亡。
2.4 外源性CC10对HepG2细胞迁移和侵袭的影响
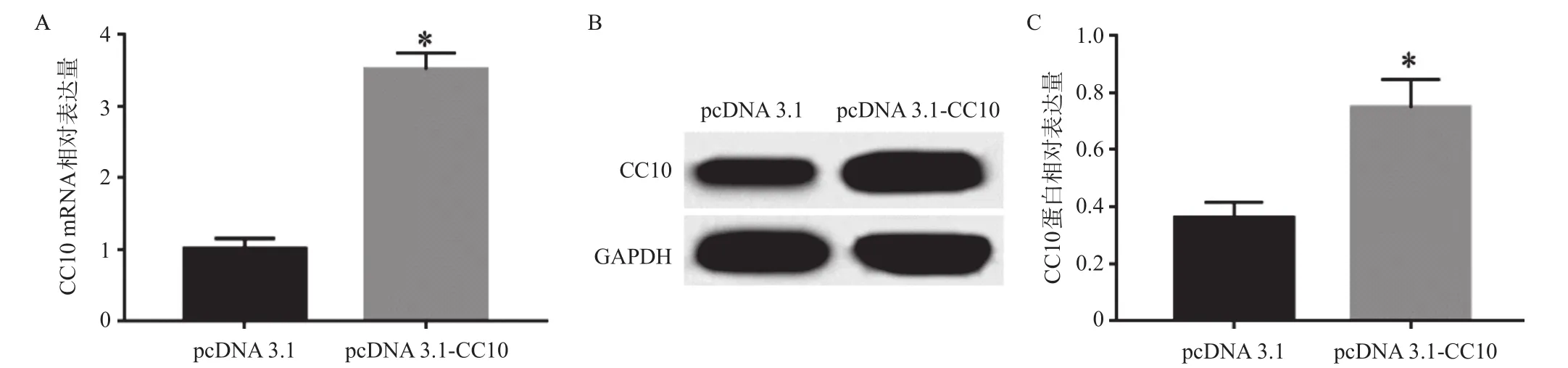
图2 外源性CC10在HepG2细胞中的表达情况
为了检测外源性CC10对HepG2细胞迁移和侵袭能力的影响,分别用Transwell实验检测转染后HepG2细胞迁移和侵袭能力的变化。结果表明,与pcDNA 3.1组相比,pcDNA 3.1-CC10组细胞迁移和侵袭细胞数量均明显降低(P<0.05)。说明外源性CC10抑制HepG2细胞增迁移、侵袭,见图4。
2.5 外源性CC10对HepG2细胞中Cyclin D1表达的影响
为了检测外源CC10对HepG2细胞中Cyclin D1表达水平的影响,pcDNA 3.1-CC10质粒转染HepG2细胞48 h后,分别用RT-qPCR和Western blotting分析Cyclin D1 mRNA和蛋白表达水平。结果显示,转染后,与pcDNA 3.1组相比,Cyclin D1表达水平明显下调(P<0.05),Western blotting的实验结果与RT-qPCR的结果一致(P<0.05),见图5。
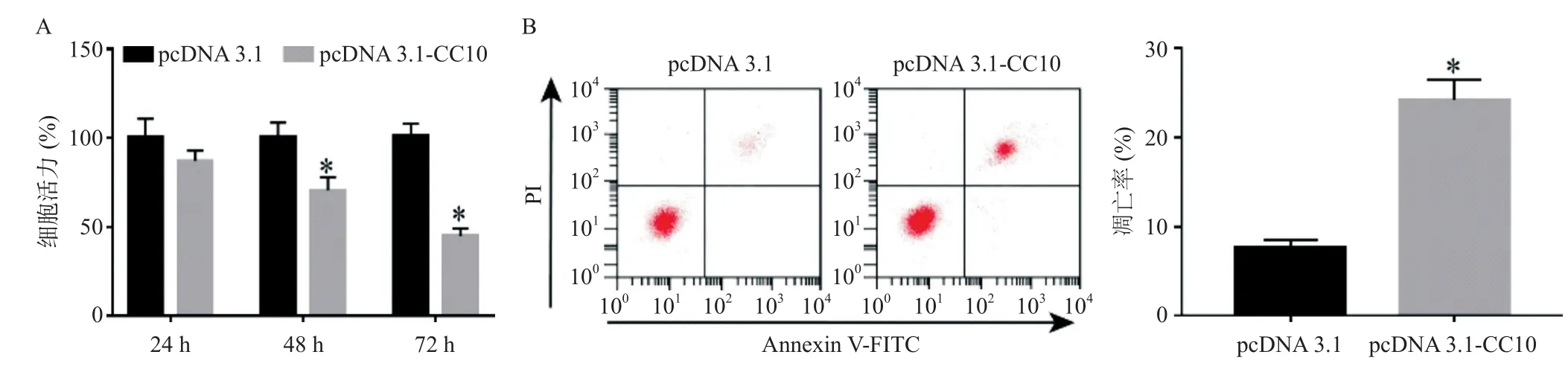
图3 外源性CC10对HepG2细胞增殖、凋亡的影响
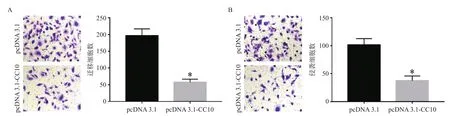
图4 外源性CC10对HepG2细胞迁移和侵袭能力的影响

图5 外源CC10对HepG2细胞中Cyclin D1表达水平的影响
3 讨论
近年来肝癌发病率呈上升趋势,给人民的生命健康和社会经济带来巨大的挑战[10]。我国每年约有38万人死于肝癌,占全球肝癌死亡病例数的51%[11]。肝癌患者预后整体较差,主要的治疗方式有手术治疗、肝移植、非手术治疗(包括肝动脉化疗栓塞、射频消融治疗、放射治疗、基因治疗、中医中药治疗等)[12]。基于基因的分子靶向治疗是目前的研究热点之一[13]。
Clara细胞CC10蛋白是一种能抑制肿瘤、抵御炎症反应、维持人体免疫平衡的分泌蛋白,但其作用机制至今不太明确[14-15]。Weeraratna等[16]研究发现,前列腺癌细胞中CC10表达量较正常上皮细胞低,CC10蛋白的表达量下降可作为前列腺癌的一个诊断指标,并且具有预后价值;CC10蛋白具有抗肿瘤增长的活性。Zhong等[17]利用脂质体将外源CC10转染非小细胞肺癌细胞A549,发现外源CC10表达能阻断G0/G1的细胞周期进程,并抑制A549细胞增殖、诱导细胞凋亡,抑制效应可能与Cyclin D1基因的下调有关。Wei等[18]于大肠杆菌中诱导表达并纯化重组大鼠CC10蛋白,然后用重组蛋白处理大鼠ASMCs细胞,结果证明重组CC10蛋白可抑制PDGF诱导的大鼠气管平滑肌细胞增殖和迁移,推测抑制作用可能与抑制细胞周期蛋白D1表达有关。钟声等[19]证明CC10表达下调与NSCLC细胞的凋亡密切相关。最新的一项研究表明,CC10蛋白可通过抑制Fgl2蛋白的表达缓解小鼠肝炎病毒株3诱导的暴发性肝炎[20]。本研究发现,肝癌细胞HepG2、Hep3B中CC10的表达量较人正常肝细胞LO2显著降低。且外源CC10能抑制肝癌细胞的增殖、迁移和侵袭,促进肝癌细胞凋亡,与前人结果类似。
Cyclin D1属于原癌基因,通过与CDK6或CDK4结合形成复合物在调节细胞周期过程中发挥作用。多种肿瘤细胞中均可检测到该基因的扩增、突变和高表达,且其表达量与患者预后呈显著负相关[21-23]。敖然等[24]发现,Cyclin D1蛋白在人正常癌旁组织中不表达,而在肝癌细胞的细胞质和/或细胞核及肝癌组织中高表达量。Zhao等[25]研究发现,Cyclin D1蛋白在食管鳞状细胞癌组织中的表达量显著高于癌旁组织。此外,Cyclin D1蛋白在宫颈癌组织中的阳性表达率明显高于正常宫颈组织[26]。因此,下调Cyclin D1基因的表达可能是抑制肝癌细胞生长的一种可能的机制。本研究中,外源CC10基因表达使得肝癌细胞HepG2中Cyclin D1 mRNA和蛋白表达水平明显下调。因此,我们推测CC10可通过下调Cyclin D1的表达抑制肝癌的发生发展。
综上所述,外源CC10基因表达对HepG2细胞具有抑制增殖、迁移和侵袭,促进细胞凋亡的作用,其机制可能与下调Cyclin D1蛋白表达有关。
