术前CONUT评分预测HBV相关的HCC患者术后生存率
2019-07-01周超军陈磊蔡斌斌蔡秀鹏林炜航方冠杨文军
周超军,陈磊,蔡斌斌,蔡秀鹏,林炜航,方冠,杨文军
(温州医科大学附属第一医院,浙江 温州 325000,1.肝胆外科,2.结直肠肛门外科)
肝细胞性肝癌(HCC)是最常见的恶性肿瘤之一,是第二大癌症死亡原因[1]。肝癌最常见的危险因素包括乙型肝炎病毒(HBV)、慢性饮酒、黄曲霉毒素等[2]。HCC治疗可分为手术治疗、经皮射频消融、经导管肝动脉化疗栓塞(TACE)等。众所周知,无论肿瘤分期如何,潜在肝病的肝功能损害对预后都有显著影响[3]。因此,仅包括肿瘤解剖特征的系统,如TNM分期,并没有很好的预测能力[4]。随着临床研究的深入,许多用于HCC分类及预后的分期和评分系统被提出,包括Okuda评分、CLIP评分、BCLC分期等。
控制营养状况(CONUT)评分是近年来流行的免疫营养评价得分,评分基于血清白蛋白、总胆固醇和总淋巴细胞计数[5]。考虑到这些参数同时受到与营养无关的其他因素的影响,最近有研究认为CONUT不仅能评估营养状况,还可用于预测术后预后情况[6-7]。因此,本研究分析CONUT评分对接受潜在治愈性切除的HBV相关性HCC患者术后生存率的预测能力,并比较CONUT评分与Okuda评分、CLIP评分、BCLC分期对预后的预测能力差异。
1 资料和方法
1.1 一般资料
收集2007年1月至2013年6月温州医科大学附属第一医院行肝癌根治术的HBV相关性HCC患者428例,符合本研究入组标准的共373例。
纳入标准:(1)HBV相关的肝癌:乙型肝炎-肝硬化-肝癌,HBV-DNA>1 000 cps/mL;(2)术前Child-Pugh分级为A或B级;(3)没有其他可能使手术复杂化的主要疾病;(4)无非肝癌所致死亡;(5)术前排除门静脉主干受累或远处转移;(6)术后病理证实为HCC;(7)术后进行HBV抗病毒治疗。
排除标准:(1)合并丙肝等其他病毒性肝炎;(2)术前肝癌破裂,既往存在上消化道大出血、肝性脑病病史;(3)既往肝癌手术史,化疗史,放疗史,消融治疗史;(4)伴有自身免疫性肝病、酒精性肝病等;(5)伴有全身性疾病不能耐受手术者;(6)临床资料不完善。
1.2 资料收集及分组
通过电子病历系统收集所有患者首次确诊时的各项临床资料及数据,包括患者年龄、性别、身高、体重、饮酒史、乙型肝炎表面抗原(HBs Ag)、血清甲胎蛋白(AFP)、血清白蛋白、总胆红素、γ-谷氨酰转肽酶和天冬氨酸氨基转移酶浓度、血清胆固醇浓度、全血细胞计数、凝血酶原时间、纤维蛋白原、Child-Pugh分级、CONUT评分、组织学肝硬化、腹水、肿瘤大小、肿瘤数量、肿瘤包膜、肿瘤分化程度、微血管侵犯、肝内转移、根据日本肝癌研究小组的TNM分期(I/II/III/IV)、CLIP评分等。在手术前1周内获得血液样本做实验室检查,用于计算CONUT评分。CONUT评分系统分为正常(0~1),轻度(2~4),中度(5~8)和重度(9~12)[5](见表1)。

表1 CONUT评分系统[5]
1.3 随访
出院后,所有患者定期通过门诊检查或电话访问进行随访;术后前3个月每月通过超声检查和肿瘤标志物检测(如AFP)检查所有患者的复发情况,之后每3个月进行肝脏超声、胸部X光检查、肝功能检查、HBV-DNA和AFP检测,每6个月进行一次对比增强CT或MRI检查。当怀疑复发时,进行额外的检查,例如肝脏血管造影。确诊复发后,选择补救治疗措施,如重复肝切除术、射频消融或TACE等。随访截止日期为2018年6月。
1.4 统计学分析
连续和分类变量与相关结果变量的关联分别使用t检验和χ2检验进行评估。通过Kaplan-Meier方法计算存活曲线,并通过对数秩检验进行比较。生成受试者工作特征曲线(ROC)并计算曲线下面积(AUC)以评估不同评分系统的辨别能力。使用Cox比例风险模型进行单因素和多因素分析。为了确定肝切除术后预后因素,将单因素分析中的所有重要变量输入多因素分析。使用IBM SPSS Statistics软件包v.21.0(Chicago,IL,USA)进行统计分析。P<0.05表示差异具有统计学意义。

表2 两组患者基本临床特征比较
2 结果
2.1 患者基本临床资料
本组373例,其中男315例(84.5%),女58例(15.5%),中位数年龄55岁(范围27~79岁)。有嗜酒史151例,无嗜酒史222例。267例(71.6%)肿瘤直径小于5 cm,106例(28.4%)肿瘤直径为≥5 cm。209例(56%)仅有1个结节,164例(44%)有多个结节。在随访期间,178例(47.7%)死亡。中位随访时间为55.7个月(范围1至103.5)。373例患者的1、3和5年总生存期(OS)分别为87.4%、68.6%和52.3%。
373例患者术前的中位CONUT为2。以术前CONUT评分分组标准[8]将373例患者分为高CONUT组(>2,n=157)和低CONUT组(≤2,n=216)。两组患者的一般情况见表2。高、低CONUT组的性别、年龄、BMI、肿瘤大小、肿瘤数量、组织学分化、肝内转移、脉管浸润、肿瘤包膜、TNM分期、AFP分布,差异均无统计学意义(P>0.05),但肝硬化情况有统计学差异(P<0.05)。
2.2 ROC曲线评价CONUT、CLIP评分、Okuda评分和BCLC分期对患者术后OS的预测能力
构建受试者工作特征曲线(ROC),预测患者1、3和5年随访的存活状态,并比较ROC曲线下面积(AUC) (表3,图1),评估每个评分系统的辨别能力。与其他评分相比,CONUT评分在1年OS(0.626)和5年OS(0.646)的AUC值始终较高,3年OS(0.620)的AUC值仅次于CLIP评分。
Kaplan-Meier分析显示,高CONUT组和低CONUT组之间OS的差异(图2)。高CONUT组和低CONUT组患者的5年OS分别为41.4%和60.2%。因此,两组患者具有统计学差异。
2.3 影响患者5年OS的单因素和多因素分析
根据我院实验室检查各指标的正常值参考范围,分别将白蛋白<40 g/L、中性粒细胞计数<1.8×109/L或>6.3×109/L、淋巴细胞计数<1.1×109/L或>3.2×109/L、血小板<125×109/L或>350×109/L、凝血酶原时间<11.8 s或>14.8 s、纤维蛋白原<1 g/L或>4 g/L、AFP≥400 ng/mL、总胆红素>20 μmol/L、AST<15或>42 IU/L、ALT<9或>50 IU/L、BMI<18.5 kg/m2赋值为1,上述指标在正常值参考范围内的赋值为0。
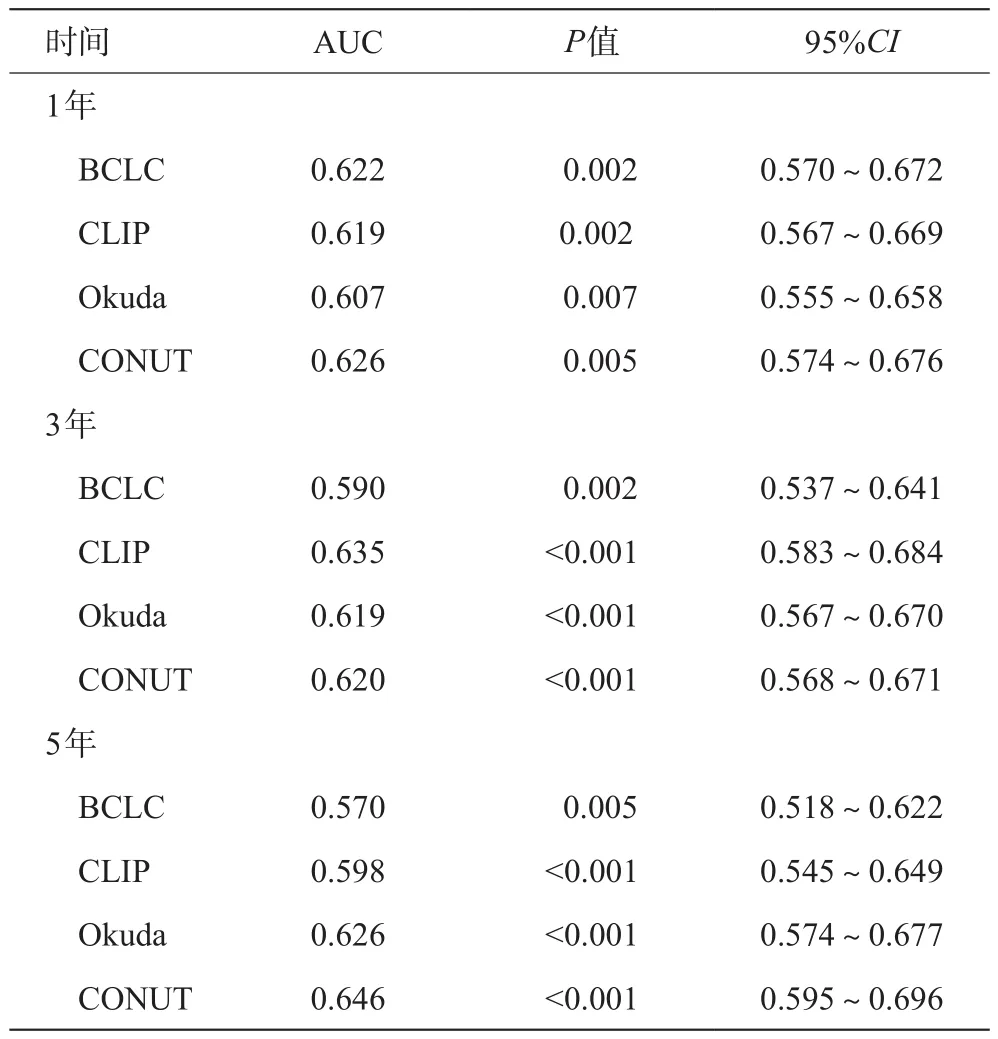
表3 不同评分系统1,3,5年AUC比较

图1 不同评分系统1,3,5年敏感性和特异性比较
术后生存率的单因素分析结果显示,CLIP评分、BCLC分期、Okuda评分、白蛋白、中性粒细胞计数、纤维蛋白原、总血清胆红素、AST、CONUT评分、TNM分期、腹水、肿瘤包膜、分化程度、脉管浸润、肝内转移与术后5年OS相关。CONUT评分包含血清白蛋白,为避免共线性问题,在多因素Cox比例模型中排除了白蛋白。多因素分析显示,CLIP评分、纤维蛋白原<1 g/L或>4 g/L、CONUT>2以及TNM分期仍然是OS的独立预测因子(表4)。
3 讨论
本研究回顾性分析在本机构接受肝癌根治性切除术的373例HBV相关的HCC患者临床资料发现,CONUT>2的患者的总体死亡率显著高于CONUT≤2较低的患者,即高CONUT评分也是OS的一项独立危险因素。
CONUT评分反映了患者的免疫营养状态。据报道,CONUT评分可以独立预测许多恶性肿瘤的预后[9]。但有关CONUT评分预测HBV相关的HCC患者术后生存的研究尚未报道。根据本研究的结果,术前CONUT被认为是HBV相关的HCC患者术后OS的独立危险因素。在与CLIP评分、Okuda评分和BCLC分期预测术后生存的比较中,CONUT评分在1年OS(0.626)和5年OS(0.646)的AUC值始终较高,3年OS(0.620)的AUC值仅次于CLIP评分,表明CONUT具有相对更好的OS预测价值。而在多因素Cox比例模型分析中,上述评分最终只留下CLIP评分和CONUT评分,在风险比(HR)方面,CONUT为1.697,高于CLIP评分的1.400。这可能与以下几方面有关:(1)Okuda分期是以肿瘤大小、有无腹水、血清白蛋白与胆红素水平为分期标准的,但它忽略了肿瘤单发还是多发,有无血管侵犯,肝功能等与预后密切相关的因素,也没有包括患者的基本情况;(2)BCLC分期是西方国家最常用的系统,并得到欧洲肝脏研究协会(EASL)和美国肝病研究学会(AASLD)的认可。BCLC在多项研究中提供了最佳的预后分层,特别是在肝硬化患者和根治术治疗后的患者[10]。然而,在我们的研究中BCLC分期并没有那么有效,可能是因为我们的研究对象属于亚洲人,另外可能跟样本量较少也有关系;(3)CLIP评分包含了肝功能和肿瘤的特点,与其他模型相比,具有较好的预测能力[11]。本研究中近89.5%的患者CLIP评分被归类为0~2,这极大地限制了CLIP评分的分层能力。尽管如此,CLIP在预测中间阶段的患者方面也有所不足,一种解释可能是它缺乏对患者一般健康状态(PS)的评估。有研究显示PS与HCC存活率的相关性[12]。

图2 CONUT评分与患者术后OS的关系
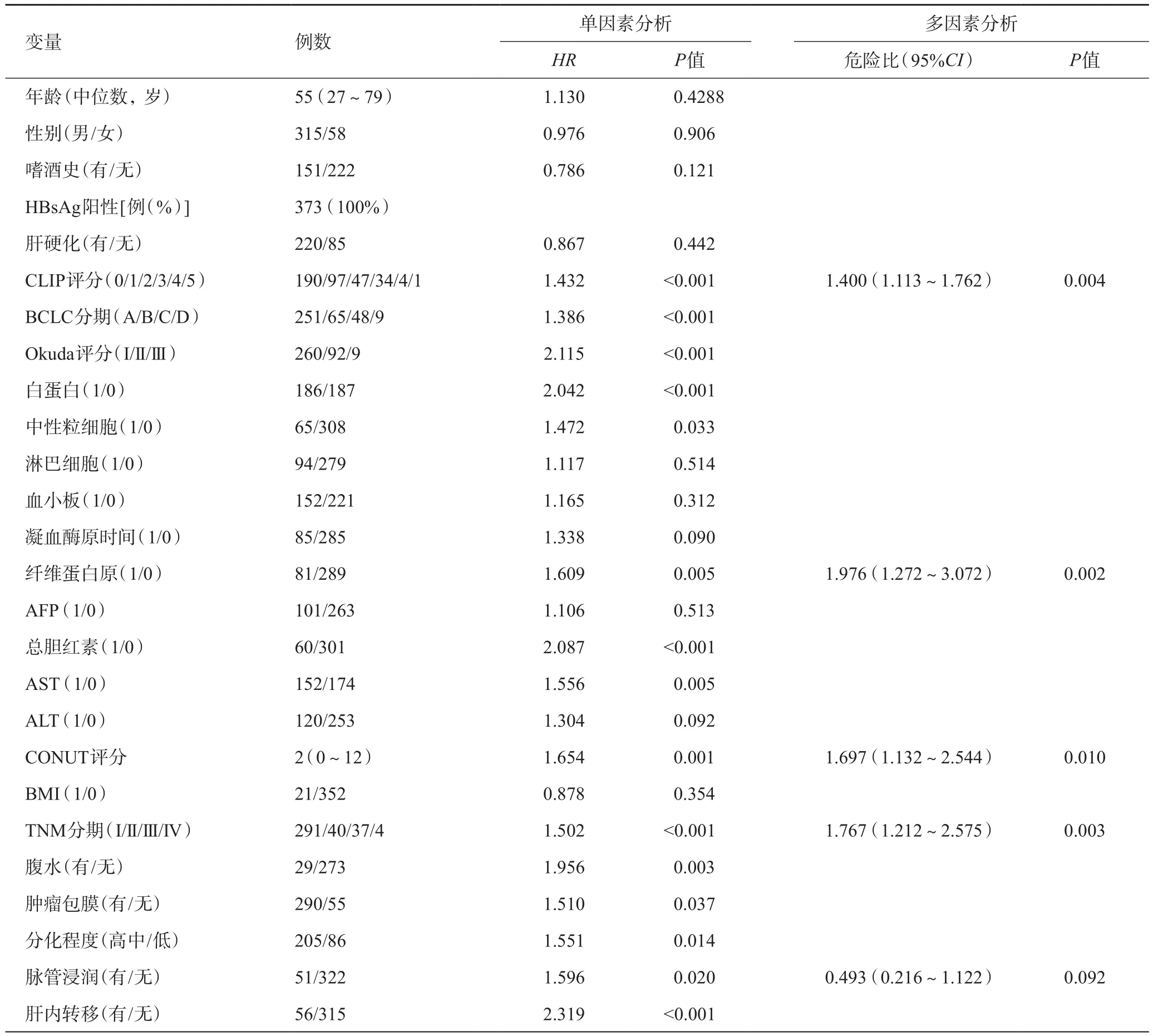
表4 患者术后生存率Cox单因素和多因素分析
CONUT评分标准包含血清白蛋白、总胆固醇和总淋巴细胞计数,这三个参数分别是蛋白质储备,热量消耗和免疫防御的标志物。在本研究中有59%的患者有肝硬化病史,而肝硬化会在一定程度上影响血清白蛋白水平,严重者将导致低蛋白血症和营养不良。据报道,低蛋白血症是HCC患者预后的独立危险因素[13]。同时,营养不良的患者在各种手术情况下发生术后不良事件的风险较高,也是公认的免疫缺陷病因,并通过各种病理生理机制增加术后感染等并发症的风险[14]。此外,据报道,血清胆固醇水平是HCC患者的预后因素[15]。尽管低胆固醇血症与癌症预后差关联的原因尚不清楚,但已有研究提出了几种可能诱导肿瘤增殖、侵袭和迁移的潜在机制的假设[16-17]。众所周知,淋巴细胞计数减少与机体免疫状态下降相关[18],淋巴细胞通过启动细胞毒性免疫反应和抑制癌细胞增殖、侵袭和迁移,在细胞介导的免疫中发挥重要作用,包括防御癌细胞[19]。因此淋巴细胞减少症的患者通过淋巴细胞介导的抗肿瘤细胞免疫反应较差。
另外,本研究存在一些局限性。首先,我们研究对象的样本量相对较少。此外,这项研究是一项单中心的回顾性研究,需要进行大规模的前瞻性验证研究来确认该结果。综上所述,术前CONUT评分被证明是HBV相关性HCC患者预后的独立危险因素。并在与临床常用分期标准(CLIP评分,Okuda评分和BCLC分期)相比较中,CONUT评分显示出了它更好的预测能力。总之,CONUT评分作为一项反映免疫营养状况的术前指标,其优势在于简便易行。关于高CONUT评分的HCC患者,术前可给予有效的干预:(1)血清白蛋白偏低:高蛋白饮食疗法;静脉滴注白蛋白;血浆或冰冻血浆的应用;人血白蛋白的应用。(2)总胆固醇偏低:①病理性:肝功能受损较常见,在适当补充脂肪类及胆固醇类饮食的同时,改善肝功能;②非病理性:例如营养不良、贫血、长期摄入含维生素C的药物等,通过饮食调整升高总胆固醇。③淋巴细胞计数偏低:病因治疗;感染防治;促进淋巴细胞生成;免疫抑制剂),通过降低CONUT,可能有望提高术后总生存期。
