纯囊性胰腺神经内分泌肿瘤八例的CT、MRI影像学特征分析
2019-07-01敖炜群王健杨光钊茅国群
敖炜群 王健 杨光钊 茅国群
浙江省立同德医院放射科,杭州 310012
【提要】 回顾性分析8例经手术病理证实为纯囊性胰腺神经内分泌肿瘤(PC-PNET)患者的CT和MRI的影像特征。8例PC-PNET均为单发病灶,肿块最大径1.2~4.9 cm。3例位于胰头,2例位于胰体,3例位于胰尾。肿瘤形态多为圆形或卵圆形肿块,其边缘光滑,与周围胰腺实质分界清楚,有完整的包膜,偶见分隔及壁结节。增强后肿瘤包膜环形明显或中度强化,壁结节及分隔明显强化,囊变区不强化,可出现“囊中囊”或“咬饼征”等特征性表现。肿瘤对邻近结构无侵犯,多无转移征象。
胰腺神经内分泌肿瘤(pancreaticneuroendocrine tumors,PNET)少见,占胰腺原发肿瘤的1%~2%[1]。PNET多表现为实性,部分可出现囊变。PNET囊性变多呈囊实性肿块[2],而纯囊性胰腺神经内分泌肿瘤(pure cystic pancreatic-neuroendocrine tumors, PC-PNET)罕见。PC-PNET多数无异常激素分泌的临床症状,影像学表现也极易与其他胰腺囊性肿瘤混淆,术前准确诊断较为困难。PC-PNET偶见于个案报道,其CT、MRI影像学特征研究较少。本研究回顾性分析8例经手术病理证实为PC-PNET的CT、MRI征象,以期提高对该病的认识及术前诊断水平。
一、资料与方法
1.一般资料:收集2010年1月至2017年12月间浙江省立同德医院手术治疗并经病理证实的8例PC-PNET患者资料,术前均行增强CT或MRI检查。8例患者中男性4例,女性4例,年龄32~75岁,平均55岁。1例因无诱因中上腹疼痛就诊,1例因反复发作低血糖,服用糖块后好转就诊,余6例均无症状,偶然体检发现。
2.影像学检查:8例患者中CT检查6例,MRI检查4例次,其中2例CT和MRI均检查。
CT采用Siemens Definition AS 128层螺旋CT扫描。扫描前禁食8 h以上,重建层厚1.5 mm。行平扫、动脉期和门脉期三期扫描,增强对比剂为碘比醇(320 mg I/ml)1.5 ml/kg体重,流速3.0 ml/s,辅以20 ml生理盐水冲洗。注入对比剂后于腹腔干水平腹主动脉处自动触发扫描获得动脉期图像,延迟约35 s进行门脉期扫描。
MRI采用SIEMENS 3.0T磁共振扫描仪,使用腹部线圈。扫描层厚5 mm,视野40 cm×40 cm。平扫序列采用T1WI/FS、T2WI/FS及扩散加权成像(DWI)。增强扫描采用对比剂钆喷酸葡胺注射液Gd-DTPA(马根维显)20 ml,流率3.5 ml/s,再注入20 ml生理盐水冲洗。对比剂注射完成后15 s开始扫描,动态增强序列总扫描4~6期。
图像由两名放射科医师(从事腹部影像诊断时间分别为12年和15年)盲法独立阅片,评价肿瘤形态、大小、位置;有无包膜、囊变或坏死;有无胰管扩张(>3 mm);增强后强化形式;肿瘤周围血管有无累及,有无肿大淋巴结或远隔脏器转移。以同期正常胰腺实质作为对照。动脉期肿瘤强化程度分为明显、中度、轻度强化;强化方式分均匀强化、不均匀强化、环形强化。两名医师诊断有分歧时通过讨论达成一致。
3.病理学检查:手术切除标本行病理检查,由病理科医师读片,并按照2016年WHO制定的胃肠胰神经内分泌肿瘤标准[3]将肿瘤分为G1、G2和G3级。
二、结果
1.病理学表现:8例均为单发病灶,肿块最大径1.2~4.9 cm,平均(2.9±1.1)cm。肿瘤位于胰头部3例(37.5%),胰体部2例(25%),胰尾部3例(37.5%)。单发囊性病灶6例,多发囊性病灶2例。镜下见肿瘤仅有囊壁,肿块内部成分为坏死、囊变、液化或出血,囊性比例>90%,大部分肿瘤内可见血供丰富的纤维间隔,2例可见壁结节。G1期6例,G2期2例。无功能性肿瘤5例(62.5%),功能性肿瘤3例(37.5%),其中2例为胰岛素瘤,1例为类癌。
2.CT及MRI表现:CT发现6个病灶,其中平扫低或稍低密度囊性灶5例,稍高密度病灶1例;增强动脉期4例肿瘤边缘明显环形强化(图1A),1例增强后肿瘤前壁线状强化,囊性灶不强化,正常胰腺组织陷入肿瘤内,呈“咬饼征”征象(图1B),1例边缘中度强化,其中1例肿瘤的囊壁、壁结节、纤维间隔均明显强化(图1C);实质期3例仍为环形或分隔样稍高密度,3例为等密度,中央囊变区不强化。MRI发现4个病灶,T1WI序列低信号3例,高信号1例(图1D),T2WI序列均为稍高或高信号,其中1个多发囊性病灶,表现为大囊内包含多个小囊,呈“囊中囊”特征(图1E);增强后动脉期肿瘤的囊壁及分隔明显或中度强化,实质期为等密度或强化程度减低。
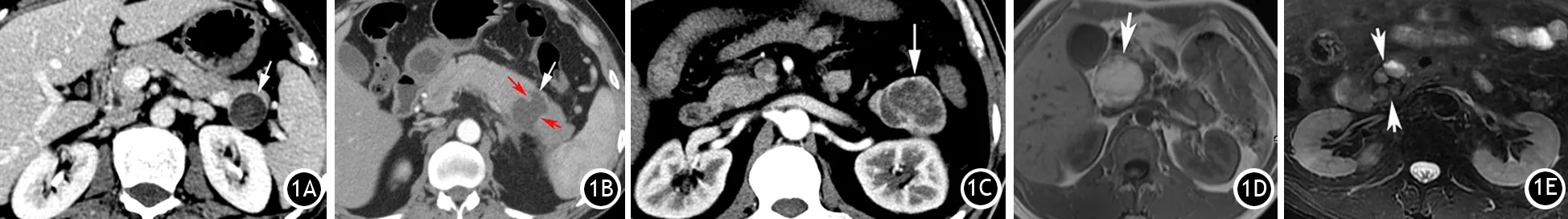
图1 PENTs CT平扫见胰尾部囊性低密度病灶(↑),增强后动脉期病灶边缘明显环形强化(1A)。胰尾部肿瘤前壁线状强化,囊性灶不强化,正常胰腺组织陷入肿瘤内,呈“咬饼征”征象(↑,1B)。胰尾大小约4.9 cm×4.1 cm囊实性肿块(↑),增强后动脉期肿瘤强化不均匀,壁及分隔明显强化(1C)。MRI见胰头部直径约4.5 cm囊性肿块(↑),T1WI为高信号,可见分层信号(1D)。T2WI见胰头部大囊内包含多发小囊状高信号(↑),即“囊中囊”征象(1E)
讨论PNET属于胃肠胰神经内分泌肿瘤之一,具有恶性潜能。近年来随着检查技术的进步和认识水平的提高,PNET发病率和患病率有上升趋势[4]。PNET多表现为实性肿瘤,囊变发生率为10%~20%[5],但肿瘤完全囊变罕见,发病率低于10%。有研究报道,1970-1980年收集的一组PNET病例中PC-PNET约占3%,2005-2011年收集的PNET中PC-PNET约占8%[6]。多数病例为体检偶然发现而无临床症状。PC-PNET好发于中年人,女性稍多见[7]。本组病例男女比例为1∶1。PC-PNET大部分是良性的,但仍有恶性潜能[2],本组6例为G1期肿瘤,2例为G2期肿瘤,与文献报道相仿。
PC-PNET更好发于胰腺体尾部[8]。Yoon等[9]报道19例囊实性PNET,其中14例(73.7%)位于胰体尾部。本组5例(62.5%)肿瘤发生于胰体尾部,与文献类似。PC-PNET多为无功能性高分化肿瘤,肿瘤的Ki67增殖指数低,淋巴结及远隔脏器转移少见[10]。本组5例为无功能性肿瘤,3例为功能性肿瘤。
PC-PNET囊变病理机制存在争议。有报道认为肿瘤在生长过程中内部出现液化、梗死是囊变形成的主因。肿瘤的变性伴随周围纤维包膜形成,阻断了肿瘤血供,导致肿瘤内部缺血和坏死[11]。另有研究[7,12]认为,PNET囊变是由于出血引起,肿瘤内部为存储较好的清亮或草绿色液体,而不是坏死的碎片组织,这可以解释小肿瘤亦可发生囊变的原因。
PC-PNET的影像学表现仅有少量个案报道,结合本组病例及文献复习,总结影像表现如下:(1)肿瘤好发于胰体尾部,形态多为圆形或卵圆形肿块,其边缘光滑,与周围胰腺实质分界清楚,有完整的包膜,偶见分隔及壁结节,囊壁及分隔大多规则,部分病例可呈不规则、厚薄不均匀改变;约13%的PC-PNET可见钙化[13]。Kaosombatwattana等[8]报道1例PC-PNET,可见环形钙化灶于肿瘤囊壁上,然而本组肿瘤均未见钙化。(2)CT平扫肿瘤多为低或稍低密度,囊变区CT值多<30 HU,可见等密度肿瘤包膜、分隔或壁结节;MRI上肿瘤呈长T1、T2信号改变,当病变伴出血时T1WI为高信号,肿瘤包膜为环形等信号或略高信号,增强早期肿瘤包膜多明显或中度环形强化,肿瘤分隔或壁结节明显强化,增强中晚期部分肿瘤包膜、分隔及壁结节可持续强化或强化程度减弱,但仍为高或稍高密度,囊变区无明显强化。有文献报道肿瘤环形强化在动脉期要比实质期更容易观察。Kajiwara等[11]报道1例无功能多发微囊型PC-PNET,肿瘤的微囊囊壁及分隔可见明显强化,镜下分隔多为血供丰富的纤维成分,故强化明显。病理组织学检查可见PC-PNET实质位于环形肿瘤壁上,囊肿内多有纤维间隔成分[11]。Deshpande等[14]报道5例经内镜超声引导下穿刺证实为PC-PNET病例,其中4例为单囊,2例囊壁薄而规则,2例囊壁不规则、厚薄不均匀;1例为多囊病灶,呈“囊中囊”改变。本组病例2例为多囊型肿瘤,影像表现呈“囊中囊”改变,增强后囊壁及分隔较明显强化,与文献报道[11]相仿;6例为单囊表现,肿瘤囊壁中等或明显强化。(3)肿瘤与邻近胰腺实质分界清楚。本组病例观察到“咬饼征”,即正常胰腺实质陷入肿瘤内部囊变区域,提示肿瘤对周围胰腺组织无侵犯,为肿瘤分化好、侵袭性低的特征。肿瘤对周围组织结构、大血管无侵犯,胰管多无扩张,多无转移。
PC-PNET主要依据术后免疫组织化学法确诊。由于囊性比例大,容易与其他胰腺囊性肿瘤,如囊腺瘤、实性假乳头状瘤(SPTP)、胰腺导管内乳头状黏液瘤(IPMN)、假性囊肿等混淆造成误诊。本组8例中2例诊断准确,6例误诊,故PC-PNET需与上述疾病相鉴别。
综上所述,PC-PNET多为分化较好、侵袭性低的一类罕见肿瘤,其影像表现为好发于胰体尾部、边界清楚、形态规则的囊性肿块,病灶包膜完整,偶见分隔、壁结节,增强后肿瘤包膜环形明显或中度强化,壁结节及分隔明显强化,囊变区不强化,肿瘤对邻近结构无侵犯,多无转移征象。肿瘤可出现“囊中囊”或“咬饼征”等特征性表现。
利益冲突所有作者均声明不存在利益冲突
