肿瘤坏死因子α对小鼠心房细胞内钙释放的急性调节作用
2019-07-01左嵩李林凌蒋乐刘念董建增马长生
左嵩 李林凌 蒋乐 刘念 董建增 马长生
炎症与心房颤动(简称房颤)的发生密切相关。炎症可导致房颤患者心房结构重塑及纤维化,但心房结构重塑或心房纤维化显然不是急性炎症相关房颤的潜在机制。既往研究显示促炎性细胞因子能够破坏心室肌细胞中的钙调控稳态[1-2]。Kao等[3]证明促炎性细胞因子肿瘤坏死因子-α(TNF-α)的急性浸润可显著增加心肌细胞内游离钙离子的水平;Duncan等[4]的研究亦显示,TNF-α对心室肌细胞的急性干预显著提升了心肌细胞肌质网钙漏的可能性,并促进了致心律失常触发活动的增加。笔者探讨急性TNF-α干预对心房肌细胞内钙循环的影响及潜在机制。
1 材料与方法
1.1细胞分离与实验试剂 成年雄性C57BL/6小鼠(20~25 g)购自北京首都医科大学动物中心。所有的实验程序都经首都医科大学动物管理委员会批准,并且遵照动物资源研究所编写并由国家卫生研究院出版的“实验动物管理与使用指南”(出版物第23号,1996年修订)。
心房肌细胞的分离采用双酶促消化方案[5]。主要步骤如下:腹腔注射肝素0.5ml(100IU/ml),15~20 min后脱颈处死,迅速取出心脏并经主动脉逆行插入套管并固定,用细胞灌流液冲灌心脏,清除冠状动脉内血液后,改用心肌细胞双酶促消化液循环冲灌约11 min,剪取心房组织后用钝头镊子撕碎,加入少许酶解液,用滴管轻柔地吹打细胞,使细胞分散。加入终止酶解液1,离心(1 000转/分)20 s,弃去上清,用终止酶解液2重悬细胞,并复钙(钙离子终浓度为1mmol/L)。至此心肌细胞准备完毕,为了保证细胞的良好状态,需在6 h之内完成实验。
双酶促消化液主要包括1.0 mg/mL的胶原酶(Ⅱ型;Worthington Biochemical公司,美国),0.05 mg/mL的蛋白酶(XIV型;Sigma公司,美国)以及25 μmol/L CaCl2。细胞灌流液的主要成分如下(mmol/L):NaCl 113、KCl 4.7、KH2PO40.6、Na2HPO40.6、MgSO41.2、NaHCO312、KHCO310、HEPES 10、葡萄糖5、牛磺酸15、2,3-丁二酮单肟(BDM)10,溶液配置后在室温下应用NaOH溶液将pH调整为7.25。正常台式液(NT)的主要成分如下(mmol/L):NaCl 140、KCl 4.0、MgCl21.0、HEPES 10、CaCl22.0、葡萄糖5.0,pH 7.30。终止酶解液1:小牛血清1 ml+100 mmol/L CaCl24 ul+细胞灌流液9 ml;终止酶解液2:小牛血清0.5 ml+100 mmol/L CaCl24 μl+细胞灌流液9.5 ml;TNF-α(Sigma公司,美国)应用时在无菌PBS溶液中制备,将事先配好的浓度为200 μg/ ml的储备溶液取出,并用无菌PBS溶液稀释至0.05 ng/ml以备用。
1.2心房细胞内钙染色及钙释放活动的测量 将新鲜分离的心房细胞溶液中加入5 μmol/L的fluo-4 AM溶液(Thermo Fisher Scientific公司,美国),并置入28℃的暗室中染色20 min。加入细胞重悬液并离心,将染料洗去,并将细胞置于台式液中保存。将完成钙染色的心房细胞分为两组,分别浸润在NT溶液(对照组)及0.05 ng/ml的TNF-α溶液(TNF-α组)中120 min以备用。
细胞内钙离子测量采用文献发表的方案[6]。应用IonOptix的系统(Milton公司,美国)进行单激发波长微荧光测定,记录静息心肌细胞内钙释放、自发性钙波及肌浆网钙容量。激光扫描共聚焦显微镜(型号SP5,Leica Microsystems公司,德国)的线扫描模式(400 Hz)和Leica 60倍油镜则用于记录钙火花的数量与特征等参数,包括钙火花频率(100 μm-1s-1)、幅值(F/F0)、时程(ms),宽度(μm)和达峰时间(ms)。记录时,首先对心肌细胞给予至少20 s、频率1 Hz的场刺激(电脉冲宽度为4.0 ms,场强为40 V)使心肌细胞达到稳定的肌浆网钙容量;然后分别利用Ionoptix系统及激光扫描共聚焦显微镜记录心肌细胞相关钙参数。钙释放是心肌细胞在无咖啡因状态下对1 Hz场刺激的反应;而肌浆网钙容量的测定则是利用咖啡因(10 mmol/L)能够开放肌浆网中所有RyR通道的特性而估测的。自发性钙波为细胞内钙的非刺激性增加,通常在场刺激停止后的5 s内自发性出现。荧光染料在波长488 nm时激发,并在大于510 nm处收集。记录钙火花线扫描图像后,使用Image J软件中的spark master功能对钙火花参数进行分析。
1.3线粒体活性氧簇(ROS)生成测量 心肌细胞内ROS的测定采用MitoSOX Red(Molecular Probes公司,美国)染色法[7]。首先,将1.1中制备完毕的心房肌细胞在室温下用稀释好的MitoSOX Red(5 μmol/ L)溶液浸润15 min。洗去染料后,将完成染色的细胞分为两组,分别浸润在NT溶液(对照组)及0.05 ng/ml的TNF-α溶液(TNF-α组)中120 min以测定心肌细胞内ROS的生成量及变化趋势。共聚焦显微镜将通过488 nm激发及585 nm测量获得共焦图像。每30 min对心房细胞采集图像并记录MitoSOX红色荧光强度。测量时取每个细胞的5个不同区域,测量并计算荧光强度,取均值作为该心房细胞的MitoSOX红色荧光强度。并通过与基线处对照荧光强度的数值获得MitoSOX红色荧光强度(100%)的基线。
1.4数据分析
所有统计分析均使用SPSS(版本17)进行。数据表示为平均值±标准误。使用Student′st检验来确定两组之间的统计学显着性。以P值<0.05为差异有显著性。
2 结果
2.1心房细胞内钙释放的比较 与对照组相比,TNF-α组的心房肌细胞内钙释放幅值显著下降,衰减时间则显著增加,而两组的达峰时间没有差异(图1,表1)。此外,TNF-α组的心房细胞肌浆网钙库容量显著降低[( 8.05±0.59) F/F0 vs (9.45±0.67) F/F0;n=8,P<0.05]。

A为对照组;B为TNF-α组(0.05 ng/ml)
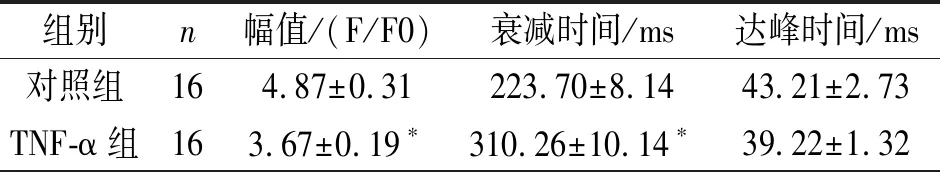
表1 TNF-α (0.05 ng/ml)急性干预2 h对心房肌细胞钙释放的影响
注:与对照组相比,*P<0.05
2.2心房细胞内自发性钙释放活动的比较 TNF-α组心房细胞内钙火花活动显著增强:钙火花发生频率大幅增加,钙火花释放幅值及时程也显著改变,而钙火花宽度和达峰时间虽略有改变,但与对照组相比无统计学差异(图2,表2)。

A为对照组,B为干预组

组别n频率/s-1幅值/(F/F0)时程/ms宽度/μm达峰时间/ms对照组162.60±0.16(191)1.26±0.06(189)27.80±0.93(190)1.42±0.11(187)21.13±1.87(187)TNF-α组164.32±0.19∗(301)1.07±0.26∗(300)32.78±1.32∗(303)1.45±0.10(298)19.18±1.30(300)
注:括号内数据代表钙火花的数量;与对照组相比,*P<0.05
2.3两组ROS比较 与对照组相比,TNF-α组心房细胞内线粒体ROS的产生逐渐增加,在起始的60 min内线粒体ROS产生缓慢,随后迅速升高,120 min时ROS生成量增加至约2.26倍,而对照组在120 min内没有明显增长(图3)。
3 讨论
当前,急性炎症作为房颤发生的重要诱因这一观点已被电生理主流学术界所逐渐接受[6]。动物实验显示,TNF-α能够急性调节动物心室肌细胞、乳鼠心肌细胞或HL-1细胞系中的离子通道功能与钙循环调控; 但这些研究往往采用与临床无关的超高浓度的TNF-α[1-3],其与炎症情况下机体TNF-α血清或组织浓度0.01~0.03 ng/ml水平相差甚远。为了有效地模拟临床环境中的急性炎症,笔者应用0.05 ng/ml的TNF-α对小鼠心房细胞内进行干预,并观察其对钙释放的急性调节作用。结果发现TNF-α的急性干预导致了心房细胞内钙瞬变振幅降低、衰减时间延长及肌浆网钙库容量降低。心房细胞内钙瞬变衰减时程的延长意味着SERCA2a功能的受损,而后者的功能受损常常导致肌浆网钙库容量的降低,从而造成钙瞬变幅值的下降。既往研究显示TNF-α能够调节钙调蛋白的表达。Kao等[3]报道TNF-α可增强SERCA2a启动子区域的甲基化,并降低HL-1细胞系中SERCA2a的表达。Rao等[8]证实TNF-α能够降低HL-1细胞系中T型钙通道α1G亚单位的蛋白表达水平。然而,本研究中TNF-α仅仅急性干预2 h,显然不能引起转录及翻译水平的改变,因此笔者推测转录后修饰很可能是TNF-α造成钙调控紊乱的分子生物学基础。

图3 两组线粒体ROS生成趋势图
触发活动被认为是阵发性及慢性房颤发作的最重要机制之一。本研究清楚地表明在经急性TNF-α处理的小鼠心房细胞中,自发性钙释放事件明显增多,这与Duncan等[4]的研究成果相一致。其研究显示TNF-α(0.05 ng/ml)急性干预3 h能够显著增加心室肌细胞内肌浆网自发性钙漏,并增强其心律失常易感性。同时,心肌舒张期肌浆网自发性钙释放可导致钠-钙交换体的激活,产生瞬时净向内电流,进而诱发舒张期后除极电位,诱发触发性心律失常[9]。TNF-α诱导产生的线粒体ROS与多种心血管疾病的发病机制相关联[10]。在心肌细胞中,线粒体体积占整个细胞体积的比例可高达30%~40%,同时线粒体还是细胞内ROS产生的主要来源[11]。在本研究中,MitoSOX Red被用来测量线粒体ROS的生成量,并且在心房肌细胞中TNF-α急性浸润2 h使线粒体ROS产生增加2倍以上。而多项研究显示线粒体ROS可通过改变钙调蛋白的表达而进一步调节钙调控,造成心肌细胞内的钙紊乱[12]。因此,笔者推测TNF-α诱导的线粒体ROS增多是心房肌细胞内自发性钙释放事件的潜在分子生物学机制。
本研究的不足之处在于我们没有全面评估心肌细胞内各项钙调控蛋白的表达。其次,我们应用咖啡因诱发的钙离子瞬时峰值来估测心房肌细胞内肌浆网钙库容量。尽管该方法在本领域得到了广泛的应用,但与膜片钳技术产生的瞬间内向整合电流相比,其仅仅是一项替代性指标而非肌浆网钙库负载的最准确指标。
