过渡金属离子与牛血红蛋白的相互作用*
2019-06-27聂志颖陈佳璐赵玉玲
聂志颖, 陈佳璐, 冯 洁, 赵玉玲
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.浙江师范大学 “先进催化材料”教育部重点实验室,浙江 金华 321004)
血红蛋白(Hb)由含有亚铁离子和吡咯环的血红素组成[1],在体内主要发挥输氧储氧功能,这些功能与血红素中的亚铁离子(Fe2+)关系密切.血红素依靠范德华力与周围的疏水性氨基酸残基保持空间构象,金属离子既可与血红蛋白残基上的N,O或S结合,又可取代血红素上的Fe2+,引起血红蛋白结构的改变[2].牛血红蛋白(BHb)同源于人血红蛋白,经常被作为模型蛋白使用.研究发现,铬(VI)酸根离子依靠氢键和范德华力使部分血红素辅基从BHb空腔中脱离[3],[Hg(SCN)4]2-则通过静电引力和疏水作用力与血红蛋白反应[4].上述作用均可导致血红蛋白构象发生改变,影响血红蛋白的功能.
过渡金属铁、钴、镍、铜在元素周期表中居于相邻位置,是维持生物体正常生理功能所必需的微量元素.Cu2+参与维持铁的代谢平衡,Ni2+和Co2+参与体内血红蛋白的合成.病理条件下,生物体内过渡金属离子的浓度会升高,破坏血红素的结构,影响血红蛋白的功能.在模拟生理条件下,用紫外可见吸收光谱和荧光光谱研究了Cu2+,Ni2+,Co2+与BHb的相互作用,讨论了过渡金属离子与BHb的荧光猝灭作用,得到了过渡金属离子与BHb的表观结合常数、作用位点和作用方式,探讨了过渡金属离子对BHb蛋白质结构的影响,为研究金属离子对血红蛋白性能的影响提供一定的理论基础.
1 实验部分
1.1 仪器与试剂
普析TU-1810 PC紫外可见分光光度计(北京普析通用仪器有限责任公司);F7000荧光分光光度计(日本日立公司);ME-T分析天平(梅特勒-托利多国际贸易(上海)有限公司);艾本德移液器(艾本德(上海)国际贸易有限公司).
牛血红蛋白(BHb)和三羟甲基氨基甲烷(Tris-HCl)购自华美生物工程公司;醋酸铜(Cu(Ac)2)、醋酸镍(Ni(Ac)2)和醋酸钴(Co(Ac)2)购自阿拉丁公司;其他试剂均为分析纯试剂,使用前均未作进一步处理.
1.2 实验内容
1.2.1 溶液准备
精确配制50 mmol/L Tris-HCl缓冲溶液(pH≈7.0,含100 mmol/L NaCl);精确称量BHb,Cu(Ac)2,Ni(Ac)2和Co(Ac)2,加水溶解,在容量瓶中定容,4 ℃避光存放.
1.2.2 过渡金属离子对BHb紫外可见图谱影响
在5 mL比色管中加入相同量的Tris-HCl缓冲溶液和BHb储备液,依次加入不同浓度Cu2+,Ni2+和Co2+溶液,摇匀,在37 ℃水浴中温浴30 min,以Tris-HCl为参比液,扫描200~700 nm紫外可见吸收光谱.
1.2.3 过渡金属离子对BHb荧光图谱的影响
在5 mL比色管中,依次加入Tris-HCl缓冲溶液、BHb储备液和不同浓度Cu2+和Ni2+溶液,以缓冲溶液稀释至刻度,摇匀,静置反应5 min.分别测定280~560 nm范围内,不同温度(298 K和308 K)的荧光光谱及过渡金属离子的吸收光谱.测定中通过固定BHb的浓度从而改变过渡金属离子的浓度.
2 结果与讨论
2.1 过渡金属离子与BHb相互作用的紫外可见图谱分析
2.1.1 过渡金属离子与BHb相互作用的紫外可见图谱
280 nm附近的吸收为BHb中芳香族氨基酸共轭键导致的紫外吸收,405 nm附近的吸收为血红素铁中π~π*跃迁导致的Soret带吸收.过渡金属离子在280 nm和405 nm均无吸收.文中主要研究Cu2+,Ni2+和Co2+对Soret吸收带的影响,因此仅观察过渡金属离子加入后405 nm附近BHb吸收光谱的变化.
由图1可见,过渡金属离子可降低BHb在405 nm附近的吸收峰强度,且有轻微蓝移.其原因可能是,Cu2+,Ni2+和Co2+进入BHb中血红素辅基的疏水空腔,通过置换反应部分取代Fe2+,形成血红蛋白衍生物,导致Soret带吸收强度降低.金属离子浓度越大,对BHb中π~π*跃迁的破坏越大.当金属离子与BHb物质的量浓度比达到10∶1时(此时金属离子终浓度为40 μmol/L),Cu2+,Ni2+和Co2+导致Soret带吸收的降低值分别为7.9 %,7.3 %和6.9 %,即Cu2+与BHb的相互作用最强.
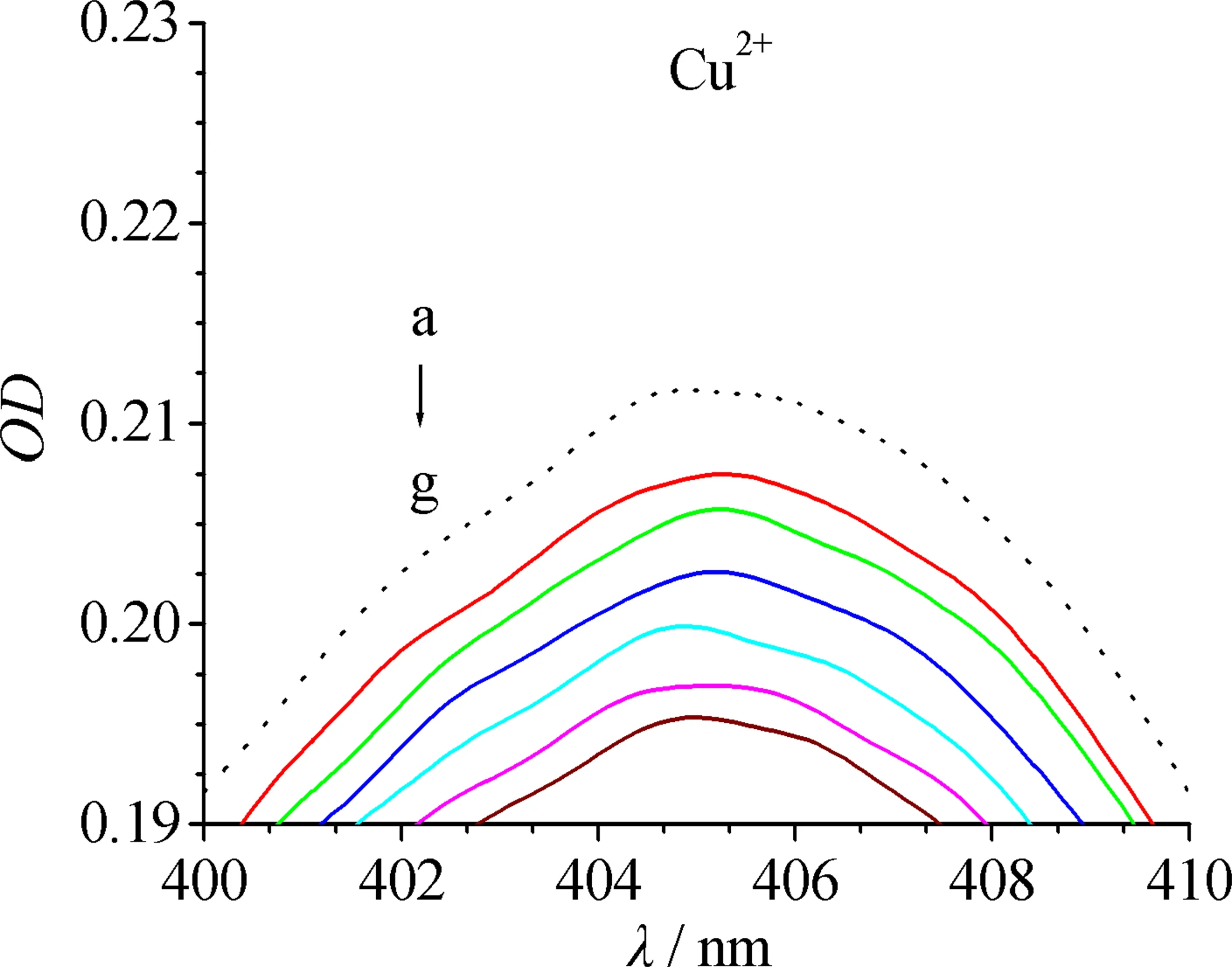
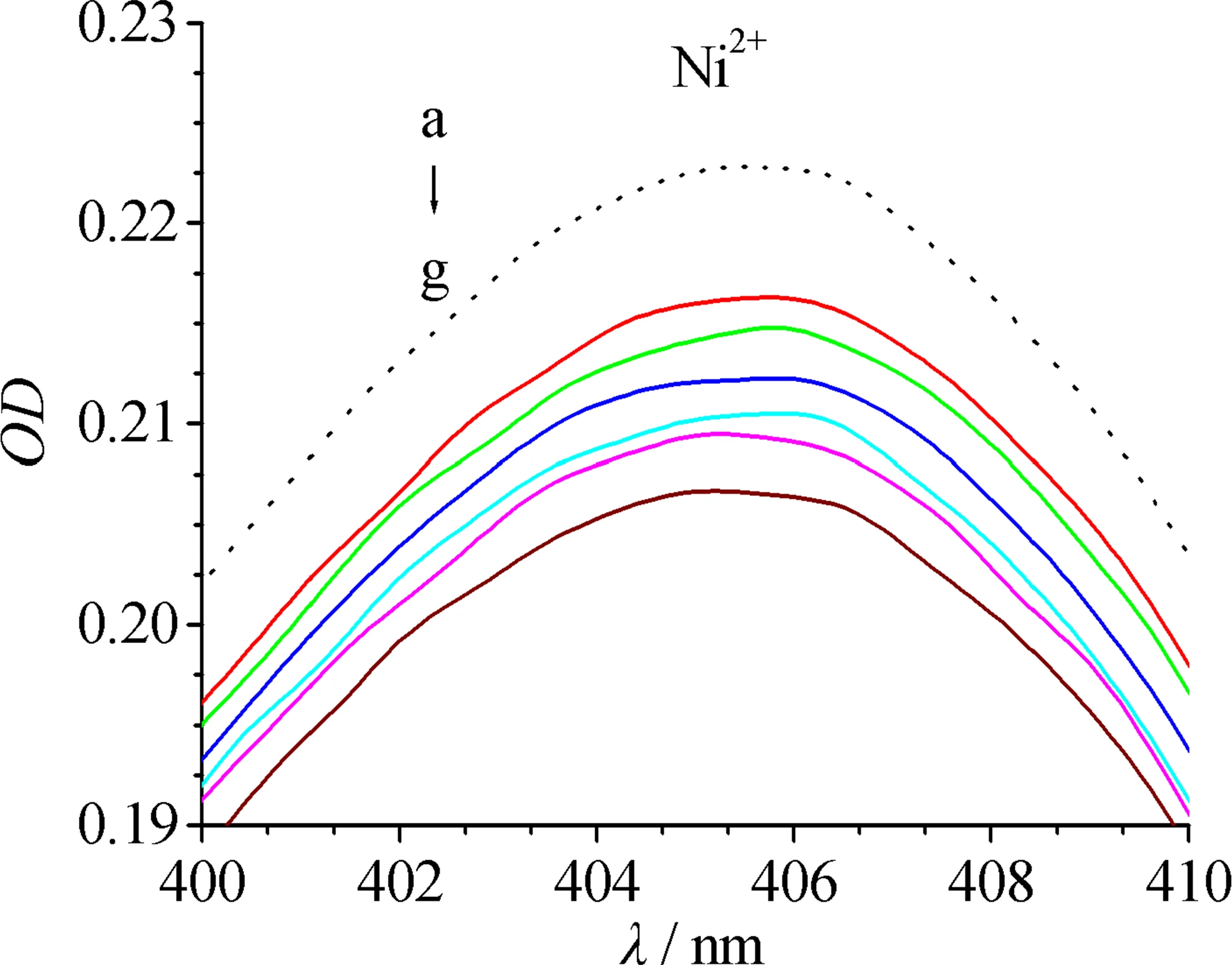
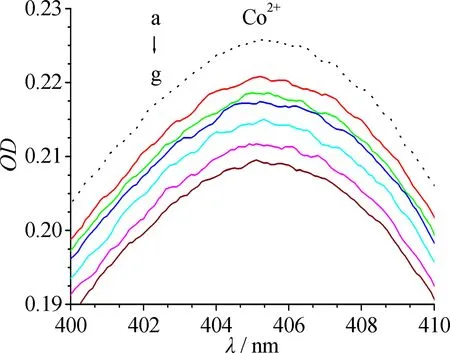
金属离子的浓度从a到g依次为0,4,8,16,24,32,40 μmol/L
2.1.2 过渡金属离子与BHb相互作用机理初探
亚铁血红素以Fe2+为中心,形成6配位的正八面体弱场.晶体场稳定化能(crystal field stabilization energy,CFSE)是影响八面体配合物稳定性的主要因素,CFSE的大小与d电子数的关系见图2.Cu2+,Ni2+,Co2+,Fe2+的d电子数分别为d9,d8,d7,d6,由图2知CFSE的大小依次为CFSE(Fe2+)>CFSE(Cu2+)>CFSE(Co2+)>CFSE(Ni2+).CFSE越小,中心离子所形成的配合物越稳定.因此,血红素金属配合物的稳定顺序可能为血红素镍>血红素钴>血红素铜>血红素铁.也就是说,Cu2+,Ni2+和Co2+均可置换血红素中的Fe2+,血红素镍配合物更稳定.
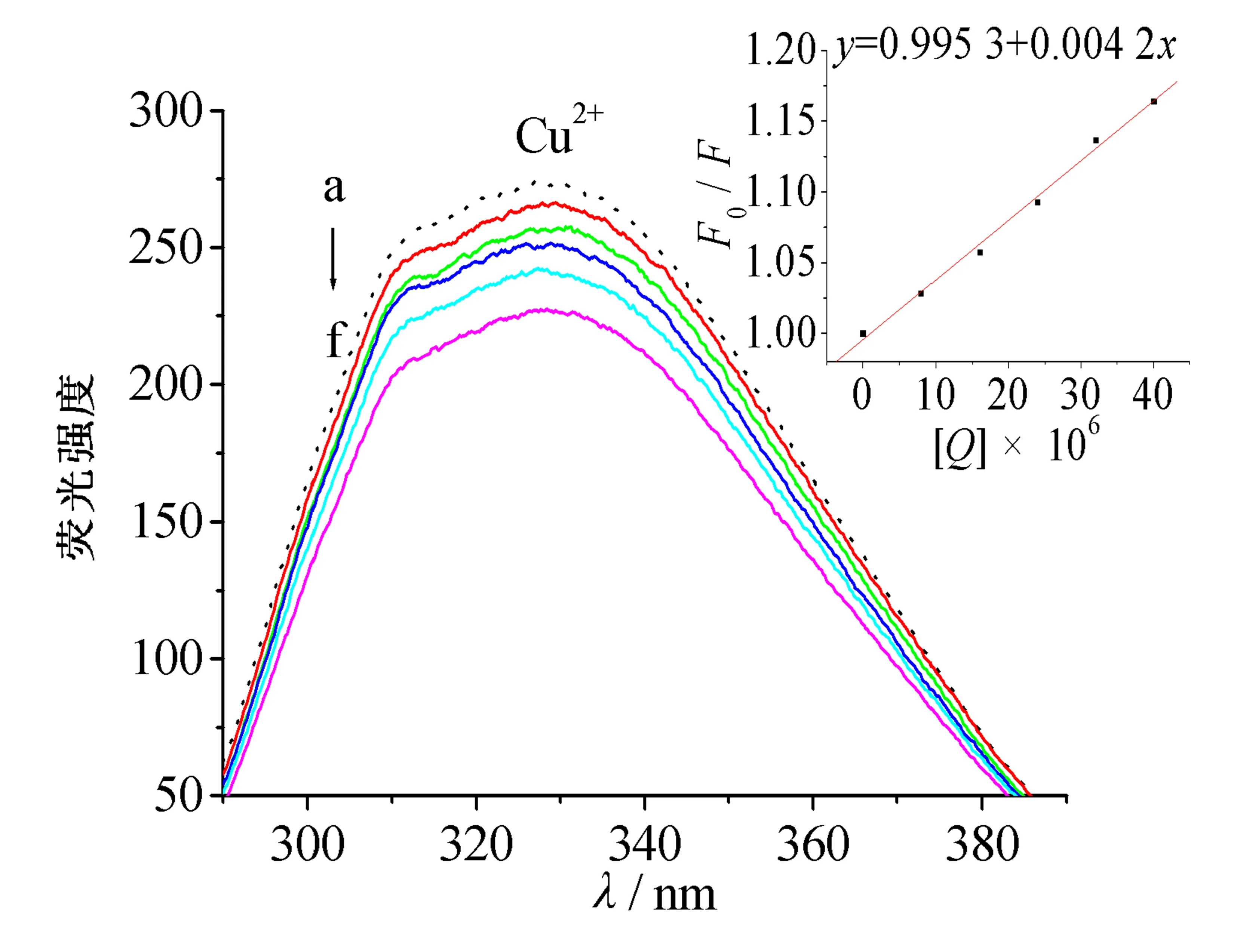
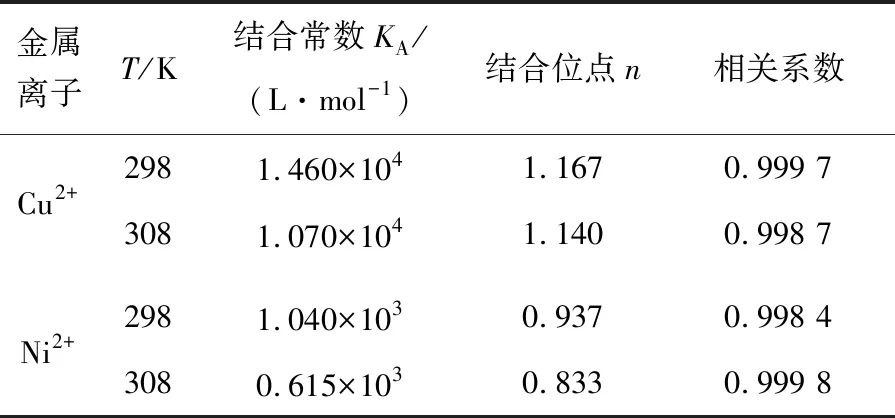
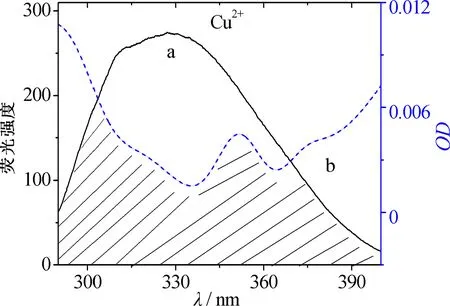
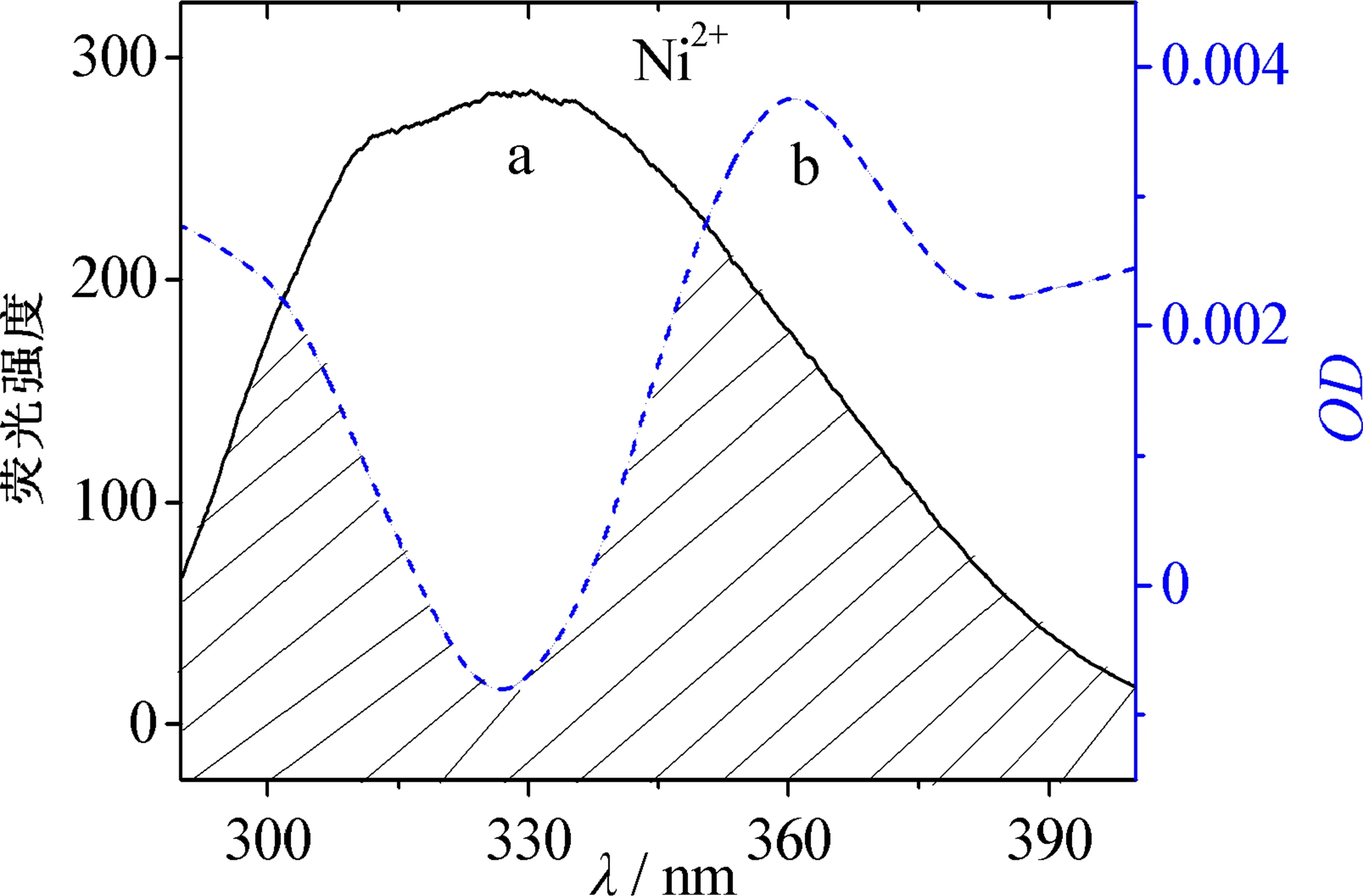
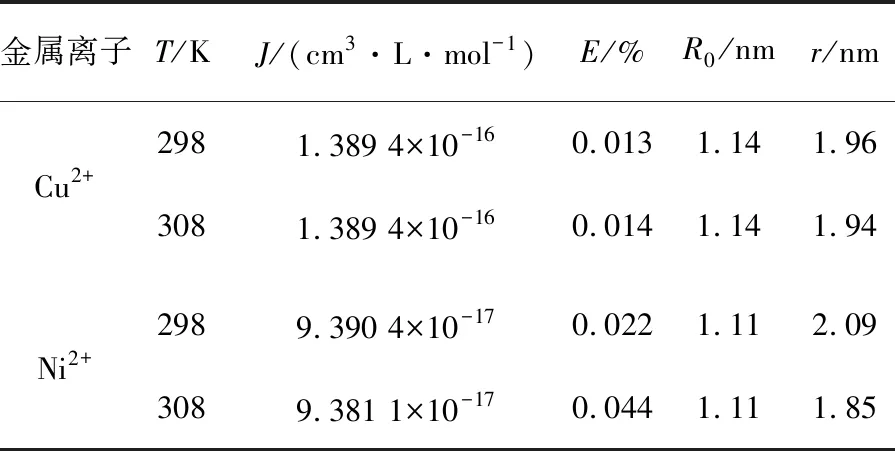
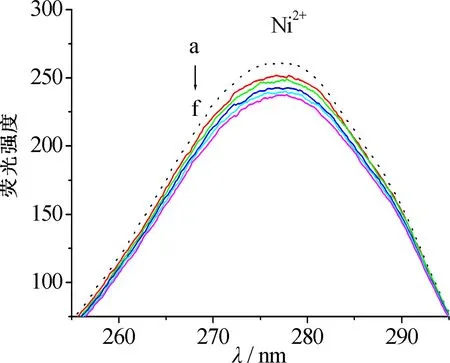
但图1的紫外可见图谱显示血红素铜配合物更稳定.通过欧文-威廉姆斯(Irving-Williams)稳定性顺序[5-6]和姜-泰勒(John-Teller)效应[7-9]对这一看似矛盾的现象进行解释.依据欧文-威廉姆斯序列(Mn2+ 图2 八面体弱场中CFSE与d电子数的关系 2.2.1 过渡金属离子与BHb相互作用的荧光光谱 固定激发波长为280 nm,过渡金属离子在300~500 nm范围内不发射荧光,BHb具有330 nm附近的内源荧光.固定温度分别为298 K和308 K时,发现过渡金属离子均导致BHb在330 nm附近的荧光产生有规律的猝灭,且轻微蓝移.笔者仅展示在308 K时的荧光光谱(见图3). 金属离子的浓度从a到f依次为0,8,16,24,32,40 μmol/L 2.2.2 过渡金属离子导致BHb荧光猝灭的机理研究 荧光物质分子(荧光体)与不发荧光的金属离子或小分子(猝灭体)相互作用,导致荧光物质的荧光强度降低,称为荧光猝灭.荧光体与猝灭体发生碰撞导致动态猝灭,荧光体与猝灭体生成不发荧光的基态复合物导致静态猝灭.通常假设为动态猝灭,则服从动态猝灭方程(Stern-Volmer,斯特恩-沃尔默)[10-11]: F0/F=1+Kqτ0[Q]=1+KD[Q]. 其中:F0为BHb的荧光强度;F为加入金属离子后BHb的荧光强度;Kq为双分子猝灭常数;[Q]为金属离子的浓度;τ0为生物体的荧光寿命;KD为斯特恩-沃尔默常数.以F0/F为纵坐标,[Q]为横坐标,可求出直线斜率KD(见表1).生物体的平均荧光寿命大约为10-8s[12],据此求出Kq(见表1).当Kq>2.0×1010L·mol-1·s-1时认为是静态猝灭[12],导致荧光体荧光强度降低.由表1可知,Cu2+和Ni2+导致BHb荧光猝灭的Kq大于2.0×1010L·mol-1·s-1,说明金属离子对BHb荧光猝灭是形成基态复合物所引起的静态猝灭. 表1 过渡金属离子与BHb相互作用的动态猝灭常数(KD)和双分子猝灭常数(Kq) 金属离子T/K斯特恩-沃尔默常数KD/(L·mol-1)猝灭常数Kq/(L·mol-1·s-1)Cu2+2984.61×1034.61×10113084.33×1034.33×1011Ni2+2981.93×1031.93×10113083.29×1033.29×1011 2.2.3 过渡金属离子与BHb结合常数和结合位点 假设小分子在蛋白质上有n个相同且独立的结合位点,按照公式[13-14]: lg(F0-F)/F=lgKA+nlg[Q]. 其中:KA为金属离子与蛋白质的结合常数;n为结合位点数.以lg(F0-F)/F为纵坐标,lg[Q]为横坐标,代入最大荧光发射峰处(330 nm)的荧光强度,由直线截距和斜率求出结合常数KA、结合位点数n及相关系数(见表2). 表2 过渡金属离子与BHb相互作用的结合常数和结合位点 金属离子T/K结合常数KA/(L·mol-1)结合位点n相关系数Cu2+2981.460×1041.1670.999 73081.070×1041.1400.998 7Ni2+2981.040×1030.9370.998 43080.615×1030.8330.999 8 从表2可知,在所选温度下,Cu2+和Ni2+均以1∶1的物质的量之比与BHb形成静态复合物.在相同温度下,Cu2+所形成的静态复合物的结合常数最大,也进一步证实了血红素铜配合物最稳定(见图1). 2.2.4 过渡金属离子与BHb相互作用时的距离 金属离子与BHb中色氨酸残基相互作用时的结合距离可通过福斯特(Forster)共振能量转移理论进行计算[10].能量转移效率E、受体与荧光体结合距离r以及转移效率为50%时的临界距离R0可通过下列公式[11]计算: J=[∑F(λ)·ε(λ)·λ4Δλ]/[∑F(λ)·Δλ]. 其中:K2(K2=2/3)为取向因子;N(N=1.36)为介质的折射指数;Ф(Φ=0.118)为荧光体的量子产率;J为荧光体的发射光谱与受体的吸收光谱间的重叠积分;F(λ)为荧光体在波长λ处的荧光强度;Δλ为荧光光谱和吸收光谱中的波长间隔;ε(λ)为受体在波长λ处的摩尔消光系数.测定温度为308 K,300~370 nm范围内金属离子与BHb以1∶1的物质的量之比结合的紫外吸收光谱,与BHb荧光发射光谱进行重叠作图(见图4).参照文献[15-16],分别求得R0,E和r,数值列于表3. a:牛血红蛋白的荧光发射光谱; b:金属离子的紫外吸收图谱 图4 Forster非辐射能量转移重叠 血红素中含有的色氨酸(Trp)残基分别为α-14 Trp,β-15 Trp和β-37 Trp,血红蛋白内源荧光主要来自β-37 Trp.当猝灭体与色氨酸残基之间的结合距离r与临界距离R0满足R0 从表3可知,不同温度下Cu2+的结合距离r(1.96 nm和1.94 nm)和Ni2+的结合距离r(2.09 nm和1.85 nm)均小于7 nm,但同时都大于各自的临界距离R0(1.14 nm和1.11 nm).因此,尽管在金属离子与BHb的相互作用中发生了能量转移(r<7 nm),但引起BHb荧光猝灭的主要原因是静态猝灭(r>R0)[16].这也与荧光猝灭分析的结果一致(见表1). 表3 过渡金属离子与BHb作用的相关性 金属离子T/KJ/(cm3·L·mol-1)E/%R0/nmr/nmCu2+2981.389 4×10-160.0131.141.963081.389 4×10-160.0141.141.94Ni2+2989.390 4×10-170.0221.112.093089.381 1×10-170.0441.111.85 2.2.5 过渡金属离子与BHb之间的相互作用力 小分子和蛋白质主要通过静电作用力、疏水作用力、氢键和范德华力等分子间作用力相结合.根据反应前后的热力学函数变(焓变ΔH和熵变ΔS),可以判断小分子与蛋白质之间的主要作用力类型.通常,ΔH>0,ΔS>0,为疏水作用力;ΔH<0,ΔS>0,为静电作用力;ΔH<0,ΔS<0,为氢键和范德华力[17].当不发生热力学相变时,在一定温度范围内ΔH基本不变.由以下热力学公式[17]: ln(K2/K1)=ΔH(1/T1-1/T2)/R; ΔG=-RTlnK; ΔG=ΔH-TΔS. 结合金属离子与BHb在不同温度下的结合常数KA(见表2),计算金属离子与BHb相互作用的热力学函数(见表4).由表4可知,过渡金属离子主要以静电作用力与BHb形成不发荧光的基态复合物,导致BHb产生荧光猝灭. 表4 过渡金属离子与BHb之间的相互作用力 金属离子ΔH/(KJ·mol-1)ΔS/(J·mol-1·K-1)Cu2+-23.720.13Ni2+-40.0976.78 2.2.6 过渡金属离子对BHb构象的影响 固定波长的同步荧光光谱常用于判断蛋白质构象的改变.固定Δλ=15 nm和Δλ=60 nm,分别扫描308 K时BHb中酪氨酸残基和色氨酸残基的同步荧光光谱[11].由图5和图6可知,BHb的荧光主要由色氨酸残基贡献.过渡金属离子基本不改变酪氨酸残基的发射波长和峰形(见图5),但可以使色氨酸残基的发射波长轻微蓝移(见图6).结果表明,过渡金属离子的加入可增强色氨酸所处环境的疏水性,改变BHb的构象[18]. Cu2+和Ni2+的浓度从a到f依次为0,8,16,24,32,40 μmol/L Cu2+和Ni2+的浓度从a到f依次为0,8,16,24,32,40 μmol/L 血红素疏水腔中的亚铁离子可以被过渡金属离子部分置换,形成血红蛋白衍生物,衍生物的稳定性与过渡金属离子中d电子的数目相关.过渡金属离子通过静电作用力与BHb形成稳定不发荧光的基态复合物,以静态猝灭的方式降低BHb的荧光强度.金属离子的加入使BHb中色氨酸残基所处疏水性增强,进而导致蛋白构象发生改变.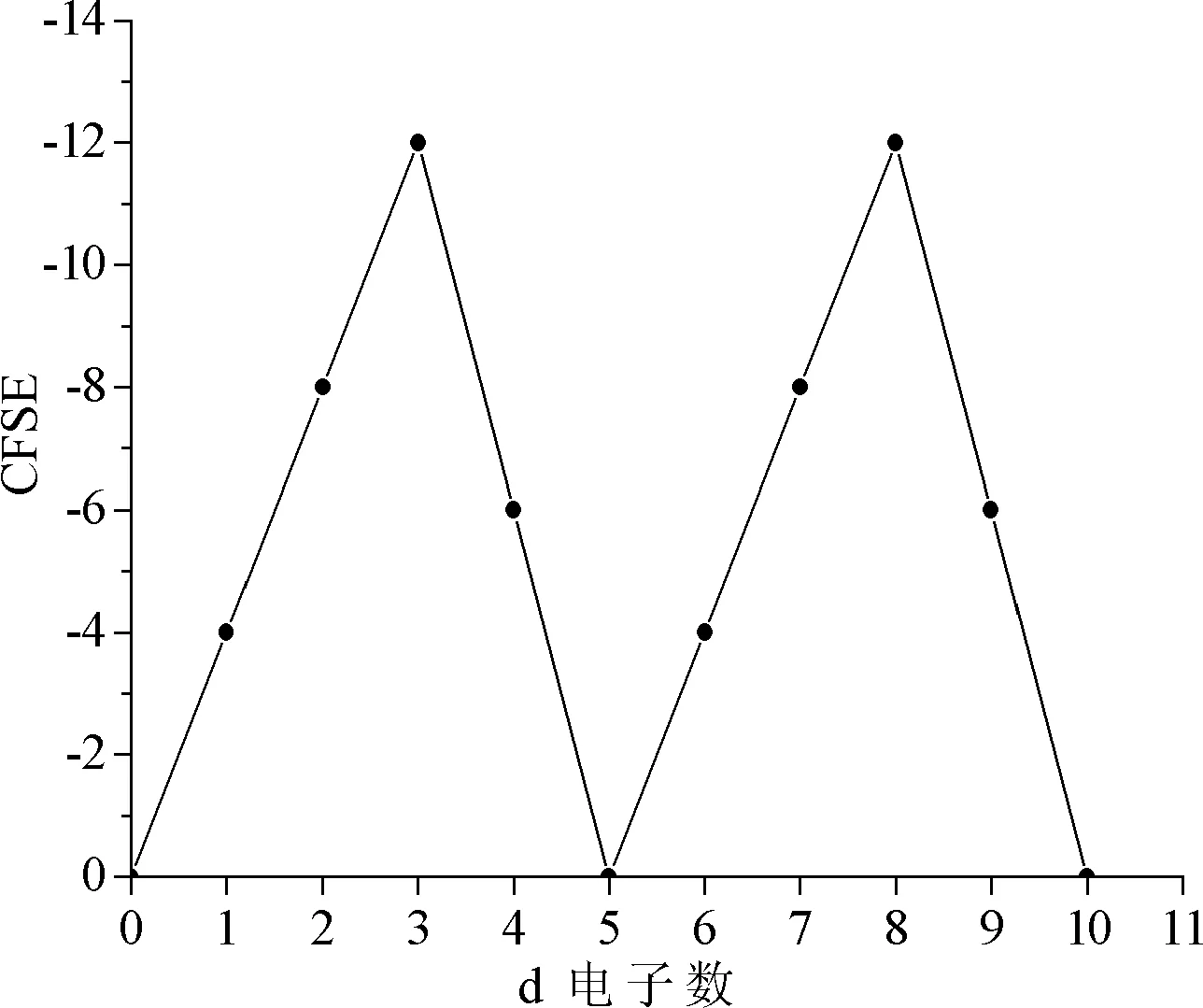
2.2 过渡金属离子与BHb相互作用的荧光光谱分析




3 结 论
