VEGF-C、Bcl-xl蛋白在前列腺癌患者癌组织内表达水平变化及意义研究
2019-06-18刘慧娟杜斌刘瑞强
刘慧娟,杜斌,刘瑞强
(濮阳市人民医院泌尿外科,河南 濮阳 457000)
近年来前列腺癌的发生率明显的上升,流行病学研究证实,前列腺癌的发病率可达272~382/10万人左右[1]。临床上前列腺癌的发生能够导致患者病死率或者致残率的上升,影响到患者远期生存预后[2]。在揭示前列腺癌的发病机制的过程中,可以发现肿瘤相关生物学蛋白的波动,能够影响癌细胞的生物学特性,导致前列腺移行上皮细胞的异常病变。血管内皮生长因子-C(vascular endothelial growth factor-C,VEGF-C)的表达,能够促进新生血管的形成,为肿瘤细胞的持续性增殖提供前 提[3,4];抗凋亡蛋白(anti apoptotic protei,Bclxl)的表达浓度的上升,能够抑制癌细胞的凋亡,促进癌细胞DNA的持续性扩增过程[5]。部分研究者报道了VEGF-C、Bcl-xl在乳腺癌或者甲状腺癌等恶性肿瘤患者病灶组织中的表达情况,发现VEGF-C等的表达阳性率明显上升,同时认为VEGF-C、Bcl-xl等的表达与恶性肿瘤患者的临床分期或者远期生存预后密切相关[6],但对于VEGFC、Bcl-xl的表达与前列腺癌的关系研究不足。为了揭示相关肿瘤生物学因子的表达与前列腺癌的关系,本次研究选取我院2016年1月-2017年6月收集的80例前列腺癌组织,探讨了VEGF-C、Bcl-xl的表达及其与患者临床病理特征的关系。
1 资料与方法
1.1 临床资料 选取我院2016年1月-2017年6月收集的80例前列腺癌组织(癌组织)、40例前列腺增生组织(BPH组)。癌组织,年龄60~83岁,平均为 70.5±9.0 岁,TNM 分期:T1期 14 例、T2期 27例、T3期26例、T4期13例;发生淋巴结转移 38例。癌组织,年龄60~80岁,平均为69.8±8.4岁。两组患者的年龄比较,差异无统计学意义(P>0.05)。纳入标准:⑴前列腺癌、前列腺增生的诊断标准均以手术后病理学结果为准;⑵患者年龄≥60岁;⑶前列腺癌患者术前未接受放化疗、免疫治疗;⑷本研究获得医学伦理委员会的批准。排除标准:⑴既往具有泌尿系统手术病史;⑵伴有膀胱及其他部位恶性肿瘤;⑶未经病理学证实。
1.2 免疫组化染色方法 所有组织标本经石蜡包埋后作连续切片,厚度约为4mm,采用免疫组化链霉卵白素一生物素复合体法 (strep avidin-biotin complex,SABC 法)染色,二氨基联苯胺(diamionben zidene,DAB)显色。 VEGF-C 蛋白、Bcl-xl蛋白通用型二抗以及SP试剂盒和DAB显色盒均购自北京中杉金桥生物技术开发公司。以阳性片及PBS代替一抗分别作为阳性及阴性对照,高倍显微镜下观察VEGF-C蛋白、Bcl-xl蛋白的表达情况,具体染色步骤严格按照SP试剂盒说明书进行操作。
1.3 判断标准 免疫组化结果判定:VEGF-C蛋白、Bcl-xl蛋白的阳性着色表达于细胞质,呈黄色、棕黄色、褐色表达,⑴根据着色强度:0分为无色、1分为淡黄色、2分为棕黄色、3分为褐色、黑色;⑵根据阳性细胞比例:阳性细胞数目所占比例≤10%为1分、阳性细胞所占比例11%~50%为2分、阳性细胞数51%~75%为3分、阳性细胞数所占比例>75%为4分,两种积分相乘总分<3分为阴性、≥3分为阳性。
2 结果
2.1 两组标本中的VEGF-C、Bcl-xl蛋白阳性表达率比较 癌组织中的VEGF-C蛋白、Bcl-xl蛋白阳性率分别为 76.25%、72.50%,BPH组织中的VEGF-C蛋白、Bcl-xl蛋白阳性率分别为12.50%、20.00%,两组比较差异具有统计学意义(P<0.05);见表 1、图 1。
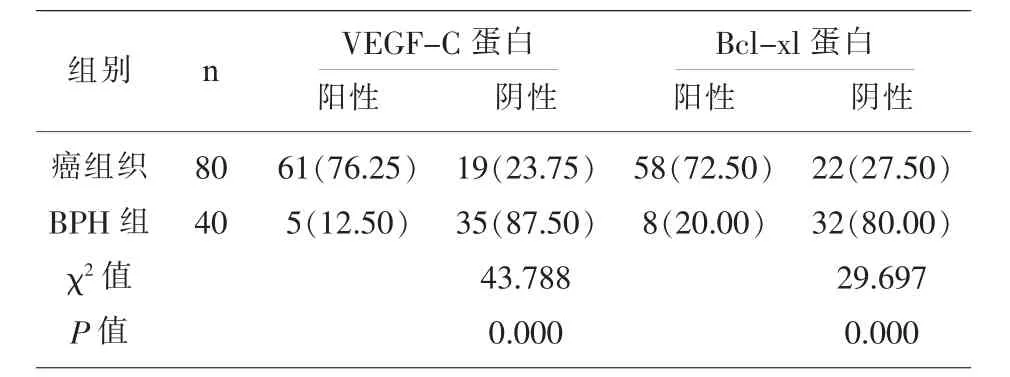
表1 两组标本中的VEGF-C蛋白、Bcl-xl蛋白阳性表达率比较[n(%)]
2.2 前列腺癌组织中的VEGF-C蛋白、Bcl-xl蛋白阳性表达与病理特征的关系 癌组织中的VEGFC蛋白在TNM分期(T3~T4期)、发生淋巴结转移的组织中阳性表达率高于TNM分期(T1~T2期)、未发生淋巴结转移的组织(P<0.05);见表 2。
癌组织中的Bcl-xl蛋白在TNM分期 (T3~T4期)、发生淋巴结转移的组织中阳性表达率高于TNM分期 (T1~T2期)、未发生淋巴结转移的组织(P<0.05);见表 3。
3 讨论
前列腺癌的病情进展相对较为隐匿,临床上多数患者无特异性的症状,病情的早期诊断水平较低[7]。同时前列腺癌的手术治疗或者放化疗治疗后,患者的病死率或者生存时间等指标均无明显改善[8]。一项包含了334例样本量的多中心的前列腺癌临床诊疗分析研究显示,前列腺癌的早期诊断水平不足55%,治疗后的病情缓解率不足50%,无瘤生存时间不足36个月[9]。本次研究通过对于相关分子生物学水平的相关研究,不仅能够为前列腺癌的发病机制研究提供参考,同时可以为疾病的诊断提供潜在的临床指标。
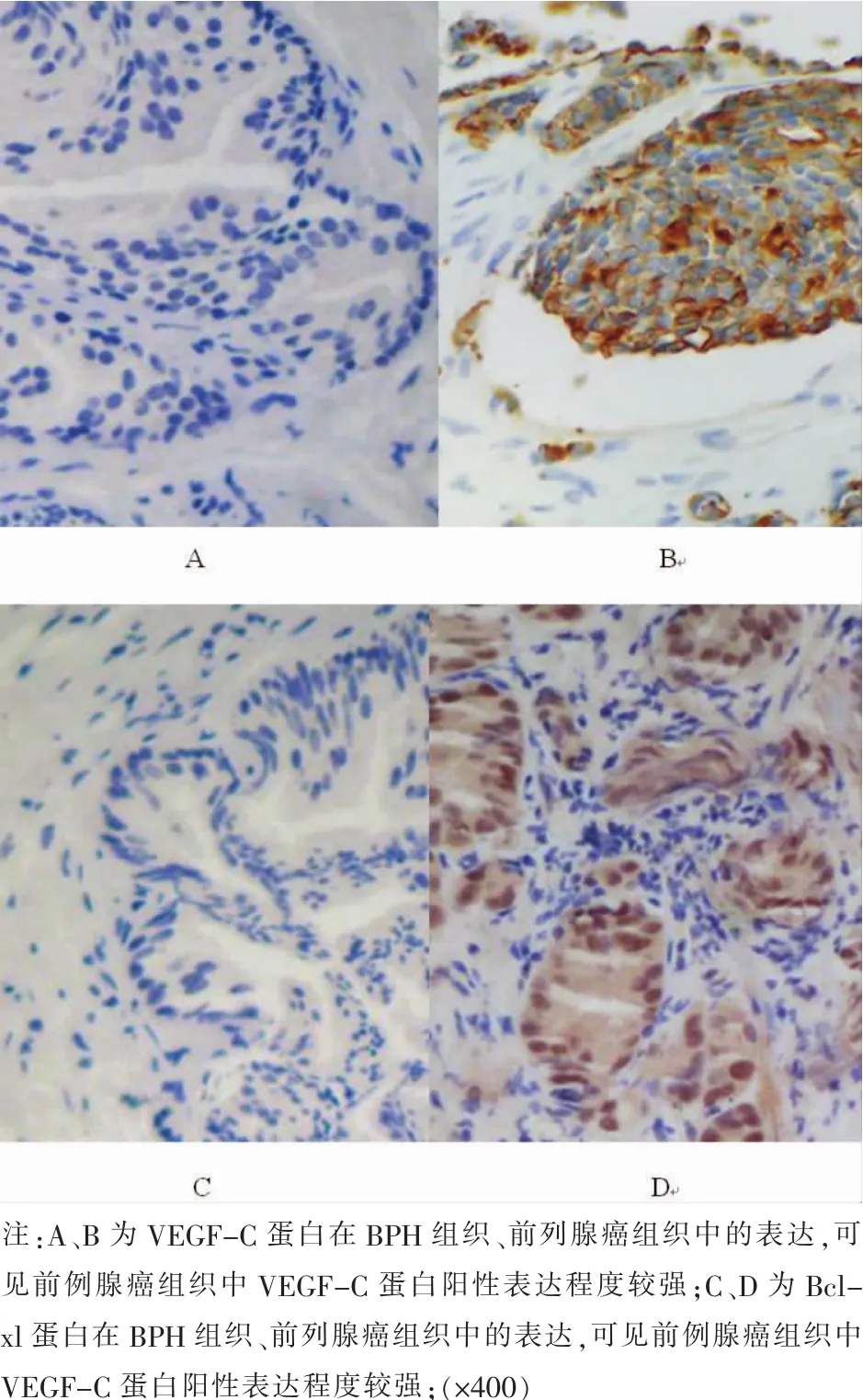
图1两组标本中的VEGF-C、Bcl-xl蛋白阳性表达

表3 前列腺癌组织中的Bcl-xl蛋白阳性表达与病理特征的关系
VEGF-C蛋白水平的改变对于肿瘤信号通路的激活,能够交错式激活患者体内的癌细胞转录调控因子,提高癌细胞DNA的扩增速度[4]。VEGFC的表达上升不仅可以影响新生血管的形成,提高肿瘤病灶组织的血流灌注,同时还能够促进癌细胞细胞周期调控依赖性蛋白激活的转录及翻译,增加G1/S期比例[3];Bcl-xl LT4是重要的抗凋亡因子,其能够通过抑制癌细胞程序性凋亡,促进癌细胞的持续性增殖,进而参与到恶性肿瘤的病情进展过程[10]。相关基础方面的研究还认为,Bcl-xl表达浓度的上升还能够促进癌细胞内的转录基因的结合,提高肿瘤干细胞对于癌细胞增殖活性的维持[11]。部分研究者报道了VEGF-C的表达与前列腺癌的关系,认为VEGF-C的表达阳性率的上升与前列腺癌的临床病理特征密切相关,但对于Bcl-xl的分析研究不足。
在本次研究中,免疫组化的分析研究发现,VEGF-C、Bcl-xl蛋白的表达阳性率明显的上升,高于前列腺良性增生组,差异较为明显,提示了VEGF-C、Bcl-xl二者均可能影响了前列腺癌的发生过程,通过荟萃国内外相关文献,笔者认为VEGF-C、Bcl-xl的高表达与前列腺癌的发生关系可能与下列几个方面的因素有关[12,13]:⑴VEGF-C的表达浓度的上升能够促进肿瘤微血管的形成,通过肿瘤病灶组织的灌注水平,为肿瘤细胞的增殖和转移提供了基础;⑵Bcl-xl不仅能够影响肿瘤细胞的凋亡过程,同时还能够促进癌细胞的过度增殖效应,降低癌细胞的坏死吸收速度。史玉爽等[14]研究者也通过免疫组化分析研究发现,在前列腺癌病灶组织中,VEGF-C的表达阳性率可平均上升40%以上,同时在治疗敏感性较差或者远期病死率较高的前列腺癌患者中,VEGF-C的表达阳性率上升更为明显。在探讨VEGF-C、Bcl-xl的表达与前列腺癌患者临床病理特征的关系过程中发现,在发生了淋巴结转移或者临床分期较晚的前列腺癌患者中,VEGF-C、Bcl-xl的表达阳性率均明显的上升,提示了VEGF-C、Bcl-xl均能够促进前列腺癌患者临床病理特征的进展,这主要考虑与VEGF-C的表达浓度的上升,能够提高前列腺移行上皮细胞对于淋巴结的粘附能力,提高了癌细胞对于临近正常组织的浸润能力,导致了前列腺癌淋巴结转移或者临床分期的进展。特别是Bcl-xl的表达浓度的上升,还能够抑制癌细胞的凋亡,持续性提高癌细胞对于淋巴结内皮细胞的粘附过程。但部分研究者还认为VEGF-C或者Bcl-xl的表达与前列腺癌患者的Gleason评分具有一定的关系,本次研究并未相关结论,不同的研究存在不同的结论,考虑可能与VEGF-C或者Bcl-xl的检测灵敏程度的差别等有关[15]。
