类乌齐牦牛SIRT3基因克隆与生物信息学及差异表达分析
2019-06-18杨玉梅柴志欣王吉坤信金伟姬秋梅钟金城
杨玉梅,柴志欣,王 会,王吉坤,信金伟,姬秋梅,钟金城*
(1.西南民族大学青藏高原动物遗传资源保护与利用教育部重点实验室,四川成都 610041;2.西藏自治区农牧科学院省部共建青稞和牦牛种质资源与遗传改良国家重点实验室,西藏拉萨 850009)
哺乳动物的沉默信号调节因子(The Silent Information Regulator,Sirtuin)家族是酵母沉默信息调节因子2(SIR2)的同源蛋白质,是一种高度保守的烟酰胺腺嘌呤二核苷酸(Nicotinamide Adenine Dinucleotide,NAD+)依赖的去乙酰化酶,广泛存在于原核生物和真核生物,具有7 个家族成员SIRT1-7[1-2]。沉默信号调节因 子3(Silent Mating Type Information Regulation 3,SIRT3)主要定位于线粒体,调节线粒体内的细胞活力及能量代谢[3]。对缺失SIRT3 的小鼠进行饥饿试验,48 h 后发现肝脏和血浆中的脂肪堆积异常且棕榈酸的氧化速率降低,脂肪酸β- 氧化发生障碍[4];在棕色脂肪细胞分化过程中会存在SIRT3 的诱导表达[5],白藜芦醇能上调肝细胞SIRT3 的表达与活性,改善肝细胞线粒体功能,减轻肝细胞氧化应激损伤[6]。以上研究表明,SIRT3 对调节肝细胞氧化代谢及脂肪代谢发挥重要作用。
牦牛是青藏高原畜牧业发展的主要畜种,为当地牧民提供赖以生存的生产和生活资料。类乌齐因其气候宜人,植被丰富,俗称“西藏小瑞士”。类乌齐牦牛遗传多样性丰富,保持了“原生态、纯天然、全绿色”等特点,肉质鲜美,致密有弹性,富含蛋白质和氨基酸,口味浓郁,营养价值高,保持了“原生态、纯天然、全绿色”等特点,2018 年正式公布成为国家优良牦牛遗传资源。本实验通过对类乌齐牦牛SIRT3 基因的克隆与生物信息学等研究,为进一步探讨影响类乌齐牦牛肝脏组织中脂肪代谢的主要影响因素提供基础资料。
1 材料与方法
1.1 实验动物 样品采集于西藏自治区昌都市类乌齐县,选取3 头4.5 岁健康雌性类乌齐牦牛,分别采集肝脏、心脏、臀大肌组织,立即用灭菌DEPC 水冲洗,置于液氮保存备用。
1.2 方法
1.2.1 引物设计 参考GenBank 普通牛SIRT3 基因序列(NM_001206669.1),使用Primer premier5.0 设计引物(表1),由英潍捷基(上海)生物技术有限公司合成。
1.2.2 总RNA 提取及反转录 选取类乌齐牦牛肝脏组织用于克隆,用Trizol 法提取肝脏组织的总RNA,用分光光度计检测RNA 浓度,电泳检测RNA 完整性并分装保存于-80℃。按照反转录试剂盒(宝生物工程(大连)有限公司)说明书步骤将总RNA 反转录合成cDNA。
1.2.3 SIRT3 基因PCR 扩增 以反转录产物为模板,PCR 扩增体系(25 µL):cDNA(20 ng/µL)1 µL,上、下游引物(10 pmol/mL)各1 µL,无菌去离子水 9.5 µL,Taq Green PCR Master Mix 12.5 µL。PCR 反应程序:95℃ 4 min 预变性;94℃ 40 s,64℃ 45 s,72℃ 70 s,共34 个循环;72℃延伸10 min。
1.2.4 QPCR 分析 反应体系10 µL: SYBR premix Dimer Eraser(2x)5 µL,上、下引物(10 pmol/mL)各0.4 µL,无菌去离子水3.2 µL,cDNA(20 ng/µL)1 µL。定量程序:95℃预变性30 s,95℃ 5 s,55℃ 30 s,72℃ 30 s,40个循环。分别取3 头牦牛的心脏、肝脏、臀大肌组织进行定量分析,每个组织3 个重复。反应结束后以熔解曲线来判定QPCR 反应的特异性,获得每个样品的CT 值,采用2-ΔΔCT法,GAPDH 作为内参基因对样本定量结果进行处理,计算各个样本的相对表达水平,每组重复取平均值。利用SPSS 16.0 软件对SIRT3 基因在不同组织器官的表达水平进行单因素方差分析,P<0.05 为差异显著,P<0.01 为差异极显著。
1.3 目的基因克隆 纯化回收后的PCR 产物与PMD19-T载体16℃过夜连接,将连接产物转化至DH5α 感受态细胞,筛选阳性克隆,送擎科生物科技有限公司测序。
1.4 生物信息学分析 将所得序列进行BLAST 比对分析,利用Clustalx 和Mega5.0 构建系统进化树,DNASTAR 进行同源性分析。利用在线软件ExPASy、SWISSMODEL 相关程序分析SIRT3 蛋白质的理化性质及结构特征。利用SignaIP 4.1、TMpred、PSORT Ⅱ软件预测SIRT3 基因的功能。
2 结果与分析
2.1 牦牛SIRT3 基因的RT-PCR 扩增 根据PCR 扩增结果,目的条带与预期大小一致(图1)。类乌齐牦牛SIRT3 基因CDS 区长1 002 bp,共编码333 个氨基酸。牦牛与普通牛(NM_001206669.1)SIRT3 基因CDS 区对比发现,存在6 个突变位点(49、279、342、384、149、620 bp),分别导致密码子TTG→CTG(亮氨酸)、CCA→CCG( 脯 氨 酸)、GAA→GAG( 谷 氨酸)、TTC→TTT(亮氨酸),以上均为同义突变;GGC→GAC(甘氨酸变成天冬氨酸)、GTG→GCG(缬氨酸变成丙氨酸)为错义突变(图2)。
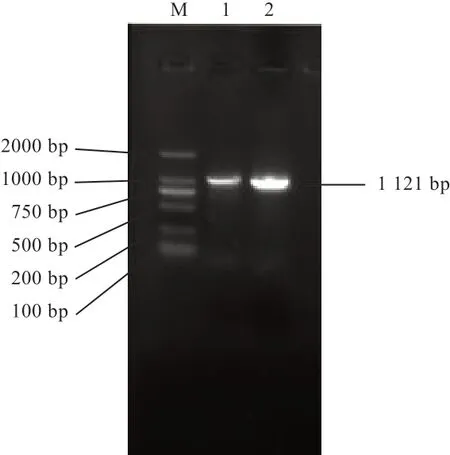
图1 牦牛SIRT3 基因RT-PCR 扩增产物电泳图

表1 类乌齐牦牛SIRT3 基因的引物序列
2.2 SIRT3 蛋白理化性质分析 使用ProtParam 预测,SIRT3 基因编码蛋白含负电荷残基总数(天冬氨酸+谷氨酸)33 个,正电荷残基总数(精氨酸+ 赖氨酸)39 个,正负残基含量相差较小。SIRT3 蛋白分子质量为36 961.69 u,等电点(PI)为9.00,其不稳定指数为36.34,属稳定蛋白,脂肪指数为91.95,亲水系数(GRAVY)为-0.036,表现为亲水性。疏水性分析显示,多肽链第77 位缬氨酸分值最高(2.689),第196 位酪氨酸分值最低(-2.044),整个肽链在尾部呈亲水性,为可溶性蛋白。
2.3 SIRT3 蛋白功能预测
2.3.1 跨膜结构域预测 利用TMpred 和SignalP 4.1 预测SIRT3 蛋白跨膜区域,存在多个跨膜区域,最优跨膜拓扑结构仅一处位于其内部N 端(29~49 aa),同时TM- 螺旋长度预测在17~33 aa。不含信号肽,属非分泌性蛋白。
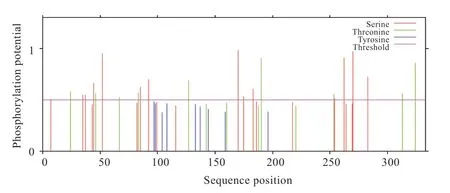
图3 类乌齐牦牛SIRT3 蛋白磷酸化位点预测
2.3.2 磷酸化位点预测 使用NetPhos 3.1 Server 预测SIRT3 基因编码序列的磷酸化位点,共发现23 个磷酸化位点,包含14 个丝氨酸磷酸化位点和9 个苏氨酸磷酸化位点(图3)。亚细胞定位发现,牦牛成熟SIRT3蛋白主要存在于线粒体(69.6%),部分存在于细胞质(17.4%)、细胞核(8.7%)及细胞骨架(4.3%)。

图2 类乌齐牦牛SIRT3 基因与普通牛CDS 区比对

图4 类乌齐牦牛SIRT3 蛋白的保守结构域

图5 类乌齐牦牛与其他物种SIRT3 氨基酸比对

图6 类乌齐牦牛SIRT3 预测二级结构
2.3.3 保守结构域预测 使用NCBI 预测SIRT3 蛋白的保守区域。由图4 可知,该蛋白属SIR2 蛋白超家族结构域,包括Sir2 酶,其催化NAD+依赖性蛋白质/组蛋白脱乙酰化,其中来自赖氨酸ε-氨基的乙酰基转移至NAD +的ADP-核糖部分,产生烟酰胺和代谢产物O-乙酰基-ADP-核糖。SIRT1 结构域,包括人SIRT1-3和酵母Hst1-4,属于SIR2 蛋白家族成员,Sir2 酶催化NAD+ 依赖性蛋白质/ 组蛋白脱乙酰化。同时,包含14 个NAD + 结 合 位 点(80、82、83、90、91、143、161、162、164、181、252、257、278、279、298),11 个底物结合位点(163、181、225、227、228、229、230、231、256、257、258)和4 个Zn 结合位点(189、192、213、216)。
2.3.4 功能结构域预测 使用Clustal W 2.1 Version 分析发现,类乌齐牦牛SIRT3 蛋白包含保守KIV 与GIP 功能区域(图5),是基因沉默必不可少的核心区域。利用Psipred 的FFpred 预测蛋白质功能,该蛋白在含磷酸化合物代谢、线粒体组织、小分子代谢及调节代谢等一系列生物合成过程中发挥调控作用,其中在催化活性、核苷酸结合及辅因子结合等过程中发挥主要作用(表2)。
2.3.5 高级结构预测 使用SOPMA 预测类乌齐牦牛SIRT3 蛋白二级结构,其中α-螺旋和无规卷曲为二级结构主要组成部分,分别占35.44%和44.44%,延伸链、β-转角分别占13.81%和6.31%(图6),牦牛SIRT3 基因编码蛋白为混合类蛋白质。使用SWISSMODEL 预测其三级结构发现,该蛋白二级结构主要由α-螺旋和无规则卷曲构成,含少量β-转角和延伸链。该结果与SOPMA软件预测类乌齐SIRT3 蛋白二级结构一致(图7)。
2.5 同源性分析及构建系统进化树 利用ClustalX 和MAGA5.2 构建类乌齐牦牛与普通牛(Bos taurus)、山羊(Capra hircus)、野猪(Sus scrofa)、家猫(Felis catus)、人(Homo sapiens)、家兔(Oryctolagus cuniculus)、小鼠(Mus musculus)、大鼠(Rattus norvegicus)和斑马鱼(Danio rerio)SIRT3 基因核苷酸序列的系统进化树。结果表明,类乌齐牦牛与普通牛亲缘关系最近,与斑马鱼亲缘关系最远(图8)。用DNASTAR 的MegAlign 对类乌齐牦牛进行一致性分析,发现类乌齐牦牛与普通牛、山羊、野猪、家猫、人、家兔、小鼠、大鼠、斑马鱼的一致性分别为99.4%、96.8%、89.7%、78.4%、82.1%、79.5%、81.5%、82.7%、59.9%,其分析结果与物种间亲缘关系理论一致(图9)。
2.6 QPCR 分析 由图10 可知,SIRT3 基因在类乌齐牦牛肝脏组织中的表达水平显著高于其他组织(P<0.01),心脏组织与臀大肌组织中的表达水平差异不显著。
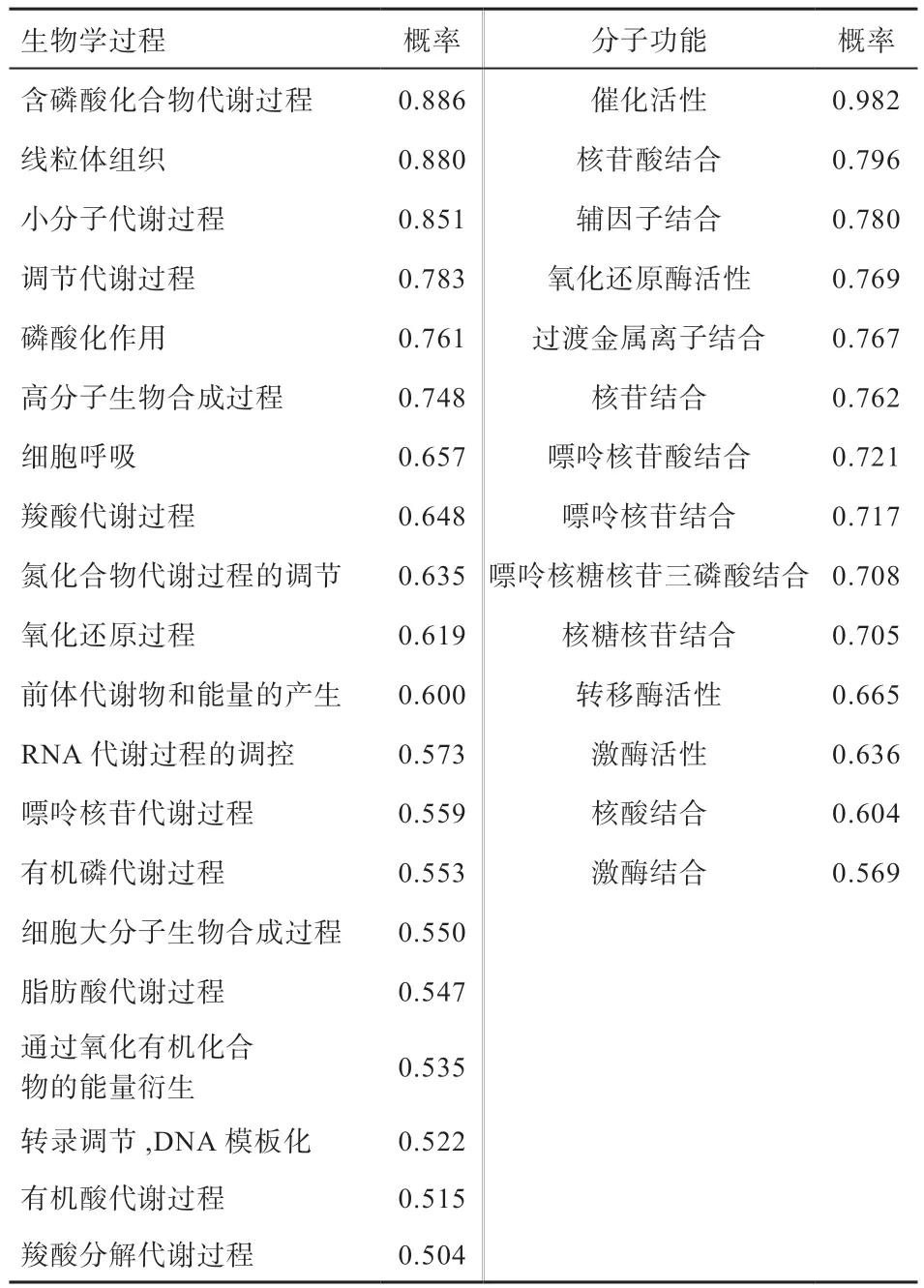
表2 SIRT3 基因功能分析结果
3 讨 论
3.1 类乌齐牦牛SIRT3 基因分子特性分析 线粒体是细胞内进行脂肪酸氧化代谢的核心细胞器,线粒体中脂肪酸氧化是脂肪消耗的主要方式,相关研究显示,3T3L1细胞分化后用抗霉素处理,抑制线粒体的氧化呼吸可显著促进细胞内脂质的积累,说明线粒体的功能与脂肪沉积存在重要关系[7]。脂肪细胞分化需大量ATP,成脂分化前期,线粒体进行氧化磷酸化可产生脂肪细胞分化过程中所需的大量ATP。研究发现,许多线粒体蛋白赖氨酸的乙酰化状态均是由SIRT3 基因调节[8-9],线粒体蛋白赖氨酸乙酰化是调节脂肪代谢的重要途径,而其乙酰化水平在很大程度上取决于NAD+依赖性去乙酰化酶[10]。对于已经成脂分化的3T3L1 细胞,通过基因转染过表达SIRT3 可显著减少细胞内线粒体数量,而抑制SIRT3的表达则会增加细胞内线粒体数量[11]。
图7 类乌齐牦牛SIRT3 蛋白三级结构的预测
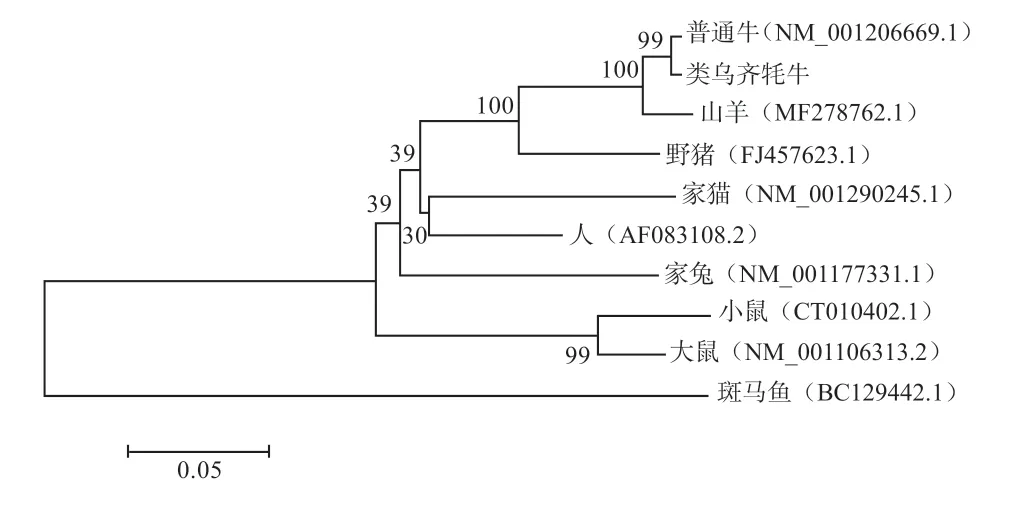
图8 用邻接(NJ)法对类乌齐牦牛与其他品种间SIRT3 基因序列构建的进化树
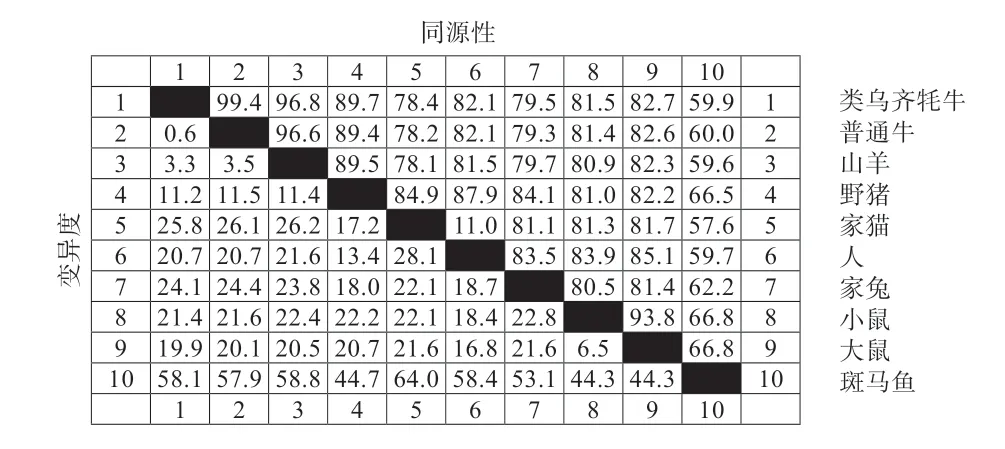
图9 类乌齐牦牛SIRT3 同源性分析
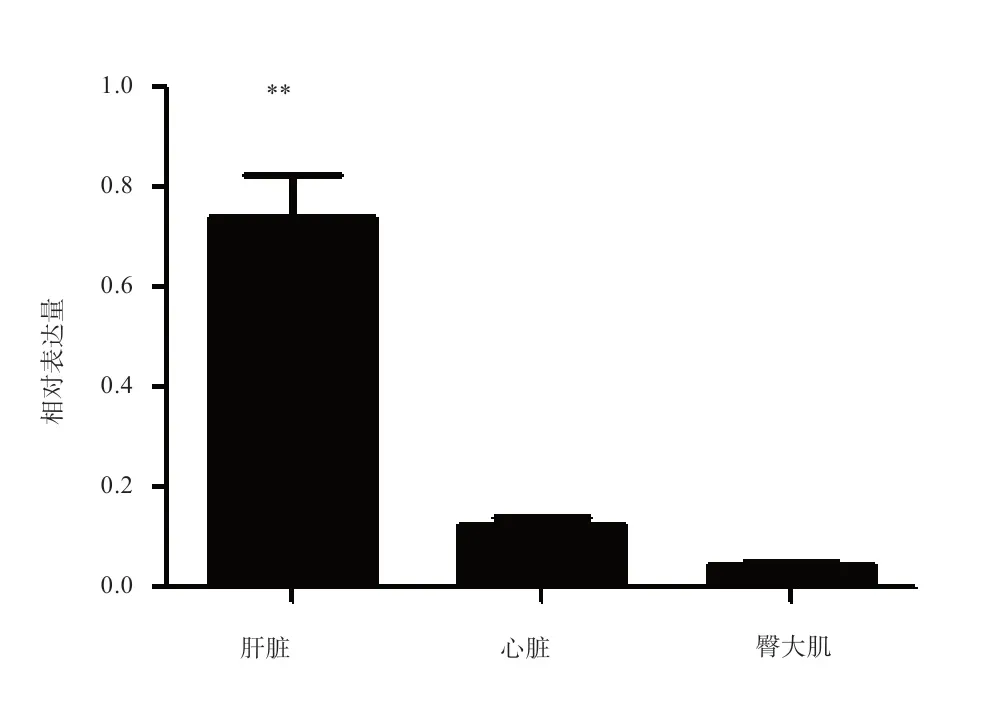
图10 牦牛SIRT3 基因的mRNA 组织表达分析
Sirtuin 家族的催化核心由NAD+ 结合域和小亚结构域组成,NAD+ 结合域由Rossman 折叠构成,是许多NAD+ 和NADP 结合酶的特征域;小亚结构域包括一个螺旋构件和一个锌结合[12]。大小结构域之间形成了一个裂隙,为NAD+ 提供了结合位点,乙酰化肽在这个裂缝里结合形成酶- 底物的β- 折叠结构而发生催化反应[13]。本研究中类乌齐牦牛SIRT3 蛋白包含SIR2蛋白超家族结构域和SIRT1 结构域,这与Sirtuin 家族基本结构吻合。类乌齐牦牛SIRT3 基因氨基酸序列发现2 个特异性保守结构域KIV 和GIP,是SIRT3 蛋白调控基因沉默的关键功能结构域[14],与人SIRT3 蛋白具有相似的功能,说明不同物种SIRT3 蛋白结构的相似性较大。亚细胞定位和功能分析显示,类乌齐牦牛SIRT3蛋白位于线粒体,该蛋白在含磷酸化合物代谢、线粒体组织及调节代谢等生物合成过程发挥作用,但在催化活性、核苷酸结合及辅因子结合等过程发挥主要作用。就目前研究而言,红鳍东方鲀SIRT3 蛋白功能对中央中介代谢、翻译、脂肪酸代谢和辅因子生物合成等过程发挥调控作用[10],与本研究在脂肪代谢和辅因子结合等过程发挥调控作用相同,说明该基因具有保守性,但鱼类与家畜在遗传机制、遗传基础、身体构造及所处环境有较大差异,该蛋白调控过程存在差异也属正常。
3.2 SIRT3 蛋白所含氨基酸分析 目前,对SIRT3 基因的研究主要集中在人、小鼠、猪和牛等,对牦牛SIRT3 基因的研究鲜有报道。本实验发现,类乌齐牦牛SIRT3 基因CDS 区长1 002 bp,编码333 个氨基酸,这与牛SIRT3基因CDS 区长1 002 bp,共编码333 个氨基酸的结果相同[15],与红鳍东方鲀SIRT3 基因CDS 区长1 263 bp、编码420 个氨基酸的结果差异较小[16],说明SIRT3 基因在进化过程中相对保守。
与普通牛比对,类乌齐牦牛SIRT3 基因CDS 区存在甘氨酸突变成天冬氨酸、缬氨酸突变为丙氨酸2 处错义突变。天冬氨酸是生物体内多种氨基酸及嘌呤、嘧啶碱基的合成前体,作为生物体内氨基提供者参与许多代谢途径[17],这也成为SIRT3 基因在不同组织线粒体中发挥作用的物质保障。SIRT3 可去乙酰化激活乙酰-Co A 合成酶(Ace CS2),Ace CS2 是一个线粒体酶,可以利用乙酸盐、Co A 和ATP 生成乙酰-Co A,乙酰-Co A 是三羧酸循环的中间产物,也是胆固醇和脂肪酸合成的主要底物[18]。天冬氨酸可介导还原当量通过线粒体膜的转移,进而调控细胞的糖酵解和氧化还原状态,还可通过合成天冬酰胺调节免疫功能[19-20],是类乌齐牦牛的能量代谢及提高免疫的重要物质基础,还可作为K+、Mg2+
的载体向心肌输送电解质,从而改善心肌收缩功能,同时降低氧消耗,在冠状动脉循环障碍缺氧时,对心肌有保护作用。牦牛生活在高原缺氧环境,天冬氨酸可保护牦牛的心肌有利于其在极端环境生存。而丙氨酸可协助葡萄糖代谢,补充类乌齐牦牛在温差较大的高原环境所需能量。在氨基酸对猪小肠上皮细胞抗菌肽和信号通路蛋白表达影响的研究中发现,用丙氨酸处理可显著提高Sirt1 的表达水平[21],饲粮中添加适量β-丙氨酸能改善肉仔鸡肉品质[22],SIRT3 基因部分位点突变可能是其肉质鲜美的影响因素。而秦川牛SIRT3 基因发现第5外显子22522 C>T 突变,与其部分体尺、肉品质性状极显著相关[23],与本研究结果突变位点一致,可进一步进行该基因突变位点与牦牛体尺及肉品质性状的相关性分析。
3.3 类乌齐牦牛SIRT3 基因表达分析 SIRT3 基因在臀大肌中表达水平最低,在肝脏组织中的表达水平最高。肝脏作为机体主要代谢器官,肝脏中SIRT3 不仅参与脂肪酸的合成和分解代谢,也参与调控饥饿条件下酮体生成;肝脏中SIRT3 还可调控尿素循环,促进细胞内氨基酸代谢生成氨的解毒作用。SIRT3 在肝脏中主要参与物质的氧化分解,为细胞生理活动提供ATP,抑制富余营养物质如脂肪酸等在肝脏中的积累。结果显示,与物质和能量代谢密切相关的SIRT3 在肝脏、心脏及肌肉等代谢旺盛的组织中表达量相对较高[24],这与在猪SIRT3 肝脏组织中表达水平最高的结果相似[10]。同时在禁食期间,与野生型小鼠相比,敲除SIRT3 小鼠的脂肪酸代谢中间产物的浓度发生异常,肝脏中甘油三酯也明显增多,但其在肝脏中的脂肪酸吸收以及分解作用正常[25],这也从侧面说明SIRT3 基因在维持肝脏中脂肪正常代谢发挥重要作用。
4 结 论本研究显示,类乌齐牦牛SIRT3 基因编码区在生物进化中具有较高保守性,SIRT3 基因在肝脏、心脏、臀大肌均表达,且在肝脏中的表达量最高,为进一步阐明SIRT3 基因在肝脏组织中脂肪代谢奠定基础。
