碱性蛋白酶交联聚集体的制备及其催化性能研究
2019-06-17区晓阳曾英杰倪子富宗敏华娄文勇
区晓阳, 曾英杰, 彭 飞, 倪子富, 熊 隽, 宗敏华, 娄文勇,2,*
(1.华南理工大学 食品科学与工程学院, 广东 广州 510640;2.华南协同创新研究院 生物活性分子开发与应用创新中心, 广东 东莞 221116)
碱性蛋白酶作为一种重要的生物催化剂,属于丝氨酸内肽酶,是一类最适pH值为碱性的蛋白酶。碱性蛋白酶具有催化水解蛋白质的氨基酸酰胺键、酯键,并具有转酯和转肽的能力[1],能将一些蛋白质水解成多肽或氨基酸。碱性蛋白酶主要来源于细菌、酵母菌等微生物,具有产量大且蛋白分离纯化方便等优点,被广泛应用于食品、医药、酿造、丝绸等行业[2-4]。
游离碱性蛋白酶存在稳定性差、不可回收、产品分离困难等缺点,阻碍了其在工业上的应用,而酶的固定化技术可以克服这些障碍[5-7]。在固体载体上固定酶会导致非催化载体占据大量空间(约占总质量的90%~99%),从而降低体积活性、时空产率和催化剂生产率[8];此外,载体通常比较昂贵,且需要对惰性基质进行化学修饰后才能实现与酶的共价偶联。交联酶聚集体(CLEAs)是一种无载体固定化技术,通过对酶进行沉淀和加入交联剂(如戊二醛等)后,戊二醛的两个醛基分别与酶分子表面的氨基形成希夫氏碱反应,中间以5个碳原子连接在一起[9]。与有固体载体结合的固定化技术相比,CLEAs具有更突出的优势,催化剂具有高体积活性,这是因为避免了引入惰性载体而造成酶活性降低[10]。交联酶制备步骤简单(沉淀和化学交联)[11-12],出色的酶活回收率[13-14],无需高纯度酶[15],并且所得到的CLEAs对高温、有机溶剂和自保护水解造成的酶失活有很好的抵抗作用[16-18],从而表现出很高的存储稳定性和操作稳定性,使CLEAs得到广泛应用。此外,CLEAs负载酶量高,酶活性损失小,并能有效避免固体载体的引入造成酶失活[15]。聚集体制备成大分子的结构会影响酶与底物分子的接触,从而影响其催化活性,并且不同来源的酶对于制备CLEAs条件呈现较大的差异,这可能是其不具有普适性的原因,所以需要对制备条件(如沉淀剂的类型、浓度、交联时间等)进行系统优化,以期获取具有最高催化活性的CLEAs。
本研究拟对碱性蛋白酶进行沉淀,并加入交联剂进行交联,制备高效的碱性蛋白CLEAs,并对影响制备过程的因素进行系统研究;为了防止酶在沉淀过程中变性,利用糖作为稳定剂,辅助制备碱性蛋白酶CLEAs[19],以期获取更高的酶活回收率;研究碱性蛋白酶CLEAs水解催化酪蛋白的酶学性质,并与游离碱性蛋白酶的催化性质进行比较分析。
1 材料与方法
1.1 实验材料
地衣芽孢杆菌碱性蛋白酶(诺维信37071,180 U/mL),购于诺维信公司(丹麦);酪蛋白和戊二醛,购于Sigma公司。其他所有化学品纯度均为分析纯,并购买于生工生物工程(上海)股份有限公司。
1.2 实验方法
1.2.1碱性蛋白酶CLEAs的制备
向0.4 mL游离碱性蛋白酶中滴加一定量的沉淀剂(8种),将混合物在25 ℃下用磁力搅拌器搅拌5~30 min,直到碱性蛋白酶完全沉淀。将一定量的交联剂缓慢添加到混合物中,并在25 ℃下继续搅拌一定时间,然后将悬浮液在4 ℃、10 000 r/min离心10 min,去上清液。得到的沉淀用磷酸盐缓冲液(200 mmol/L,pH值7.5)清洗颗粒3次,再次离心得到沉淀并进行冷冻干燥处理,于4 ℃冰箱冷藏备用。
在沉淀过程中,使用糖来保护酶免受沉淀剂引起酶的过度脱水。40 mg的糖(包括葡萄糖、蔗糖、D-葡萄糖醇、半乳糖、三氯蔗糖和海藻糖)与100 μL游离酶混合后,在25 ℃、200 r/min下添加900 μL沉淀剂(叔丁醇、饱和铵或乙醇等),继续温浴30 min。
1.2.2酶活性和蛋白质浓度的测定
蛋白质浓度根据Lowry方法测定,并使用牛血清白蛋白为标准品[20]。以酪蛋白为底物,测定了游离酶和固定化碱性蛋白酶的活性。用紫外分光光度计测定280 nm下酪氨酸的释放量。一单位蛋白酶相当于释放1 μg酪氨酸/(mL·min)所需的酶量,固定化酶酶活回收率计算方法见式(1)。

(1)
1.2.3游离酶及其CLEAs的特性分析实验
以酪蛋白为模型底物,经碱性蛋白酶水解成为酪氨酸。研究游离酶和CLEAs的酶学性质,包括酶的最适温度和pH值及其稳定性,酶的动力学参数和重复使用稳定性。
1.2.3.1 最适温度和pH值的确定
将40 mg酪蛋白溶解于3.6 mL 200 mmol/L磷酸盐缓冲液(pH值7.8),并加入0.4 mL游离碱性蛋白酶或CLEAs,在不同温度(50~75 ℃)下测定游离碱性蛋白酶和CLEAs的最佳反应温度。在60 ℃(游离酶)和65 ℃(CLEAs)条件下,将酶加入不同pH值(7.0~9.0)的底物溶液中,分别测定最佳反应pH值。
1.2.3.2 酶的动力学参数测定
在优化的反应条件下,将具有相同酶活单位的游离酶和碱性蛋白酶CLEAs分别加入不同质量浓度的酪蛋白(1~11 mg/mL)中,测定酶对底物的亲和力(Km)和酶最大反应速度(Vmax),并根据Hanes-Woolf图计算表观Km和Vmax值。
1.2.3.3 酶的稳定性测定
热稳定性测定:在不同温度(50~70 ℃)下,将含有4.5 U/mL CLEAs或游离酶和10 mg/mL酪蛋白的4 mL磷酸盐缓冲液(200 mmol/L,游离酶pH值为7.5,CLEAs pH值为8.0)于磁力搅拌器中温浴搅拌反应4 h,测定样品中的剩余酶活性。
酸碱稳定测定:向4 mL不同pH值的磷酸盐缓冲液(200 mmol/L)中加入含有10 mg/mL酪蛋白和4.5 U/mL的CLEAs或游离酶,混合液在25 ℃搅拌反应4 h,按1.2.2方法测定酶样品的剩余酶活性。
1.2.3.4 酶的重复使用稳定性测定
将含有60 mg/mL酪蛋白的磷酸盐缓冲液(200 mmol/L,pH值8.0)放置于65 ℃下进行催化反应,重复8批次(每批次反应1 h)。在各批次中,通过离心(10 000 r/min,25 ℃)回收CLEAs,并使用磷酸盐缓冲液(200 mmol/L,pH值8.0)洗涤3次。将回收的CLEAs溶解在新的反应介质中,并将第一批CLEAs的相对酶活性定义为100%。
2 结果与讨论
2.1 碱性蛋白酶CLEAs的制备及电镜分析结果
2.1.1影响碱性蛋白酶CLEAs制备的因素分析
2.1.1.1 沉淀剂种类对碱性蛋白酶CLEAs制备的影响
CLEAs的制备包括聚集和交联两个步骤。在蛋白质水溶液中加入盐、有机溶剂、非离子聚合物或酸引起的聚集是蛋白质沉淀的常用方法。本研究采用乙腈、叔丁醇、乙醇、饱和硫酸铵、丙酮、甲醇、异丙醇和聚乙二醇(PEG)作为沉淀剂来制备CLEAs,并测定其酶活回收率。沉淀剂对碱性蛋白酶CLEAs的酶活回收率的影响如图1。总的来说,随着沉淀剂浓度的增加,酶活回收率增加。与甲醇、乙醇等沉淀剂相比,以含有90%叔丁醇的溶液作为沉淀剂,可获得碱性蛋白酶CLEAs的酶活回收率的最大值,达到91.6%。这是因为甲醇、乙醇等沉淀剂的极性强,剥夺了蛋白质表面的水化层,改变了酶的空间结构,使酶失活。沉淀条件的不同,制备得到的CLEAs的催化产率会有明显的差异[11,21]。

图1 不同沉淀剂对酶活回收率的影响Fig.1 Effect of different precipitants on enzyme activity recovery
2.1.1.2 糖作为沉淀辅助物对碱性蛋白酶CLEAs制备的影响
有研究表明,用糖作为辅助物能有效减少酶在沉淀过程中的活性损失[17,22]。在我们的研究工作中,多种糖已被用来保护酶因沉淀剂造成的过度脱水。以乙醇为沉淀剂时,酶活回收率较低,但糖加入对酶有一定的保护作用,可在一定程度上提高酶活回收率,见表1。与乙醇相比,以叔丁醇或饱和硫酸铵为沉淀剂时,糖辅助沉淀没有明显提高酶活性,可能是叔丁醇或饱和铵对酶活性损失影响较小。

表1 糖作为沉淀辅助物对聚集体重新溶解后
2.1.1.3 沉淀时间、交联剂浓度和交联时间对碱性蛋白酶CLEAs制备的影响
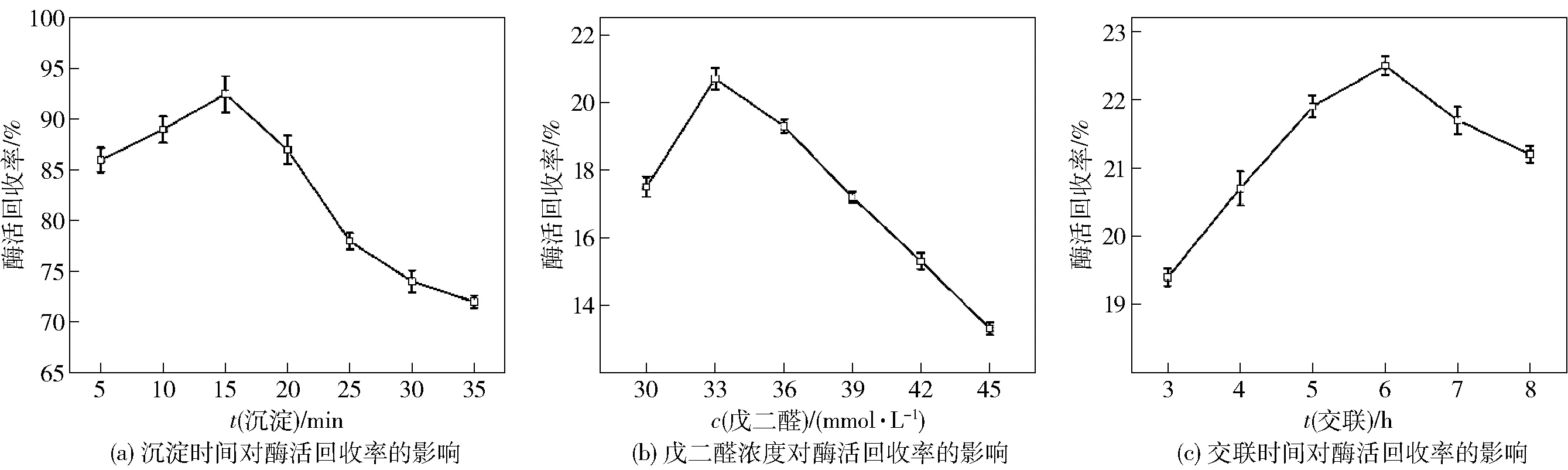
图2 多种固定化因素对酶活回收率的影响Fig.2 Effects of several immobilization factors on enzyme activity recovery of CLEAs
为了获得高效的碱性蛋白酶CLEAs,研究固定化过程中的关键参数(如沉淀时间、交联剂浓度和交联时间等)对酶活回收率的影响是非常重要的,实验结果见图2。图2(a)中,CLEAs酶活回收率随着沉淀时间的增加而增加,直至15 min,随后继续增加沉淀时间会使酶活回收率下降,这可能是由于酶在相对较长的沉淀时间(超过15 min)内部分失活所致。因此,将制备碱性蛋白酶CLEAs的最佳沉淀时间确定为15 min。
交联剂通常在制备固定化酶的过程中起重要作用[23]。戊二醛被用作固定多种酶的理想交联剂[24],因此本研究利用戊二醛作为交联剂来固定碱性蛋白酶以制备CLEAs。图2(b)中,在较低的戊二醛浓度下,酶活回收率相当低,这是因为碱性蛋白酶交联体的形成量少;但随着戊二醛浓度逐渐增加到33 mmol/L时,CLEAs的酶活回收率不断增加;戊二醛浓度进一步升高(超过33 mmol/L),酶活回收率下降,这可能是由于过量的戊二醛导致酶部分失活。所以,将制备碱性蛋白酶CLEAs的最佳戊二醛浓度确定为33 mmol/L。戊二醛对碱性蛋白酶的影响趋势与常见的实验结果[25]大不相同,这表明了交联时间过长会破坏酶的柔韧性,从而使酶活回收率降低。
图2(c)表明,酶活回收率随交联时间的增加而显著增加,直至6 h,继续延长交联时间则会使酶活回收率降低。这可能是由于在较长的交联时间(6 h以上)内,酶的部分失活所致。显然,碱性蛋白酶交联体制备的最佳交联时间为6 h。
对碱性蛋白酶制备过程中的影响因素分析表明,以体积分数为90%的叔丁醇作为沉淀剂,沉淀时间为15 min,交联剂浓度为33 mmol/L,交联时间为6 h时,碱性蛋白酶CLEAs的酶活回收率达最大值,为22.6%。
2.1.2电镜分析结果
CLEAs是一种多孔结构聚合物,所制备的交联体结构直接影响到酶的催化活性,如交联体的孔道直径会影响到酶与底物的接触面积和底物与产物进出孔道的快慢。为了更直接观察所制备的CLEAs形态特征,使用电子扫描电镜(SEM)对所制备的CLEAs表面特征进行观察(图3)。CLEAs表面层次分明,皱褶片状多,并有颗粒凸起,有许多大小不一的孔道,孔道直径介于1~2 μm,表明所制备的CLEAs表面积大,有利于酶与底物的接触。

图3 CLEAs的SEM图Fig.3 SEM images of CLEAs
2.2 游离酶及其CLEAs的特性分析结果
2.2.1酶的最适反应温度和pH值
酶的催化活性与反应温度和pH值密切相关,过高或过低都会影响酶的催化效率,因此,探索酶的最适反应温度和pH值对更好发挥碱性蛋白酶CLEAs的催化性能及其应用具有重要意义。反应温度和pH值对碱性蛋白酶CLEAs活性的影响见图4。游离碱性蛋白酶的最适温度为60 ℃,碱性蛋白酶CLEAs则为65 ℃(图4(a)),这可能是由于戊二醛引起了蛋白质间共价键的形成,增加了酶构象的刚性,进而防止酶因热交换而引起扭曲或破坏[26-27]。
pH值也是影响酶活性的主要参数之一。酶的固定化通常会导致酶的构象发生变化,从而导致最优pH值的变化。pH值对游离酶和CLEAs活性的影响见图4(b)。游离酶的最适pH值为7.5,交联后的碱性蛋白酶CLEAs则为8.0。pH值向碱性方向转移是由于偶联剂和酶之间的二次相互作用造成的。最适pH值的变化取决于酶和(或)基质的电荷,而戊二醛与酶偶联会将酶表面所有可用的氨基连接起来,因此酶表面的酸性基团会使酶蛋白带负电荷,最终将最佳pH值向碱性方向移动。
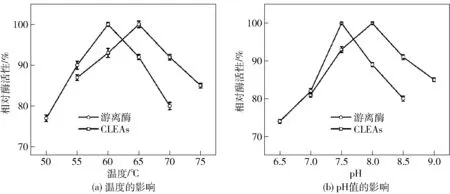
游离酶和CLEAs最高的酶活性定义为100%。图4 反应温度和pH值对游离酶与碱性蛋白酶CLEAs活性的影响Fig.4 Influences of various temperature and pH value on activity of free enzyme and alkaline protease CLEAs
2.2.2酶动力学研究结果
通过测定不同浓度酪蛋白在各最佳反应条件下(游离酶pH值7.5, 60 ℃;CLEAs pH值8.0, 65 ℃)的初始反应速率,比较了游离酶和碱性蛋白酶CLEAs的表观动力学参数,见表2。CLEAs的Km值(2.3 mg/mL)低于游离酶(3.6 mg/mL),说明CLEAs对底物的亲和力增强。CLEAs的Vmax为9.8 mg/(mL·min),低于游离酶的13.3 mg/(mL·min)。酶通过固定化后会造成其构象发生变化,使酶的活性位点更适合与底物结合[28]。CLEAs的催化效率(Vmax/Km)高于游离酶(3.7 min-1),说明CLEAs具有更高的催化效率。游离酶的活性位点具有不同的走向,但经过交联固定化后,酶的活性位点排列有序,更容易与底物结合,效率更高。
2.2.3酶的热稳定性和酸碱稳定性分析为了更好地了解固定化碱性蛋白酶CLEAs的特性,研究其在不同温度和pH值下的稳定性。图5(a)是CLEAs和游离酶在不同温度(50~70 ℃)下的稳定性情况。结果表明,CLEAs的耐热性强于游离酶。由于游离酶稳定性差,部分酶在高温下温浴4 h后迅速失活。在相对较高的温度(70 ℃)下,固定化碱性蛋白酶CLEAs的初始酶活性至少保留了70.2%,而游离酶的相对活性仅为41.1%左右。结果表明,CLEAs具有较高的耐热性,这可能与CLEAs中的共价键有关。
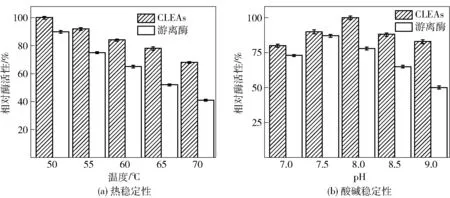
图5 CLEAs和游离酶的热稳定性和酸碱稳定性Fig.5 Stabilities of CLEAs and free enzyme under different buffer pH value and temperatures

酶制剂Km/(mg·mL-1)Vmax/(mg·(mL·min)-1)Vmax/Km/min-1游离酶a3.613.33.7CLEAsb2.39.84.3
a:最优反应条件为pH值7.5,60 ℃;b: 最优反应条件为pH值8.0, 65 ℃。
图5(b)表明,碱性蛋白酶CLEAs在pH值为7.0~9.0时,比游离酶更稳定。在所测定的pH值范围中,CLEAs的活性都要高于游离酶,而且,pH值越大,CLEAs的稳定性比游离酶越明显。CLEAs的酸碱稳定性有所提高,可能是由于酶聚集体之间的共价交联造成的[29]。
2.2.4固定化酶CLEAs的重复使用稳定性分析
碱性蛋白酶CLEAs的重复使用稳定性是衡量固定化酶优劣的关键因素,因此生物催化剂的重复使用性能是固定化酶的一个重要指标[30]。以生物催化水解酪蛋白为模型反应,研究了碱性蛋白CLEAs的重复使用实验,结果见图6。图6表明,在磷酸盐缓冲液中重复使用5批次和8批次后,碱性蛋白酶CLEAs的剩余酶活性分别保持在82.5%和56.5%以上。由于碱性蛋白酶CLEAs具有易分离、稳定性好、可重复利用等特点,在生物水解工业上将具有更大应用潜力。

图6 碱性蛋白酶CLEAs水解酪蛋白的重复使用稳定性Fig.6 Reuse stability of alkaline protease CLEAs for enzymatic hydrolysis of casein
3 结 论
通过对碱性蛋白酶固定化条件的优化,得到最佳沉淀剂为体积分数为90%的叔丁醇,最佳沉淀时间为15 min,最佳交联剂浓度为33 mmol/L,最佳交联时间为6 h,最大碱性蛋白酶CLEAs的酶活回收率为22.6%。下一步实验可以利用其他固定化方法(如磁性纤维纳米晶)对碱性蛋白酶进行固定化,进一步提高碱性蛋白酶酶活回收率。虽然实验过程中酶活回收率较低,但未固定上的碱性蛋白酶能用其他试剂(如饱和硫酸铵)沉淀析出,回收后可继续重复利用,减少酶的浪费。碱性蛋白酶CLEAs的催化性能(如最适催化温度和pH值)得到一定程度的提高,最适催化温度由60 ℃提高65 ℃,最适反应pH值也由7.5提高到8.0。不但如此,碱性蛋白酶CLEAs的热稳定性和酸碱稳定性也明显优于游离酶,且CLEAs的Km值(2.3 mg/mL)低于游离酶(3.6 mg/mL),这表明CLEAs对酪蛋白具有更高的结合能力,所制备的固定化酶更符合工业用酶的苛刻要求。此外,碱性蛋白酶的CLEAs具有良好的重复使用稳定性,重复利用5和8批次后,CLEAs的剩余酶活性还能保持82.5%和56.5%以上。所制备的碱性蛋白酶CLEAs在食品、医药、酿造等行业的具体应用有待进一步研究,但其简单的制备和回收步骤,优异的催化性能和稳定的操作性都表明,碱性蛋白酶CLEAs的优越性要高于游离酶,这将会使其在生物催化工业上具有更大的应用潜力。
