不同β-葡萄糖苷酶性能分析及对罗汉果苷的转化
2019-06-17李登科王欣驰陈雪佳李家霖胡小妍路福平
李登科, 王欣驰, 陈雪佳, 李家霖, 胡小妍, 路福平, 李 玉
(天津科技大学 生物工程学院/工业发酵微生物教育部重点实验室, 天津 300457)
罗汉果苷为罗汉果中研究最多的活性成分,具有消炎、止咳、护肝、降糖、抗疲劳、增强免疫等显著功能[1]。1983年,日本人竹本首次采用光谱和化学分析法鉴定了罗汉果醇及其甙的结构[2],之后陆续分离和鉴定出30多种甜味化合物罗汉果苷[3-4]。罗汉果苷V是成熟的罗汉果的主要成分,其甜度是蔗糖的250~400倍,在人体代谢过程中不需要胰岛素的参与[5],是肥胖以及糖尿病等不宜摄糖人群理想的糖替代品[6]。由于这些罗汉果苷均为葫芦烷型四环三萜类的衍生物,区别在于R1和R2两处所链接的葡萄糖基不同,因此结构上的相似性对其分离纯化造成了一定的干扰[7],加之罗汉果醇、罗汉果苷ⅢE、罗汉果苷ⅡE等在罗汉果中的含量少,导致其价格偏高,对其功能的深入研究也少有报道[8]。因此实现罗汉果苷的定向转化,生成特定的罗汉果苷及其类似物,为进一步探究其作用机制提供原料具有重要意义。
目前,罗汉果苷的获得主要通过从原料中直接提取、化学合成和酶法合成等方法[9]。从罗汉果中提取的罗汉果苷是市场上最常见的产品,但此类产品加工技术过于粗糙,技术指标也较为广泛,可信值大大降低。微生物酶法转化具有反应条件温和、专一性强、环境友好等优点[10]。β-葡萄糖苷酶可水解结合于末端的非还原性的β-D-葡萄糖苷键,释放出葡萄糖和相应的配基[11]。由于β-葡萄糖苷酶广泛的底物特异性,可作用于β-(1,1)、β-(1,2)、β-(1,3)、β-(1,4)和β-(1,6)糖苷键[12],有的β-葡萄糖苷酶还具有转移葡萄糖基的作用[13],因此可利用不同来源β-葡萄糖苷酶的底物特异性来进行罗汉果苷的转化,提高稀有结构罗汉果苷的含量,为罗汉果苷的功能研究奠定基础[14]。本研究拟利用毕赤酵母表达系统对不同来源的β-葡萄糖苷酶进行异源表达,并对其酶学性质进行分析,初步确定转化的最佳条件。以罗汉果苷Ⅴ为底物进行酶法转化,探究酶水解性能的差异和特异性,希望为酶法制备罗汉果苷及其结构类似物提供新的来源和途径。
1 材料与方法
1.1 实验材料
大肠杆菌JM109、毕赤酵母GS115、黑曲霉TCCC 41063和表达载体pPIC9K均为天津科技大学生物工程学院菌种保藏中心保藏。酵母粉、蛋白胨,购于Oxoid公司;质粒抽提试剂盒、DNA纯化试剂盒等,购于美国Omega公司;标准品罗汉果苷ⅢE、Ⅳ、Ⅴ,购于成都普瑞发科技开发有限公司。其他化学试剂均为国产分析纯。
1.2 主要仪器
Bio电击转化仪和S1000型PCR型基因扩增仪,美国Bio-Rad公司;MaxQ6000型恒温调速摇床,美国Thermo Scientific公司;TU-1810型紫外可见分光光度计,北京普析通用仪器有限责任公司;Milli-Q型超纯水系统,天津市奥佳科技有限公司。
1.3 实验方法
1.3.1重组菌株的构建
将不同来源的β-葡萄糖苷酶基因进行合成或采用PCR技术从实验室保藏菌种中扩增,得到目的基因。其中来源于特异腐质霉Humicolainsolens的β-葡萄糖苷酶基因(bglHi),来源于棘孢曲霉Aspergillusaculeatus的β-葡萄糖苷酶基因(bglAa),由苏州金唯智生物科技有限公司优化合成。黑曲霉Aspergillusniger来源的β-葡萄糖苷酶基因(bglAn)通过PCR扩增得到,其引物序列为:F:CGCGAATTCGCTGATGAATTGGCCTAC;R:CTAGCGGCCGCTTAGTGAACAGTAGGCAG。将目的基因与载体pPIC9K连接构建重组质粒,化转至大肠杆菌JM109。将构建正确的重组质粒线性化后电转至毕赤酵母GS115中,经G418筛选后,通过PCR验证转化子。
1.3.2β-葡萄糖苷酶的诱导表达
将重组菌株的单菌落分别接到30 mL YPG培养基中,30 ℃、180 r/min培养16~18 h;按2%接种量分别将种子液接入50 mL BMGY液体培养基中,30 ℃,180 r/min培养至OD600达到5~6(约16~20 h);收集菌液于灭菌的50 mL离心管中,8 000r/min,离心5 min,倒掉上清液,用20 mL BMMY培养基重悬菌体进行细胞洗涤,重复洗涤3次,最后用BMMY培养基重悬菌体(菌体终浓度OD600为1);饥饿1 h后开始添加诱导剂甲醇,每隔24 h加入0.5%甲醇诱导表达,并定时取样分析。
1.3.3β-葡萄糖苷酶活力的检测
以对硝基苯基-β-D-吡喃葡萄糖苷(pNPG)为底物,检测β-葡萄糖苷酶的酶活力。pNPG的水解产物为对硝基苯(pNP)和葡萄糖,pNP在400 nm下有特异的吸光值,可以进行比色测定。将反应体系中每分钟产生1 μmol pNP所需的酶量定义为1个酶活力单位(U)。
绘制pNP的标准曲线:配制0.1 mg/mL对硝基苯酚母液,分别稀释到质量浓度为0.002、0.004、0.006、0.008、0.010 mg/mL。以无菌水为空白,在400 nm下测定吸光度值。以OD600值为纵坐标,pNP质量浓度(mg/mL)为横坐标,做出pNP的标准曲线。
1.3.4不同来源β-葡萄糖苷酶酶学性质的分析
为了考察酶的最适温度、热稳定性、最适pH值和酸碱稳定性,按照1.3.3的方法在不同的温度(30、40、50、55、60、65、70、75、80 ℃)和pH(3.0、4.0、5.0、6.0、7.0、8.0)下测定酶的活力。将最高酶活力设为100%,计算各条件下的相对酶活力,以确定酶的最适温度和pH值。将酶置于酶的最适反应温度附近,恒温水浴处理10 h,每隔1 h测量酶的残留活力,以确定酶的热稳定性。将酶适当稀释于pH值为3.0~8.0的缓冲体系中,置于4 ℃冰箱保存12 h,在不同pH值条件下测量酶的残留活力,以确定酶的酸碱稳定性。
1.3.5不同来源β-葡萄糖苷酶水解罗汉果苷Ⅴ底物特异性分析
在酶的最适反应条件下,向10 mL的反应体系中加入2 U不同来源的β-葡萄糖苷酶(以100 ℃煮沸10 min的灭活发酵液上清液作为对照),以质量浓度为1 mg/mL和5 mg/mL的罗汉果苷Ⅴ(40%)作为底物进行反应,定点取样。绘制标准品罗汉果ⅢE标准曲线:配制1 mg/mL罗汉果ⅢE母液,分别稀释至质量浓度为0.2、0.4、0.6、0.8、1.0 mg/mL;以峰面积为纵坐标,罗汉果ⅢE的质量浓度为横坐标,绘制标准曲线。
HPLC检测条件:色谱柱为ZORBAX SB-Aq 4.6 mm×150 mm×5 μm;柱温为30 ℃;流动相为水(A相)和乙腈(B相);梯度洗脱程序为0~3 min 20%B,3~8 min 30%B,8~9 min 35%B;流速为0.8 mL/min;检测波长203 nm。
2 结果与分析
2.1 不同来源β-葡萄糖苷酶的克隆表达结果
2.1.1表达载体pPIPC9K-bgl的构建结果
将特异腐质霉、棘孢曲霉和黑曲霉来源的β-葡萄糖苷酶基因bglHi、bglAa和bglAn双酶切后,与相同酶切后的载体pPIC9K片段相连,化转至大肠杆菌JM109中,构建重组质粒pPIC9K-bglHi、pPIC9K-bglAa和pPIC9K-bglAn。用对应的限制性内切酶进行双酶切鉴定,结果如图1。泳道1显示,在约1 400 bp和9 300 bp位置分别出现两条电泳条带,与基因bglHi(1 443 bp)和载体(9 276 bp)的大小一致;泳道2和3显示出的约2 600 bp的条带分别与基因bglAa(2 597 bp)和bglAn(2 583 bp)的大小一致,说明目的基因已成功插入到载体中。

图2 重组转化子的高拷贝筛选Fig.2 High copies screening of recombinant strains

泳道1: pPIC9K-bglHi;泳道2: pPIC9K-bglAa;泳道3:pPIC9K-bglAn;M: 1kb DNA ladder。图1 重组质粒pPIC9K-bgl的双酶切鉴定结果Fig.1 Identification of there combinant plasmids by double enzymes digestion
2.1.2重组毕赤酵母菌株GS115/pPIPC9K-bgl的筛选鉴定结果
分别提取构建成功的重组质粒pPIC9K-bglHi、pPIC9K-bglAa和pPIC9K-bglAn,用SacI线性化,电转至毕赤酵母GS115感受态细胞中,涂布于MD营养缺陷型筛选板,30 ℃下培养2~3 d,至有单菌落产生。挑取重组毕赤酵母转化子分别接种于质量浓度为0.5、1.0、2.0 mg/mL的YPD/G418抗性筛选平板上,进行抗性复筛,挑取在高浓度G418下生长状态良好的单菌落,进行验证和诱导表达,重组菌株分别命名为P.pastoris/pPIC9K-bglHi,P.pastoris/pPIC9K-bglAa,P.pastoris/pPIC9K-bglAn。以P.pastoris/pPIC9K-bglHi为例,图2表明了重组菌株在不同浓度G418下的生长情况。挑取在G418质量浓度为2.0 mg/mL的YPD平板上菌落形态最大的单克隆,作为下一步的研究对象。
2.1.3不同来源β-葡萄糖苷酶的表达及酶活性分析结果
按照1.3.2的方法进行酶的诱导表达,发酵结束后离心取上清液,获得粗酶液。3种不同来源的酶分别命名为BglHi,BglAa和BglAn,利用12%SDS-PAGE分析酶的表达情况,结果如图3。泳道1为对照菌株GS115/pPIC9K的发酵上清液,泳道2为P.pastoris/pPIC9K-bglHi的发酵上清液,与泳道1相比,可见明显的蛋白条带,其表观分子质量约为60 kDa。泳道3和4分别为P.pastoris/pPIC9K-bglAa和P.pastoris/pPIC9K-bglAn的发酵上清液,蛋白质的表观分子质量约为135 kDa和120 kDa。采用软件DNAman对不同来源β-葡萄糖苷酶的氨基酸序列进行分析,预测其理论分子质量,结果显示:BglHi、BglAa和BglAn的理论分子质量分别为54.05、93.05 kDa和93.25 kDa,其理论分子质量均小于表观分子质量,这与毕赤酵母在表达分泌目标蛋白时会对其进行糖基化修饰有关[15-16]。按照1.3.3的方法,绘制pNP的标准曲线如图4,其线性回归方程为Y=39.43X-0.020 3;R2=0.998 9。以pNPG为底物,在pH值6.0、温度50 ℃的条件下,反应5 min,测得BglHi,BglAa和BglAn三种酶的酶活力分别为25.97、40.69、90.83 U/mg。

泳道1:P. pastoris/pPIC9K对照;泳道2:P. pastoris/pPIC9K-bglHi的发酵上清液;泳道3:P. pastoris/pPIC9K-bglAa的发酵上清液;泳道4:P. pastoris/pPIC9K-bglAn的发酵上清液;M:蛋白Marker。图3 重组毕赤酵母发酵上清液的SDS-PAGE分析结果Fig.3 SDS-PAGE analysis of recombinant β-glucosidase expressed in P. pastoris GS115
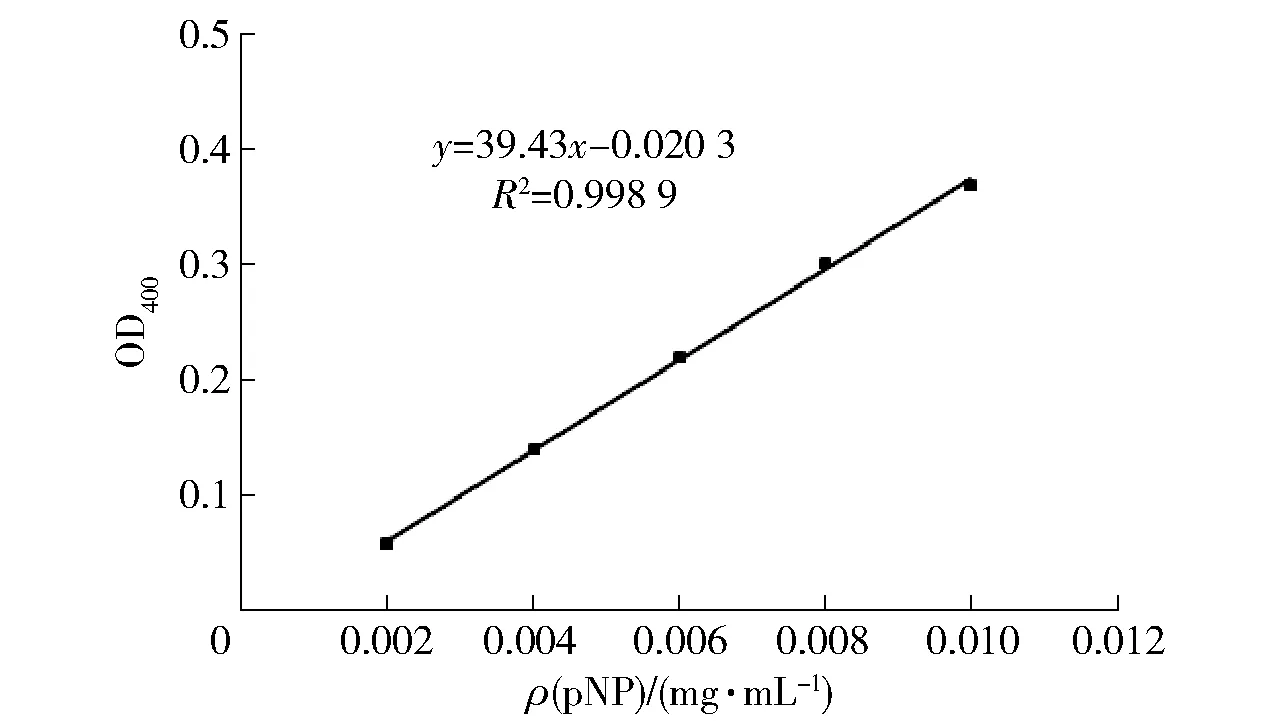
图4 pNP标准曲线Fig.4 Standard curve of pNP
酶活力计算公式见式(1)。
(1)
式(1)中,S:样品的酶活力,U/mL;X:pNP质量浓度,mg/mL;V1:反应液体积,mL;V2:酶液的体积,mL;t:反应时间,min;n:稀释倍数。
2.2 不同来源β-葡萄糖苷酶性质的测定结果
2.2.1温度对酶活力的影响
温度是影响酶催化反应的重要因素,为确定温度对不同来源β-葡萄糖苷酶的影响,按照1.3.4的方法测定了不同温度下β-葡萄糖苷酶的相对活力,以及在50、60、70 ℃下处理10 h后酶的相对活力随时间的变化,实验结果见图5、图6。由图5可以看出,BglHi、BglAn和BglAa的最适温度分别为55、60 ℃和65 ℃。由图6可知,这3种酶均能在50 ℃时维持较好的稳定性,在50 ℃下处理10 h均可保持50%以上的相对酶活性,而在60 ℃和70 ℃时其稳定性欠佳。

图5 不同来源β-葡萄糖苷酶的最适温度Fig.5 Optimum temperatures of different β-glucosidase
2.2.2pH值对酶活力的影响

图6 不同来源β-葡萄糖苷酶的热稳定性Fig.6 Thermo stability of different β-glucosidases
为了探究pH值对酶活力的影响,测定了不同pH值时酶的相对活力和在不同pH值时处理12 h后酶残余活力的相对值,实验结果如图7。图7中,BglHi、BglAn和BglAa的最适pH值分别为6.0、5.5和5.0,与Yan等[17]的研究结果一致。这一结果在一定程度上表明,β-葡萄糖苷酶多为酸性酶,而这一特性有利于其在食品饮品加工及纤维素水解等过程中应用,因为该过程多发生在pH值为4.0~6.0[18]时。图8显示了酶的酸碱稳定性,其中BglHi和BglAa的酸碱稳定性较好。在pH值为4.0~8.0的缓冲液下处理12 h,均可残留60%以上的酶活力,但BglAn在pH值为3.0~4.0时稳定性较差。
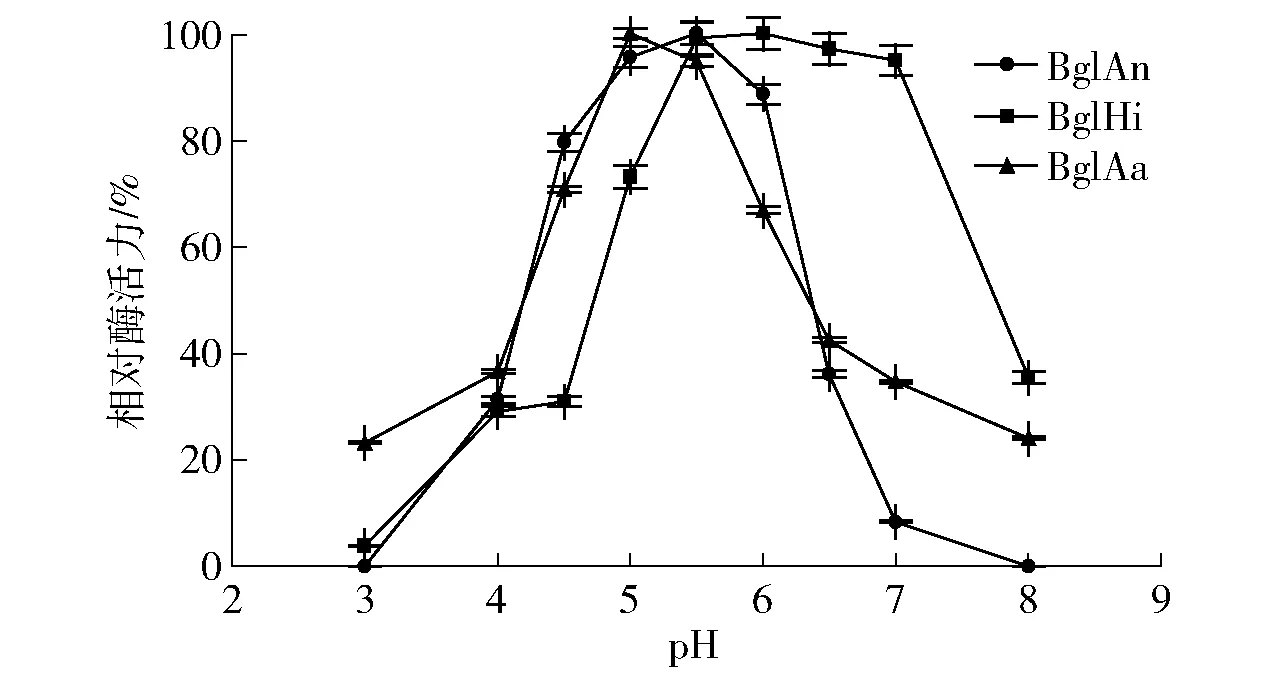
图7 不同来源β-葡萄糖苷酶的最适pH值Fig.7 Optimum pH value of different β-glucosidases
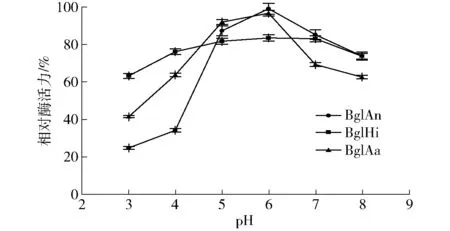
图8 不同来源β-葡萄糖苷酶的酸碱稳定性Fig.8 pH stability of different β-glucosidases
2.3 不同来源β-葡萄糖苷酶对罗汉果苷转化性能的比较
按照1.3.5的HPLC检测条件,绘制出罗汉果ⅢE的标准曲线,如图9,其线性回归方程为Y=2 806.2X+90.109;R2=0.999 2。检测了BglHi、BglAa、BglAn在以1 mg/mL和5 mg/mL的罗汉果苷Ⅴ(40%)为底物时的转化情况,实验结果见图10。以1 mg/mL的罗汉果苷Ⅴ(40%)为底物,在反应20 min时,均有转化产物罗汉果ⅢE的生成。BglHi和BglAa转化率分别为5.1%和6.37%。延长反应时间至12 h,未见其水解产物罗汉果ⅢE增多;然而BglAn将底物几乎完全转化为罗汉果ⅢE,转化率为96.5%,如图10(c)所示。增加底物罗汉果Ⅴ浓度,以5 mg/mL的罗汉果苷Ⅴ(40%)为底物,在反应30 min时,BglHi和BglAa转化率分别为6.23%和6.89%,延长反应时间至12 h,未见其水解产物罗汉果ⅢE增多;而BglAn在1 h内随反应时间的延长,产物罗汉果苷ⅢE明显增多,转化率依次为17.77% (5 min)、68.6% (30 min)、97.9% (1 h),如图10 (d~f) 所示。此结果可以证明,BglAn对罗汉果苷Ⅴ结构中3位和24位的β-1,6-糖苷键的专一水解性极强,可以有效地转化生成罗汉果苷ⅢE。

图9 罗汉果ⅢE标准曲线Fig.9 Standard curve of mogroside ⅢE

(a)罗汉果苷Ⅴ(6.068 min)、Ⅳ(6.735 min)、ⅧE(7.435 min);(c)BglAn转化1 mg/mL罗汉果苷Ⅴ; (d) (e) (f) BglAn转化5 mg/ml罗汉果苷Ⅴ。图10 转化产物的HPLC分析结果Fig.10 HPLC analysis of transformation products
3 结 论
利用毕赤酵母GS115表达系统对来源于特异腐质霉、棘孢曲霉和黑曲霉的β-葡萄糖苷酶基因bglHi、bglAa和bglAn进行了异源表达。对不同来源的β-葡萄糖苷酶的酶学性质进行了研究。比较发现,3种来源的酶最适温度均在55~65 ℃,并且在50 ℃下的稳定性均能保持在50%以上;3种酶的最适pH值范围在5.0~6.0,同时酸碱稳定性都能保持在80%以上。以罗汉果苷Ⅴ为底物,通过对不同来源β-葡萄糖苷酶转化性能的比较,发现来源于黑曲霉的β-葡萄糖苷酶BglAn在底物质量浓度为1 mg/mL时,20 min就可以将罗汉果苷Ⅴ几乎全部转化为罗汉果苷ⅢE,转化率为96.5%;将底物浓度由1 mg/mL提高到5 mg/mL,60 min时,转化率高达97.9%。另外两种来源的β-葡萄糖苷酶BglHi和BglAa,仅能转化生成少量的罗汉果苷ⅢE,转化率为5%~7%。由此可以证明:来源于黑曲霉的β-葡萄糖苷酶BglAn对罗汉果苷Ⅴ结构中3位和24位的β-1,6-糖苷键有极高的专一水解性,并且转化率极高,基本实现完全转化,这极大地降低了罗汉果苷ⅢE后期分离和纯化的难度,为实现罗汉果苷类物质的工业化生产提供了可能。
